FoxO1 经ATF6调控Hcy诱导的肝细胞凋亡
王青青,焦 运,吴欣妍,海秀玲,徐 龙,张 辉,郭 伟,郝银菊,姜怡邓,4,5
(宁夏医科大学 1.基础医学院、2.总医院感染科、3.药学院、4.宁夏血管损伤与修复研究重点实验室、5.国家卫生健康委代谢性心血管疾病研究重点实验室,宁夏回族自治区,宁夏 银川 750004)
高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)是由蛋氨酸代谢中胱硫醚β-合成酶(cystathionine β synthase,CBS)活性缺乏或减少导致同型半胱氨酸(homocysteine,Hcy)在体内的大量积聚造成的[1]。HHcy可参与肝硬化、慢性肾病和心脑血管等多种疾病的发生发展[2-3]。本课题组前期的多项研究表明,HHcy能够明显引起肝脏损伤[4-5]。细胞内诱导细胞凋亡的场所在内质网,而且过度的内质网应激会诱导细胞凋亡[6]。内质网应激在肝脏损伤中发挥重要作用,参与肝炎、肝硬化、肝癌等肝脏疾病中肝细胞凋亡的调控[7-8]。激活转录因子6(activate transcription factor 6,ATF6)作为内质网的传感器,当内质网(endoplasmic reticulum,ER)应激诱导非折叠蛋白反应(unfolded protein reaction,UPR)时被激活。ATF6在细胞中表达增加,进而调控促凋亡蛋白C/EBP同源蛋白(C/EBP homologous protein,CHOP)使得半胱氨酸天冬酰胺酶12(cysteine-containing aspartate-specific protease 12,caspase12)发生活化,促进细胞凋亡的发生[9-10],但是ATF6是否在Hcy诱导肝细胞凋亡中发挥调控作用未见报道。叉头框蛋白O1(forkhead box O1,FoxO1)是Fox基因家族的重要成员,广泛参与哺乳动物细胞增殖、分化、代谢和凋亡等生物学功能[11],在Hcy诱导的肝细胞凋亡中,DNA低甲基化是造成FoxO1表达上调的重要原因[12],但其机制尚不明确。因此,本研究以ATF6表达改变为切入点,探讨FoxO1在Hcy介导的肝细胞凋亡中的潜在机制,将为进一步研究肝损伤的发病机制提供理论依据。
1 材料与方法
1.1 主要试剂和仪器同型半胱氨酸(BCBV1026),购自Sigma公司;cbs+/-与cbs+/+实验小鼠由杰克逊实验室(Bar Harbor,ME)提供,饲养于宁夏医科大学动物中心。Annexin V-FITC/PI 细胞凋亡检测试剂盒(9009907),购自沈阳万类生物生物技术有限公司;蛋白提取试剂盒(P0013F)、蛋白定量试剂盒(20191101),购自上海碧云天生物技术有限公司;FoxO1(ab179450)、ATF6(ab227830)、Bcl-2 (ab32124)和Bax(ab32503)抗体,均购自Abcam公司;内参抗体β-actin(TA-09),购自北京中杉金桥生物技术有限公司;胎牛血清(2021472)和 RPMI 1640 培养液(812006),购自Gibco公司;超净工作台,购自苏州安泰有限公司;总RNA提取试剂盒(U8604),购自北京天根生物技术有限公司;ATF6,FoxO1引物由上海生工合成;逆转录试剂盒(AJ90851A)与qRT-PCR试剂盒(AJE1566A),购自宝日医生物技术(北京)有限公司;流式细胞仪,购自美国ACEA;普通PCR仪与qRT-PCR 仪,购自耶拿公司;CO2培养箱和5415D 型微量台式离心机,购自Eppendorf公司;BS110S 型精密天平,购自Sartoriu公司;垂直电泳仪和 Model680 全自动酶标仪,购自BioRad公司。
1.2 细胞培养人正常肝细胞株HL-7702,购自上海名劲生物科技有限公司。用含 10%胎牛血清的 RPMI 1640培养基培养,并将细胞置于37 ℃、5% CO2的培养箱中进行培养。当细胞密度增长至50%时,以0、100 μmol·L-1Hcy干预48 h的人肝细胞分别作为对照组和Hcy组,收集细胞用于后续实验。
1.2.1siRNA 转染肝细胞 转染前1 d,在400 μL的培养基(不加抗生素)中接种2×105个细胞。将 250 μL RPMI 1640 纯培养基和0.5OD 6.25 μL的siRNA(序列如Tab 1所示)混合,轻轻吹吸3-4次。再将250 μL 1640纯培养基与5 μL的 Lipofectamine 2000混合,轻轻吹吸3-4次,静置 5 min。将混合转染试和siRNA稀释液混合,轻轻吹吸3-4次,于室温下静置 20 min。将上述转染混合物加入培养瓶中,再加入1.5 mL纯培养基,轻摇培养瓶混合均匀。将培养瓶置于37 ℃,5%CO2培养箱中培养6 h,更换新鲜的培养基,并加入 Hcy 药物干预48h,进行后续其他实验。

Tab 1 FoxO1 and ATF6 siRNA sequences
1.2.2流式细胞仪检测肝细胞凋亡水平 用胰蛋白酶消化肝细胞,1 500g离心5 min,收集肝细胞,用4 ℃预冷的PBS将细胞洗涤2次,再次1 500g离心5 min收集肝细胞,用500 μL 1×Annexin V结合液悬浮细胞,其浓度大约为1 × 109cells/L。接着加入5 μL Annexin V-FITC和10 μL PI 染色液,轻轻混匀后置于避光处孵育15 min,并在1 h内用流式细胞仪检测肝细胞凋亡率。
1.2.3Western blot检测FoxO1、ATF6以及凋亡相关蛋白的表达 按照蛋白提取试剂盒配置的蛋白裂解液将收集的肝细胞裂解,使用BCA法对蛋白裂解液进行定量,将浓度定量的总蛋白加入适量的蛋白上样缓冲液煮沸5 min以彻底变性,经SDS-PAGE凝胶电泳,半干转至PVDF膜,并用5%脱脂奶粉封闭2 h,PBST洗膜10 min×3 次,与1 ∶1 000稀释的FoxO1、ATF6、Bax和Bcl2的一抗在4 ℃孵育过夜,PBST洗膜10 min×3 次,再与 1 ∶5 000稀释的辣根过氧化物酶标记的二抗室温孵育2 h,PBST洗膜10 min×3 次,采用ECL化学发光试剂显色,用Image Lab 软件分析检测结果的灰度值,计算目的条带灰度值与内参β-actin 灰度值的比值,进行结果分析。
1.2.4qRT-PCR检测FoxO1和ATF6的mRNA表达 按照总RNA提取试剂盒操作提取组织与细胞的总RNA,根据Gene Bank查询序列并交由生工设计引物,FoxO1(人源):Forward:GTACGCCGACCTCAT CACCAAG,Reverse:GCACGCTCTTCACCATCCACTC;FoxO1(鼠源):Forward:TGTCCTACGCCGACCTCAT CAC,Reverse:GCACGCTCTTGACCATCCACTC;ATF6(人源)Forward:GCGGAGCCACTGAAGGAAGATAAG,Reverse:TGTTTGAGTCTTGGGTGCTGCTG;ATF6(鼠源)Forward:TGCCTTGGGAGTCAGACCTATGG,Reverse:CTGTGGACCGAGGAGAGGAGATG。逆转录条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃ forever;qRT-PCR扩增程序95 ℃ 30 s 1x,95 ℃ 5 s 60 ℃ 34 s 40 x,Dissociation 95 ℃ 15 s,60 ℃ 1 min,75 ℃ 15 s,以内参作为对照,目的基因的相对量根据公式2-△△Ct,△△Ct=[Ct目的基因(待测样本)-Ctβ-actin(待测样本)]-[Ct目的基因(校正样本)-Ctβ-actin(校正样本)]。
2 结果
2.1 FoxO1在cbs小鼠肝脏及人源肝细胞中的表达情况qRT-PCR和Western blot 检测cbs+/+与cbs+/-小鼠肝脏中FoxO1 的mRNA和蛋白表达水平改变。结果显示,与cbs+/+相比,cbs+/-小鼠肝脏中FoxO1的mRNA与蛋白表达水平显著增加(P<0.01,Fig 1A,B)。使用100 μmol·L-1Hcy干预肝细胞48 h,模拟体外HHcy,接下来用qRT-PCR和Western blot检测FoxO1的mRNA与蛋白表达,结果显示,与control组相比,Hcy组FoxO1的表达显著增加(P<0.01,Fig 1C,D),提示FoxO1表达增加可能在Hcy诱导肝损伤过程中发挥关键作用,见Fig 1。

Fig 1 Expression of FoxO1 in hepatocytes detected by qRT-PCR and Western blotA:qRT-PCR was used to detect the FoxO1 mRNA expression in liver of cbs+/+ and cbs+/- mice(,n=8);B:Western blot was used to detect FoxO1 protein expression in liver of cbs+/+ and cbs+/- mice(,n=8);C:qRT-PCR was used to detect the FoxO1 mRNA expression in hepatocytes (±s,n=3).**P<0.01 vs cbs+/+group or control group.
2.2 FoxO1 siRNA敲低效率验证构建FoxO1的siRNA并转染肝细胞,qRT-PCR和Western blot检测FoxO1表达改变。结果显示,3组干扰片段均能引起FoXO1表达下调(Fig 2A,B),且以FoxO1-siRNA-1338(siFoxO1)效果最好,可用于后续试验。
2.3 敲低FoxO1抑制肝细胞凋亡转染FoxO1 siRNA至肝细胞后,且用 Hcy处理48 h。结果显示,与Hcy+si-NC组相比,Hcy+siFoxO1组Bax的表达显著降低(P<0.05,Fig 3A),Bcl2的表达显著增加(P<0.01,Fig 3A),同时流式细胞术显示肝细胞凋亡率显著降低(P<0.01,Fig 3B),提示FoxO1敲低可下调肝细胞凋亡水平。
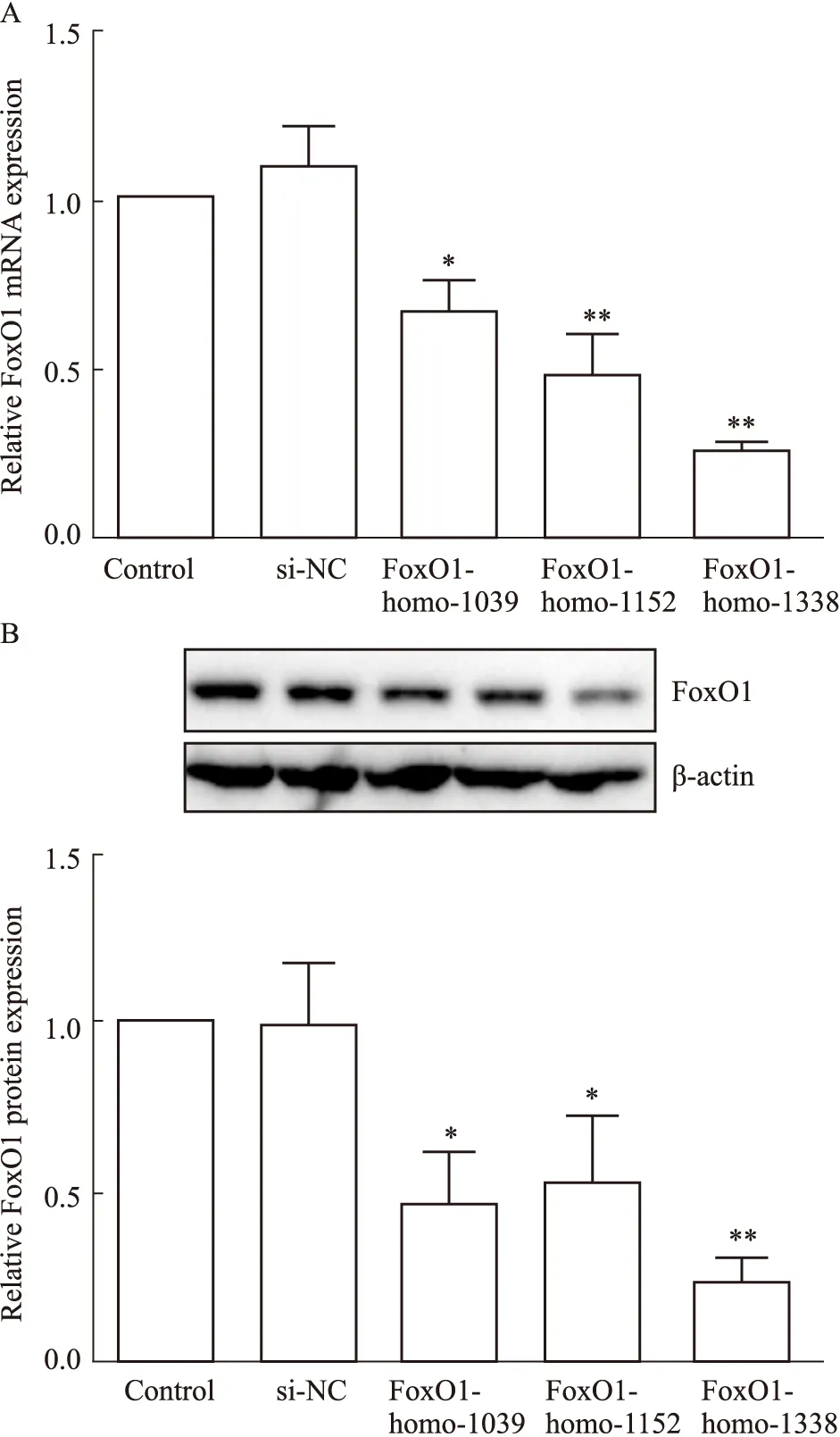
Fig 2 mRNA and protein expression of FoxO1 in hepatocytes detected by qRT- PCR and Western blotA:qRT-PCR was used to detect the FoxO1 mRNA expression in hepatocytes (,n=3);B:Western blot was used to detect FoxO1 protein expression in hepatocytes(,n=3).*P<0.05,**P<0.01 vs si-NC group.
2.4 FoxO1参与调控ATF6的表达改变ATF6作为内质网应激中未折叠蛋白反应致细胞凋亡的重要蛋白,为了验证其在肝细胞凋亡中的作用,首先采用qRT-PCR和Western blot检测小鼠肝脏组织和肝细胞中ATF6的表达。结果显示,与cbs+/+组相比,cbs+/-组肝脏组织中ATF6的表达明显增加(P<0.05,Fig 4A),同时Hcy处理的肝细胞中表达明显上调(P<0.01,Fig 4B),结果与动物水平保持一致。肝细胞转染FoxO1 siRNA后,qRT-PCR和Western blot检测ATF6的表达改变,与Hcy+si-NC组相比,Hcy+siFoxO1组ATF6表达显著降低(Fig 4C)(P<0.05),说明Hcy通过上调FoxO1促进ATF6表达进而激活内质网应激反应。

Fig 3 Hcy induced hepatocyte apoptosis inhibited by decreased FoxO1 expressionA:Western blot was used to detect Bcl2 and Bax protein expression(,n=3);B:Apoptotic rate of hepatocytes (,n=3).*P<0.05,**P<0.01 vs Hcy+si-NC group.

Fig 4 Expression of ATF6 in hepatocytes regulated by FoxO1A:qRT-PCR and Western blot was used to detect ATF6 expression in liver(,n=8);B:qRT-PCR and Western blot was used to detect ATF6 expression inhepatocytes;C:Hepatocytes were transfected with FoxO1 siRNA,Hcy to interfere with hepatocytes,and ATF6 expression was detected by qRT-PCR and Western blot(,n=3).*P<0.05,**P<0.01 νs control and Hcy+si-NC group.
2.5 FoxO1通过调控ATF6表达改变参与肝细胞凋亡调控为了进一步探讨FoxO1在调控肝细胞凋亡中的分子机制,构建ATF6 siRNA并转染肝细胞。qRT-PCR和Western blot结果显示,在引起ATF6表达下调的3个干扰片段中,siRNA-ATF6-homo-2105 (siATF6)敲低效果最佳,可用于后续试验(Fig 5A)。为证明ATF6在Hcy诱导肝细胞凋亡过程中的调控作用,将ATF6 siRNA 转染肝细胞,Western blot和流式细胞术分别观察肝细胞凋亡情况。结果显示,与Hcy+si-NC组相比,Hcy+siATF6组Bax蛋白表达显著降低(P<0.01,Fig 5B),而Bcl2蛋白表达明显增加(P<0.05,Fig 5B)。流式细胞术的结果显示肝细胞凋亡率亦显著降低,这与Western blot结果一致(P<0.01,Fig 5C)。为进一步的证明FoxO1通过调控ATF6的表达改变调控肝细胞凋亡,在Hcy干预的条件下,肝细胞分别转染FoxO1过表达腺病毒或转染FoxO1过表达腺病毒加ATF6siRNA,Western blot检测Bax和Bcl2的表达改变,结果显示,与Ad-FoxO1组相比,Ad-FoxO1+siATF6组Bax表达显著降低(P<0.05,Fig 5D),Bcl2的表达显著增加(P<0.05,Fig 5D)。以上结果说明,FoxO1通过调控ATF6表达改变调控Hcy诱导的肝细胞凋亡。

Fig 5 Hcy-induced hepatocyte apoptosis significantly relieved by down-regulation of ATF6A:Hepatocytes were transfected with ATF6 siRNAs,qRT-PCR and Western blot to detect ATF6 expression (,n=3);B:Hepatocytes were transfected with ATF6 siRNA,Western blot to detect Bax and Bcl2 expression (,n=3);C:Hepatocytes were transfected with ATF6 siRNA,observation of hepatocyte apoptotic rate by flow cytometry(,n=3);D:FoxO1 overexpression adenovirus or FoxO1 overexpression adenovirus plus ATF6siRNA in hepatocytes,Western blot to detect Bax and Bcl2 expression(,n=3).1:Control;2:si-NC;3:ATF6-homo-1734;4:ATF6-homo-2105;5:ATF6-homo-1038.*P<0.05,**P<0.01 νs control+si-NC group or Ad-FoxO1 group.
3 讨论
Hcy是一种含硫氨基酸,在生物体内硫醇新陈代谢中起到的关键作用。当血浆Hcy浓度高于15 μmol·L-1时,将会超出机体自身调节能力,使机体患有严重疾病,包括造血功能异常、阿尔茨海默病、神经毒性和肝脏损害等[13]。大量研究表明,肝脏正常情况下肝细胞很少发生凋亡,当肝细胞大量凋亡发生时,肝脏会出现明显的损伤,因此研究肝细胞的凋亡机制对于预防肝脏损伤至关重要。本课题组前期的大量研究表明,高同型半胱氨酸血症显著引起肝脏损伤,肝细胞凋亡在其中发挥了重要的调控作用,且采用不同浓度的Hcy处理体外培养肝细胞,发现肝细胞损伤随着Hcy浓度的增加而逐渐加重[4-5]。
FoxO1是体内重要信号传导途径中的关键调节剂之一。研究表明缺氧状态下颗粒细胞(granulosa cell,GC)中FoxO1的表达增加,通过JNK途径的细胞凋亡显著增加,敲低FoxO1表达后显著抑制缺氧暴露后GC的凋亡[14]。课题组前期的研究亦发现,FoxO1启动子区的低甲基化造成FoxO1的表达增加,可能在Hcy诱导的肝细胞内质网应激未折叠蛋白反应中发挥重要作用[12],但是抑制FoxO1的表达后,Hcy诱导肝细胞内质网应激未折叠蛋白反应致肝细胞凋亡是否会缓解,以及FoxO1通过何种途径缓解肝细胞凋亡均未知,基于此,本课题进行了大量研究,研究结果证明,Hcy能够显著促进FoxO1的表达,在抑制FoxO1的表达后,Hcy处理的肝细胞凋亡程度显著降低。内质网应激在诱导细胞凋亡过程中发挥着重要的作用,内质网应激未折叠蛋白反应主要由3条途径激活分别是:(1)PERK /eIF2α/ ATF4分支,二聚化和自磷酸化会激活PERK,导致eIF2α发生磷酸化并抑制蛋白质表达,eIF2α磷酸化后会促进转录表达因子4(activate transcription factor 6,ATF4)[15]。(2)IRE1 / XBP1分支,病理状态下IRE1与葡萄糖调节蛋白(glucose-regulated protein 78,GRP78)解键激活,并导致XBP1的进一步剪接。新产生的剪接XBP1(sXBP1)作为转录因子调节ER蛋白的表达[16]。(3)ATF6分支,当发生内质网应激时,ATF6从GRP78上解离,导致ATF6表达增加并易位至细胞核并诱导ER应激反应基因CHOP的表达,促进细胞凋亡[17]。本课题组前期的研究同样也表明,Hcy显著促进肝细胞发生内质网应激未折叠蛋白反应[5],也证明了Hcy促进肝细胞中ATF6的表达增加,FoxO1能够调控ATF6的表达,为进一步的证明ATF6途径在Hcy诱导肝细胞凋亡中的重要作用,Hcy干预肝细胞的状态下敲低ATF6的表达,发现Hcy引起的肝细胞凋亡显著降低,说明在内质网应激未折叠蛋白反应中ATF6途径发挥着重要的调控作用。在Hcy干预的基础上,过表达FoxO1,发现Bax的表达显著增加,Bcl2的表达降低,与此同时过表达FoxO1的同时敲低ATF6的表达,Bax的表达显著降低,Bcl2的表达增加,此时凋亡相关蛋白Bax和Bcl2的变化与只敲低ATF6的结果是一样的,与只过表达FoxO1的结果是正好相反的,这说明FoxO1必须经过ATF6才能发挥功能,提示ATF6在FoxO1在调控肝细胞凋亡过程中发挥着关键的作用。
综上所述,Hcy通过促进FoxO1的表达激活ATF6途径发生内质网应激未折叠蛋白反应造成肝细胞凋亡导致肝脏损伤,这为深入研究HHcy引起肝细胞凋亡提供了新的实验依据,而且为HHcy引起的肝损害提供了新的防治依据和治疗靶点。

