ApoA-Ⅰ模拟肽抗动脉粥样硬化的研究进展
贺春霞,李慧瑾,秦 魏,邢 露,周 鑫,赵 栋,李鹏权,金 曦,曹慧玲
(陕西省缺血性心血管疾病重点实验室,西安医学院基础与转化医学研究所,陕西 西安 710021)
心脑血管疾病是全球人类的首要杀手,动脉粥样硬化 (atherosclerosis,As) 是其主要病理基础,高血脂导致的脂质代谢紊乱,是引发As的独立危险因素[1]。高密度脂蛋白 (high density lipoprotein,HDL) 是脂代谢过程中的五大载脂蛋白之一,其功能主要是参与胆固醇逆转运(reverse cholesterol transport,RCT),即将外周组织中的胆固醇逆转运至肝脏,转化为胆汁酸或合成类固醇激素,促进胆固醇代谢,是机体排出多余胆固醇的唯一途径。同时,HDL可通过抗炎、抗氧化作用,维持内皮细胞完整性,保护内皮功能。因此,HDL在As发生发展中发挥重要保护作用,作为As和冠心病的保护因子受到广泛重视,以升高血液HDL水平为治疗策略的抗As药物开发一度成为热点。但是,烟酸受体激动剂和胆固醇酯转移酶抑制剂类药物研发的相继失利,提示单纯升高血液HDL为治疗策略抗As似乎不可行[2]。
HDL由载脂蛋白、胆固醇与调节因子组成,其载脂蛋白包括ApoA-Ⅰ和ApoA-Ⅱ,其中ApoA-Ⅰ是HDL的主要蛋白质成分,约占其蛋白质含量的70%。ApoA-Ⅰ在RCT中发挥关键作用[3],与As和冠心病发生呈负相关,是As与冠心病最重要的保护因素之一。靶向ApoA-Ⅰ研发的模拟肽,基于重组ApoA-Ⅰ研发的ApoA-Ⅰ米兰和HDL模拟肽表现出良好的促RCT与抗As作用,作为有潜力的抗As药物而备受关注。本文从ApoA-Ⅰ的结构和功能,ApoA-Ⅰ与ABCA1 (ATP-binding cassette transporter A1)、LCAT (lecithin cholesterol Acyl transferase)与SR-B1 (scavenger receptor class B member 1) 分子互作机制,靶向ApoA-Ⅰ类模拟肽抗As活性等方面进行了综述,以期为ApoA-Ⅰ模拟肽类抗As新药研发提供参考。
1 ApoA-Ⅰ的结构与功能
1.1 ApoA-Ⅰ的结构目前研究热点主要集中在盘状和球状HDL结构上,对于ApoA-Ⅰ结构研究甚少。ApoA-Ⅰ由267个氨基酸组成,氨基酸1-18构成信号肽,氨基酸19-267称作ApoA-Ⅰ前体,由243个氨基酸 (25-267) 构成的肽段称为成熟ApoA-Ⅰ,是构成HDL的主要成分[4]。
在成熟ApoA-Ⅰ中,推测氨基酸1-43的肽段负责蛋白间互作,其余氨基酸构成10个串联α螺旋,其中两个α螺旋由11个氨基酸构成,另外8个α螺旋由22个氨基酸构成,为脂质结合区,决定了盘状HDL的直径 (Tab 1)[5]。ApoA-Ⅰ在体内有不载脂、少载脂和载脂3种存在形式。Mei等[6]采用X-射线衍射法研究ApoA-Ⅰ的结构发现,C端 (氨基酸185-243) 可形成一个半圆二聚体,该二聚体骨架由两个反向平行的由脯氨酸连接的5个纵向AB型螺旋构成,而N端与之相对应区域形成四个螺旋束,中心弹性区域由两个反向平行的螺旋 (helix5/5)构成。基于这项研究,Gursky[7]提出了HDL的“双带模型”:双带中心部分是氨基酸66-184构成结构保守的恒定区,而N端氨基酸1-65和C端氨基酸185-243为可变区,在HDL成熟过程中可发生重排。随着双带周围包含氨基酸G65-P66和G185-G186铰链的摆动,这些铰链区对应不同大小的DHL颗粒,与N-端结合的包含氨基酸G39与G65两个柔韧区逐渐解离,带逐渐延长,赋予HDL二维表面曲率到球型表面。而ApoA-Ⅰ的这一结构特征与不同大小HDL的形成密切相关。Kontush等[4]提出每个HDL球形粒子可包含3-5个ApoA-Ⅰ分子,并进一步建立了不同大小HDL球形粒子的模型 (Fig 1)。

Tab 1 The functional segments in ApoA-Ⅰ
随后,Mei等[8]又研究了ApoA-Ⅰ C端结构发现,helix10 可能负责脂质结合与聚集启动,胆固醇外排,在HDL形成过程中发挥至关重要作用。Ray等[9]研究发现,在ApoA-Ⅰ中加入生理浓度胆固醇后,由C端特定胆固醇结合位点和N端新胆固醇结合位点驱动的剧烈结构扰动,促使单体蛋白自发形成圆形构象。由此推测,ApoA- I以阶段性方式打开,结构变化是由特定胆固醇与ApoA-Ⅰ互作导致,而不是非特异疏水效应引起。由此可见,C端结构域对于ApoA-Ⅰ与脂质结合启动、驱动HDL形成具有重要作用。
1.2 ApoA-Ⅰ的功能
1.2.1ApoA-Ⅰ在RCT中的作用 HDL最主要功能是参与RCT,HDL代谢过程实质是由ApoA- I与其他脂蛋白参与的脂质运输和代谢过程。首先,胆固醇和其他脂质通过ABCA1与空载ApoA-Ⅰ结合,形成包含两个ApoA-Ⅰ拷贝的盘状HDL,然后LCAT结合到ApoA-Ⅰ使胆固醇酯化,使盘状HDL变为成熟球形HDL。最后,HDL携带脂质通过肝HDL受体SR-B1清除,剩下空载ApoA-Ⅰ (Fig 2)。因此,ApoA- I不仅是脂质和胆固醇在亲水环境中的穿梭支架,同时也是HDL成熟与脂蛋白颗粒间通讯的锚定中心[10]。

Fig 1 Development of trefoil model for a spherical particle from double belt of ApoA-Ⅰ
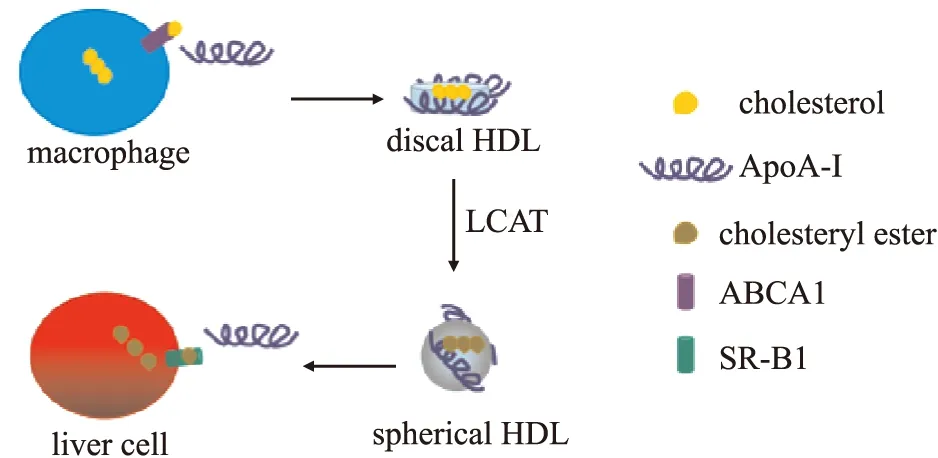
Fig 2 Diagram of ApoA-Ⅰ removing cholesterol by RCT
1.2.2ApoA-Ⅰ的抗炎作用 在新西兰白兔颈动脉急性炎症造模后,单次低剂量灌注ApoA-Ⅰ可减少中性粒细胞浸润,抑制中性粒细胞活化[11]。ABCA1和ABCG1 受体缺失小鼠的白细胞明显增多,且出现了可移植的骨髓增生性疾病,ApoA-Ⅰ过表达可抑制该现象,表明ApoA-Ⅰ具有抗炎作用,可抑制炎性反应[12]。研究表明,ApoA-Ⅰ可通过多种机制发挥抗炎作用。如ApoA-Ⅰ可以通过ABCA1,减少脂质筏丰度,降低CD11b表达水平,从而抑制中性粒细胞的激活、迁移和粘附。另一种抗炎机制指出,ApoA-Ⅰ/HDL可降低巨噬细胞炎性小体成分表达,如 NLRP3 (NLR family pyrin domain containing 3)、IL-1以及caspase 1,发挥抗炎作用[12]。
1.2.3ApoA-Ⅰ在抗氧化、细胞增殖等方面的作用 Miroshnichenko等[13]研究了ApoA-Ⅰ在有害条件 (饥饿、缺氧条件和H2O2氧胁迫)下对骨髓间充质干细胞 (mesenchymal stem cells,MSCs) 存活和增殖率的影响。首次发现ApoA-Ⅰ可降低细胞内活性氧簇 (reactive oxygen species,ROS),促进MSCs增殖,增加氧化条件下的细胞数量。缺氧条件下,MSCs处于G0/G1期时,ApoA1不影响其细胞周期,在MSCs向充氧或氧化状态过渡时,ApoA-Ⅰ可快速激活细胞增殖,减少细胞凋亡。ApoA-Ⅰ可在各种不利条件下保护细胞,提高Ⅱ型糖尿病 (T2D) 患者MSCs的移植效率。提示ApoA-Ⅰ具有抗氧化和促进MSCs细胞增殖活性,在糖尿病预防和治疗方面也具有开发潜力。
2 ApoA-Ⅰ的分子互作机制
2.1 ApoA-Ⅰ与ABCA1互作在RCT过程中,ApoA-Ⅰ载脂的起始需要ABCA1辅助,是RCT的限速步骤。ABCA1可将脂质转运给多种参与HDL形成的脂蛋白,如ApoA-Ⅰ、ApoA-Ⅱ、ApoC、ApoE-3、ApoE-4[14]。ApoA-Ⅰ和ApoA-Ⅰ模拟肽5A可动员ABCA1+/+巨噬细胞沉积的胆固醇微区,而无法动员ABCA1-/-巨噬细胞沉积的胆固醇微区,说明这种动员依赖于巨噬细胞ABCA1,而一旦ApoA-Ⅰ模拟肽5A与磷脂复合,即使在没有ABCA1的情况下,也可动员巨噬细胞沉积的胆固醇微区。说明ABCA1对于启动ApoA-Ⅰ载脂至关重要[15]。研究表明,缺乏helix 10的ApoA-Ⅰ截短体无法促进胆固醇外排,线性阵列排列的两亲性α螺旋是促进ABCA1胆固醇外流所所必需的结构原件[16]。但空载ApoA-Ⅰ是如何获取来自ABCA1转运的游离胆固醇和磷脂来启动球形HDL形成,ApoA-Ⅰ与ABCA1的分子互作机制还有待进一步研究。
2.2 ApoA-Ⅰ与LCAT互作ApoA-Ⅰ对LCAT的活化具有重要作用。Cooke等[17]研究发现,完整的LCAT活性需要一个ApoA-Ⅰ分子上的helix5-7和另一个ApoA-Ⅰ分子上的helix3-4组成的杂交表位。提示ApoA-Ⅰ helix3-7对LCAT催化胆固醇酯化过程具有重要作用。在上文提到的“双带模型”中,两个反向平行的ApoA-Ⅰ分子通过helix5/5形成一个与脂质结合的通道,这个通道两端有两个带正电的精氨酸R123。Gorshkova等[18]提出,这两个特殊定位的精氨酸R123直接参与了LCAT催化胆固醇酯化过程。基于此假设,Gorshkova等制备了R123A与R123E的ApoA-Ⅰ突变体,研究表明,虽然R123突变没有改变HDL颗粒组成和大小,也没有改变蛋白质构象和稳定性,但是,R123的两种突变均显著降低了LCAT的催化效率和胆固醇酯形成的表观Vmax,对LCAT磷脂水解无影响。可见ApoA-Ⅰ在盘状高密度脂蛋白上的R123对LCAT介导的胆固醇酯化反应催化效率具有重要作用。
2.3 ApoA-Ⅰ与SR-B1互作LCAT催化HDL-胆固醇酯化,形成成熟的球状HDL,而后HDL-胆固醇酯可被肝脏清道夫受体SR-B1摄取,使胆固醇酯在肝脏内进一步代谢,排出体外[10]。SR-B1是跨膜蛋白,包含1个高糖基化的胞外结构域和2个胞内尾巴,胞外结构域由两个跨膜结构域锚定在细胞膜上。为了促进胆固醇运输,HDL和SR-B1必须形成一种特定“复合物”,HDL以精确构象与SR-B1胞外结构结合,实现高效脂质运输,而ApoA-Ⅰ helix4-6对于该过程具有重要作用[19]。最近关于SR-B1结构研究显示,SR-B1的C端跨膜结构域含有1个亮氨酸拉链结构,当其发生突变时,会削弱受体与HDL结合及其介导的胆固醇传递能力,这与SR-B1不能形成二聚体有关,同时还发现SR-B1胞外结构域的近膜区可能与脂质表面相互作用,促进SR-B1的胆固醇转运功能[20]。
3 靶向ApoA-Ⅰ的模拟肽ApoA-Ⅰ是HDL的主要成分,是胆固醇的重要载体,血浆HDL从外周组织接收游离胆固醇,在LCAT催化下转变成胆固醇酯。同时,ApoA-Ⅰ还是HDL受体的配体,可触发胆固醇酯向肝细胞转运和代谢。基于ApoA-Ⅰ在胆固醇代谢中的重要作用,ApoA-Ⅰ一直是抗As药物研发的研究热点。然而,由于高昂的人工合成成本以及缺乏口服给药方式,ApoA-Ⅰ本身作为药物制剂的开发受到严重限制。所幸,以ApoA-Ⅰ为靶标开发的ApoA-Ⅰ模拟肽和ApoA-Ⅰ Milano表现出良好的促RCT与抗As作用,作为有潜力的抗As药物而备受关注。
3.1 ApoA-Ⅰ模拟肽α螺旋是ApoA-Ⅰ发挥功能的结构基础,因此,科学家们模拟ApoA-Ⅰ的α螺旋合成了不同氨基酸组成的α螺旋模拟肽(Tab 2)。18A是人工设计合成的第一个ApoA-Ⅰ单α螺旋模拟肽,该18A肽具有疏水氨基酸 (W,L,A,F,Y,V),在极性表面具有亲水性氨基酸 (D,E,K,R),在极性/非极性界面上有带正电荷的赖氨酸,在极性面中心有带负电的D或E。在18A基础上,科学家们进一步设计了F系列单α螺旋模拟肽以及基于两个18A的双螺旋模拟肽,如37pA等。几种小鼠模型研究发现,模拟肽6F具有抗氧化和抗炎特性,用表达6F的转基因番茄喂养LDLR-/-小鼠,治疗13 W后,与对照相比,改善了炎症和抗氧化的系列生物标志物,显著降低了主动脉病变面积[21]。5A是在37pA基础上改良ApoA-Ⅰ模拟肽,细胞毒性较低,可通过ABCA1特异性地诱导胆固醇外排,具有抗炎和抗氧化特性,5A还可减少哮喘小鼠模型中的气道炎症[22]。ATI-5261是Bielicki等人开发的一种由36个氨基酸组成的肽,可形成一个具有双亲性的单螺旋结构,可诱导ABCA1介导的胆固醇外排。与安慰剂组相比,经ATI -5261治疗的小鼠主动脉病变面积和斑块脂质含量显著降低,同时随粪便排泄甾醇增加,表明在ATI-5261治疗促进RCT,促进了胆固醇排泄[23]。目前,ApoA-Ⅰ模拟肽ETC-642、L-4F和D-4F进入了临床Ⅰ期试验。研究表明,其具有良好的安全性和耐受性。4F的两个临床实验由于在保护LDL诱导的单核细胞趋化性的结果上相矛盾,诺华公司终止了4F的进一步研究。ETC-642是一种由22个氨基酸肽组成的复合物,它可形成一个双螺旋结构,研究发现,ETC-642具有良好的促进胆固醇外排,抗炎和抑制斑块形成的作用[24]。

Tab 2 ApoA-Ⅰ mimic peptide

PeptideCholesterolefflux 35ELK-1AEKLKELLEKLLAKLKELL-P-EKLKELLEK-LLAKLKELL22c36ELK-1FEKFKELLEKLLEKLKELL-P-EKFKELLEK-LLEKLKELL50c37ELK-2A2K2EEKLKAKLEELKAKLEELL-P-EKLKAK-LEELKAKLEELL75c38ELK-3E3EKEELKELLKELLKKLEKLL-P-ELKELLKELLKKLEKLL84c39ELK-2E2KEELKKLLEELLKKLKELL-P-EE-LKKLLEELLKKLKELL69c40ELK-PAEKLKELLEKLLEKLKELL-A-EKLKELLEK-LLEKLKELL38c41ELK-P2AEKLKELLEKLLEKLKELL-AA-EKLKELLE-KLLEKLKELL65c42ELKAEKLKAKLEELKAKLEELL-P-EKAK-AALEEAKAKAEELA0c43ELKA-CH2EKLKAKLEELKAKLEELL-P-EHA-KAALEEAKCKAEELA0c445A-CH1DHLKAFYDKVACKLKEAF-P-DWA-KAAYDKAAEKAKEAA0c455A-CH2DWLKAFYDKVAEKLKEAF-P-DHA-KAAYDKAACKAKEAA61c465A-C1DWLKAFYDKVACKLKEAF-P-DWA-KAAYNKAAEKAKEAA34c475A-H1DHLKAFYDKVAEKLKEAF-P-DWA-KAAYDKAAEKAKEAA48c
目前,模拟肽功能研究包括体内和体外研究。体内功能研究主要是利用模型动物如高脂血症家兔、LDLR-/-小鼠、ApoE-/-小鼠等进行高脂饮食造模,然后通过腹腔注射药物来检测主动脉病变面积、斑块脂质含量以及粪便甾醇外排等。体外功能研究主要是细胞毒性、胆固醇外排、抗炎抗氧化作用评价等,目前尚无统一评价标准。D’souza等研究了22种不同双螺旋ApoA-Ⅰ模拟肽 (17种ELK模拟肽和5种5A模拟肽) 对胆固醇外排能力和特异性,对单核细胞和内皮细胞炎症反应的抑制作用,对LDL氧化的抑制作用。结果表明,没有一种模拟肽在所有抗As功能的各方面都表现优良,不同抗As功能主要受特定结构特征的影响。平均疏水性、电荷量、疏水面大小和螺旋间连接角度是决定胆固醇流出效率和特异性的主要因素,疏水表面电荷和大小是影响抗炎性能的主要因素,半胱氨酸和组氨酸的存在是决定抗氧化性能的主要因素[25]。ApoA-Ⅰ模拟肽的构效关系研究,对于ApoA-Ⅰ模拟肽设计和改造具有重要指导意义。
3.2 基于重组ApoA-Ⅰ的HDL模拟肽除了上述基于ApoA-Ⅰ α螺旋研发的模拟肽,利用重组ApoA- I和磷脂类脂质组成的HDL模拟肽也取得了一定进展(Tab 3)。ApoA-Ⅰ Milano是一种人源的自然突变,该突变携带者特征是HDL-C水平降低,而没有预期的CVD风险增加。与ApoA-Ⅰ相比,ApoA-Ⅰ Milano可诱导更多ABCA1介导的胆固醇外排,同时还具有优良的抗炎和斑块稳定特性[38]。动物模型证实,ApoA-Ⅰ Milano短期灌注,可促进As斑块消退[26],由此研发的ETC-216已进入二期临床实验。在II期临床试验中,在急性冠脉综合征 (ACS) 后的一小群患者中,应用ETC-216后,采用血管内超声 (IVUS) 检测发现,冠状动脉粥样硬化显著消退。但是,严重免疫刺激副作用阻碍了对ETC-216的进一步评价研究。MDCO-216,一种ETC-216改良肽,可消除不良免疫刺激,但其对动脉粥样斑块的治疗效果也大大减弱[27]。目前尚无对ApoA-Ⅰ Milano的进一步研究报道。CSL-112是一种由ApoA-Ⅰ和磷脂组成的重组HDL,其前体分子CSL-111由于高肝毒性而暂停研究。CSL-112的一期和二期临床研究已经完成,结果表明,其可显著增强胆固醇外流,具有良好耐受性,无明显脏器毒性或免疫原性,目前已进入三期临床研究[28]。CER-001是一种初生HDL模拟肽,由重组ApoA-Ⅰ和双磷脂酰甘油及鞘磷脂两种磷脂组成,CER-001对于冠状动脉粥样硬化患者的改善作用具有剂量依赖性,表现为U型剂量曲线,建议使用3 mg·kg-1剂量。在家族性低α蛋白血症患者中应用已进入三期临床试验[29-30]。
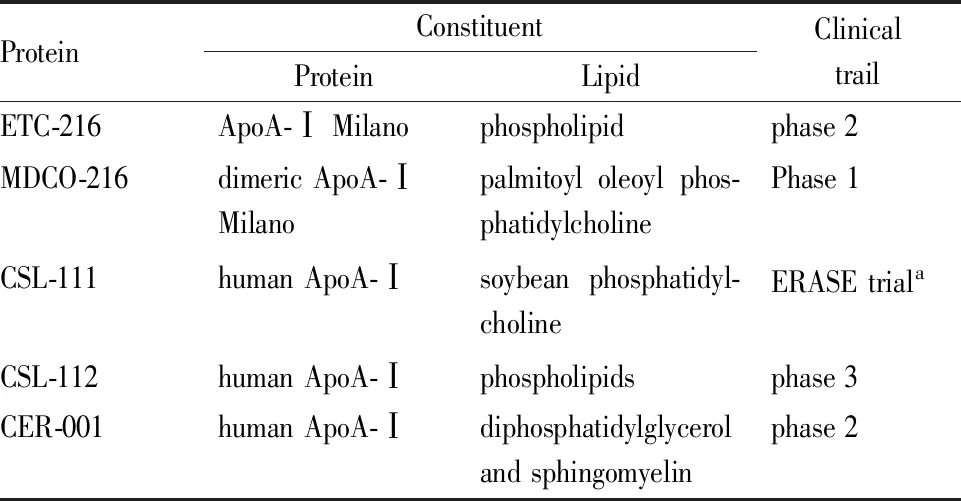
Tab 3 ApoA-Ⅰ based reconstituted HDL mimics
4 结语
ApoA-Ⅰ作为HDL的主要蛋白成分,在RCT过程中发挥关键作用。虽然目前尚无成熟药物上市,但基于ApoA-Ⅰ结构和功能研发的模拟肽类药物表现出良好的促RCT与抗As活性,具有广阔的开发和应用前景。由于ApoA-Ⅰ单体及HDL不同成熟阶段的结构尚未解析,基于结构与功能的研究还有待进一步完善。不同成熟阶段HDL与其载脂的分子作用机制尚不明确,导致ApoA-Ⅰ类模拟肽主要集中在表型功能方面的研究,缺乏药物作用分子机制探索,给ApoA-Ⅰ类模拟肽药物研发推进带来一定困难。同时,目前也有基于ABCA1、LCAT和SR-B1等与HDL互作机制的药物研发,也面临类似困难。此外,对于ApoA-Ⅰ类模拟肽类药物,缺乏科学全面的药效评价体系,有待深入研究解决。未来随着ApoA-Ⅰ和HDL结构和功能的深入研究,RCT相关分子互作机制的深入阐释,必将促进基于ApoA-Ⅰ结构和功能的模拟肽类抗As药物研发,造福人类健康。

