TiO2光催化氧化脱盐电池系统去除海水中PAHs效果研究
卢家磊,董奕岑,徐成龙,张饮江,2
(1.上海海洋大学 海洋生态与环境学院,上海 201306;2.水域环境生态上海高校工程研究中心,上海 201306)
淡水资源在世界资源储备上占有极其重要的战略地位,但随着人口增加、环境破坏与水质恶化,可用的淡水量已不足全球水资源总量的0.01%。为缓解淡水资源压力,海水淡化工程逐渐成为增加淡水量的重要手段[1-3]。但人类生活生产的污废水大多都经径流排流入海,致使大量不同种类的污染物汇集并于海水中混合,引发二次污染[4-5]。多环芳烃(PAHs)作为海水中的污染物之一,其具有毒性强[6-7]、难降解[8-9]等特性,多溶于海水中与淤积于底泥中,不仅污染水质[10-11],还破坏底泥生态环境[12],严重危害水域生态健康与物种多样性,并诱发生物体致癌、致畸[13-14]。目前,处理工艺主要由物理与化学耦合形成[15],但都存在去除效率低、去除不彻底等情况[16-17]。TiO2光催化氧化技术已成为一种新型的PAHs处理手段[18-19]。本研究通过构建TiO2光催化脱盐电池系统[20-21],将海水中PAHs降解与新型脱盐技术相结合,以串联脱盐电池的形式对PAHs的去除进行了探究,为PAHs处理工艺的拓展和脱盐系统的耦合提供相应参考。
1 实验部分
1.1 材料与仪器
海水,取自采样点(121°93′E,30°86′N)的海水样品5 L用玻璃瓶封装,置于4 ℃冰箱中保存,盐度为20.02 g/L,PAHs浓度为723.72 ng/L;NaOH、HCl、CH3CH2OH、钛酸丁酯、HNO3、CH3COOH均为分析纯;PE离子交换膜;粉煤灰(来自河南省某火电厂),成分见表1。

表1 粉煤灰成分Table 1 Composition distribution ratio of fly ash
FE-30K电压记录仪;GC-MS/MS气相色谱-质谱联用仪;CM-230N盐度计;Thermo Scientifc Orion 5-Star pH计;柯迪达CT3031笔式电导率仪水质测试笔。
1.2 TiO2沸石催化剂制备
1.2.1 粉煤灰沸石制备 采用碱融-水热反应法制备粉煤灰沸石[22]。对含铁矿的粉煤灰进行酸洗处理[23],将粉煤灰和2 mol/L的HCl以3∶1混合,在 93 ℃ 搅拌酸洗1 h,水洗至pH为7左右,烘干。将预处理后的粉煤灰和NaOH固体以1∶1.2的质量比研磨混合均匀,置于马弗炉中,550 ℃灼烧7 min,取出,冷却。以1∶10的比例溶于水,并置于恒温磁力搅拌器上搅拌24 h,冷却至室温后过滤、洗涤、烘干,得到灰白色粉末粉煤灰沸石。
1.2.2 TiO2沸石催化剂制备 设置3组实验。以钛酸丁酯和CH3CH2OH为底料,采用溶胶-凝胶法制备粉煤灰沸石负载光催化剂TiO2。将C16H36O4Ti∶CH3CH2OH∶冰醋酸∶HNO3以34∶100∶25∶2的质量比混合,置于恒温磁力搅拌器上,强力搅拌30 min,使之质地均匀。加入粉煤灰沸石粉末,搅拌2 h,使其混合均匀,于室温下放置12 h,使其老化。老化后于90 ℃下干燥24 h,研磨,置于500 ℃马弗炉中灼烧2 h,制得粉煤灰沸石负载光催化剂TiO2。
1.3 实验方法
实验构建TiO2光催化氧化脱盐电池系统,由阴极室、阳极室、脱盐室3部分构成,见图1。阳极室放置碳网电极,碳网填料为沸石负载TiO2光催化剂,粒径为1~5 mm;阴极室置入铂和活性炭纤维构成的空气阴极。采用预处理后的阴阳离子交换树脂分别作为三室之间的分隔材料,厚度均为0.2 mm,夹紧并密封。阳极和阴极之间用铜制导线连接,连接处用环氧树脂密封。系统由有机玻璃构成,有效容积为900 mL。
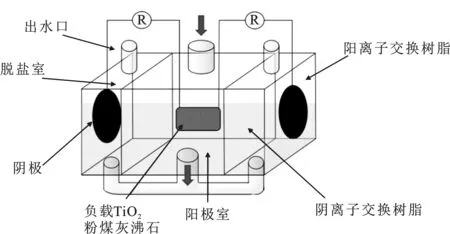
图1 TiO2光催化氧化脱盐电池系统结构Fig.1 Structure of TiO2 photocatalytic oxidationdesalination battery system
室温条件下,称取定量负载TiO2的粉煤灰沸石置入碳网中,将200 mL海水通入阳极室,加紧密封。阳极采用磁力搅拌器搅拌,转速为40~50 r/min,使水质组分充分混合,同时保持厌氧。采用250 W紫外高压汞灯照射阳极沸石,使其发生光催化,从而去除PAHs;研究pH对PAHs去除效果影响时可通过加入HCl和NaOH调节溶液酸碱度,于厌氧状态下10 h后测定溶液中的PAHs的浓度。
1.4 分析方法
采用电压记录仪每隔10 min采集数据;采用气相色谱-质谱联用仪对PAHs浓度进行测定;采用盐度计测定盐度;用pH计测定溶液的pH。常规水质指标采用国家水质标准[24],并对PAHs进行测定。溶液电导率采用笔式电导率仪水质测试笔测定。计算公式:
脱盐率=[(脱盐室初始浓度-脱盐室最终浓度)/脱盐室初始浓度]×100%。
2 结果与讨论
2.1 电压输出
将水样通入系统阳极室,运行紫外高压汞灯。TiO2在受紫外光的激发照射下,电子发生跃迁释放,产生的电子经阳极到达外电路,再传递到阴极,从而实现电流;H+到达阴极,在铂的催化下与电子和受体发生反应,生成H2O。实验运行周期10 h,采用笔式电导率仪水质测试笔测定电导率。
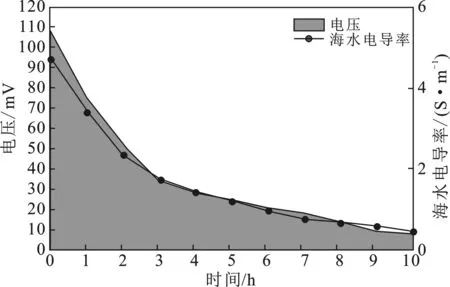
图2 系统电压与电导率的周期变化Fig.2 Periodic variation of system voltage and conductivity
系统初始阶段底物PAHs 723.72 g/L,海水盐度为20.02 g/L,电压输出达108 mV,初始电导率为4.72 S/m。伴随运行时间的增加,底物浓度开始减少,3 h后电压降低到34 mV,降速达到68%;3 h后,底物中PAHs浓度下降,降低至442.93 g/L,降解效率与产生电子的速率均有所降低,从而导致电压下降,由34 mV降至8 mV,该结果与强琳辉等[8]所得出的趋势相符。
实验测得的电导率变化与电压变化情况相似,在系统运行前3 h,电导率下降较快,并且在第3 h时,下降至1.76 S/m,这是由于系统阳极中PAHs初期含量较高,TiO2对PAHs的催化氧化降解效率较高,产生电子较多,致使脱盐室内离子迁移速度加快;在3~10 h,电导率下降较慢,由1.76 S/m下降至0.46 S/m,平均每小时下降0.18 S/m。在该阶段内,系统由于已运行3 h,且总体效率及速率均有所下降,因此,伴随PAHs的进一步降解,导致电子产生速率减缓,从而致使盐室离子迁移速度降低。同时,盐室内经过3 h高效率的脱盐,盐度大幅降低,相较于初始阶段,脱盐速率趋缓。
2.2 盐度与脱盐效果
系统启动并达到稳定电压输出后,测定样品进出水盐度,计算脱盐效率。进水样品初始盐度为20.02 g/L,pH调整至(7±0.2)将样品推流进入脱盐室内,盐室离子在电场作用下向两端迁移,阴、阳离子分别吸附在阴、阳离子交换树脂上,实现含盐水脱盐。

图3 盐度与脱盐效果Fig.3 Salinity and desalination effect
由图3可知,进水的盐度在前3 h下降较快,由20.02 g/L降至7.47 g/L,第3 h开始下降速率趋缓,这是由于溶液中可迁移离子量的减少,致使脱盐减缓[25]。盐浓度由7.47 g/L在7 h后下降为1.94 g/L。前3 h的脱盐效率分别为27.5%,50.1%,62.9%,效率较高,第3~10 h后,单位时间内脱盐效率趋于平缓,10 h后系统的脱盐效率达到90.3%。
2.3 pH梯度下系统对PAHs的降解效果与脱盐效率
采用粉煤灰合成沸石负载TiO2光催化氧化去除PAHs,并设置平行。加入TiO2光催化剂3 g/L,待运行稳定后的周期内,调节系统pH,通过测定进出水PAHs浓度、盐度,研究pH梯度下TiO2光催化氧化脱盐电池系统的运行效果,结果见图4。


图4 pH梯度下出水PAHs浓度(a)与盐度变化(b)Fig.4 PAHs concentration(a) and salinity change(b) of effluent under pH gradient
系统内pH值的变化,降解脱盐效率也会发生变化。由图4a可知,当系统内部处于酸性(pH=3,4,5,6),PAHs的降解效率相对较低,分别达到92.8%,93.3%,94.4%,95.3%,但随着pH的增加,PAHs去除率显著提升;pH=7时,系统对PAHs的去除,达到96.1%;pH=8时,系统PAHs降解率达到98%,并随pH的增加,出水的PAHs的浓度低至52.13 ng/L。说明位于弱碱性条件下,系统内的PAHs降解效果相对较好,李贞燕等[26]的研究也相应的证明了这一点。
系统阳极室内的降解活动也同时影响着脱盐室的运行。由图4b可知,当pH处于酸性时,脱盐效果随着pH的递增而增强,并在中性时达到90.3%,此时的盐浓度为1.94 g/L。分别将pH调整为8,9,10,11时,系统的总体脱盐效率处于下降状态,最低仅为85.8%。与Bo等[27]的趋势相似,碱性环境下,系统脱盐效果不佳。
2.4 TiO2光催化剂投加量对PAHs降解的影响
光催化剂具有强氧化性,可有效降解有机物、细菌等[28]。于系统运行稳定周期内,添加TiO2光催化剂,设置平行,并对出水PAHs浓度进行测定,系统pH=(8±0.2)。

图5 PAHs浓度变化及降解效果Fig.5 PAHs concentration change and degradation effect
由图5可知,随着TiO2光催化剂投加量的提升,出水PAHs的浓度下降。当TiO2光催化剂用量为3 g/L时,降解率达到95.8%,出水浓度为 418.46 ng/L;但TiO2光催化剂用量超过3 g/L时,系统的降解效果呈下降态势。这是因为TiO2光催化剂的大量添加,导致系统中悬浮颗粒增加,对光的遮挡率提升,致使系统反应速率减缓[29]。
3 结论
(1)以PAHs为底物的TiO2光催化氧化脱盐电池系统启动运行后,阳极PAHs含量从初始的 723.72 ng/L 降低至442.93 ng/L,此时TiO2光催化剂添加量为3 g/L,最大电压可达108 mV,并在前 3 h 衰减至34 mV,10 h后降至8 mV。
(2)系统单位时间内脱盐效率在前3 h较高,达到62.9%。第3~10 h后,单位时间内脱盐效率趋缓,10 h后系统的总脱盐率达到90.3%。
(3)TiO2光催化剂添加量为3 g/L,初始PAHs含量为723.72 ng/L。当pH≥3时,系统对PAHs的降解提升,并在pH=8时达到98%;pH≥9后,系统对PAHs的降解减缓。系统运行周期后,出水PAHs低至52.13 ng/L,表明系统对PAHs具有较好的降解效果,但脱盐效果在酸性与强碱性环境下不佳,pH=7时系统脱盐效果可达90.3%。
(4)pH=8,TiO2光催化剂投加量为3 g/L时,PAHs的降解率最优,达到95.8%。当投加量高于 3 g/L 时,系统对PAHs的降解率降低。
(5)采用脱盐电池协同粉煤灰合成沸石负载TiO2光催化氧化去除PAHs,将PAHs降解技术与脱盐技术相耦合,为PAHs处理工艺与脱盐技术的拓展提供了相应的参考。

