乳酸菌调控胆固醇代谢关键因子的研究进展
李权威,张开屏,赵艳红,杜 瑞,田建军*,靳 烨
(1 内蒙古农业大学食品科学与工程学院 呼和浩特010018 2 内蒙古商贸职业学院食品工程系 呼和浩特010070)
近几年,心血管疾病高发,已经成为人类的主要死因之一[1]。体内胆固醇含量过高是引发此类疾病的主要原因[2]。有研究表明,每降低1%的血清总胆固醇含量,冠心病等疾病的发病率可降低2%~3%[3]。他汀类药物虽可起到明显的治疗效果,但其成本过高且副作用较大。天然代替品的研究显得尤为重要。食源性乳酸菌来源于食品本身,安全性被广泛认可,且已有研究表明乳酸菌在体内可以起到维持肠道菌群平衡,调节人体脂类代谢及糖代谢等作用[4-5]。目前为止,已有大量研究证明乳酸菌具有降解胆固醇的能力,对其机理的研究也较深入。本文对乳酸菌调控机体内、外胆固醇代谢的机理进行总结、归纳。
1 胆固醇的代谢途径
胆固醇又名胆甾醇,一种环戊烷多氢菲的衍生物[6]。从18世纪起,人们就从胆石中发现了该物质,1816年由化学家本歇尔将这种物质命名为胆固醇[7]。胆固醇是动物组织细胞中极为重要的物质,它参与细胞膜的形成,同时还是合成胆汁酸、维生素D 以及甾体激素的原料[8-9]。当体内胆固醇代谢紊乱时,机体就会受到不同程度伤害,当今频发的心脑血管疾病便是严重的后果[10]。针对这种高发高危疾病,大多选用2 种治疗方式,一是通过食用胆固醇含量低的食物,以减少体内胆固醇的摄入量,然而对于普通群众来说很难做到时刻保持警惕;二是依靠药物治疗,然而药物治疗不仅费用高昂,副作用更是不可预估,显然不属于理想的治疗方法[11-12]。因此,对于具有调控机体内、外胆固醇代谢作用的食源性乳酸菌的研究得到了极大的发展。
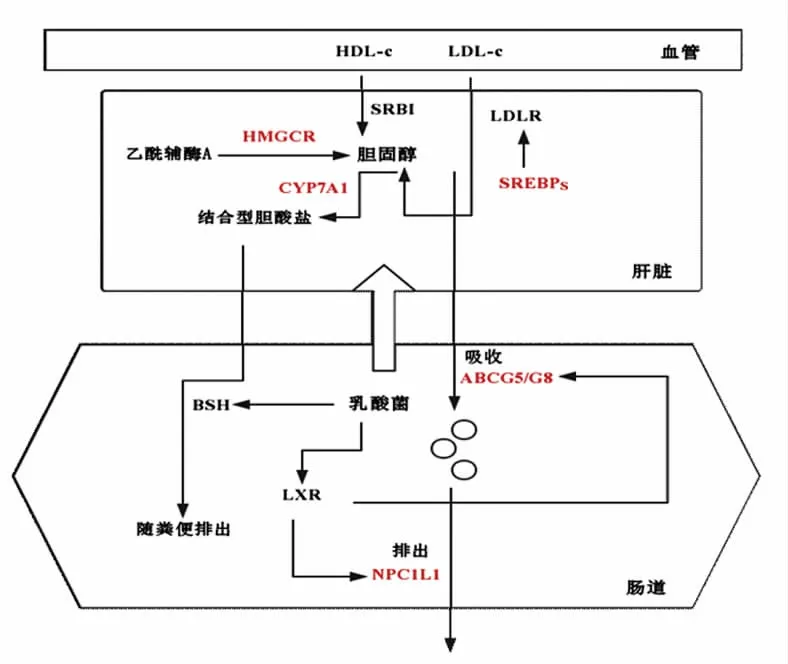
图1 体内胆固醇代谢模型[13]Fig.1 The model of cholesterol metabolism in vivo[13]
体内胆固醇的代谢主要分为胆固醇合成,胆固醇的分解及胆固醇的吸收与转运3 大部分,如图1所示[13]。肝脏是胆固醇内源性合成和分解的主要部位,在肝脏内以乙酰辅酶A(Acetyl-CoA,Ac-CoA)为原料,经过一系列的反映最终转变成胆固醇,其中HMGCR 是肝脏内胆固醇合成的关键限速酶,它催化甲羟戊酸的合成,这是合成胆固醇的关键前体物质,乳酸菌对胆固醇合成代谢的调控作用主要是通过影响此因子的表达而实现[14]。肝脏内的胆固醇除了由内源性合成以外,还有部分是从血液中吸收而来,血液中含有的高密度脂蛋白胆固醇(High-density lipoproteins receptorscholesterol,HDL-c) 和低密度脂蛋白胆固醇(Low density lipoproteins-cholesterol,LDL-c) 会通过基底膜(肝细胞与肝窦间) 上B1 型清道夫受体(Scavenger receptor class B type I,SRBI)以及低密度脂蛋白受体(Low density lipoprotein receptor,LDLR)被肝脏吸收,低密度脂蛋白胆固醇的吸收过程主要靠SREBPs 来调控,这便是乳酸菌调控肝脏胆固醇吸收的主要作用因子[15]。为了维持肝脏内胆固醇的平衡,肝脏会将部分胆固醇在CYP7A1 的控制下转化为结合型胆酸盐,在胆汁酸的作用下随粪便排出[16]。剩余部分的游离胆固醇会从肝细胞中排出,经过一系列反应,与胆盐和磷脂共同形成乳糜微粒再被肠道吸收,小肠对于胆固醇的吸收主要依靠肠上皮细胞中的NPC1L1蛋白来控制,将小肠内多余的胆固醇转移出小肠的主要调控原件是ABCG5/G8[17]。乳酸菌通过肝脏X 受体(Liver X receptors,LXRs)对小肠中的这2个关键因子进行调控,从而影响小肠内胆固醇的代谢。
2 乳酸菌调控体内胆固醇代谢机理
目前已经研究指出乳酸菌调控体内胆固醇代谢的途径主要有:(1) 抑制肝脏胆固醇的生物合成;(2)促进胆固醇的分解代谢;(3)调节胆固醇的吸收及转运。这些途径中存在着一些关键控制因子,如:胆固醇合成过程中的3-羟基-3-甲基戊二酰辅酶A 还原酶(3-Hydroxy-3-methylglutaryl coenzyme A reductase,HMGCR);胆固醇分解过程中的胆固醇7α-水解酶(Cholesterol 7 alpha hydroxylase,CYP7A1);胆固醇吸收及转运过程中的ATP 结合盒转运蛋白(ATP binding cassette,ABC)家族成员G5 和G8(ABCG5/G8)、多蛋白跨膜蛋白(Niemann-pick C1 like 1,NPC1L1)以及固醇调节原件结合蛋白(Sterol regulatory element binding protein,SREBPs)[18-19]。乳酸菌对胆固醇代谢的调控作用与这些关键控制因子息息相关,可以说这些代谢过程中的关键因子就是乳酸菌的作用靶标。

表1 调控体内胆固醇代谢的关键控制因子Table 1 The key regulatory factor of cholesterol metabolism
2.1 胆固醇合成代谢关键控制因子及乳酸菌调控机制
胆固醇的合成几乎发生在所有细胞中,然而主要合成部位集中在肝脏、肠、肾上腺皮质和生殖组织中,人体内合成的总胆固醇的三分之一是在肝脏内完成的[20]。
HMGCR 是胆固醇生物合成中的限速酶,它催化3-羟基-3-甲基戊二酰辅酶A(3-Hydroxy-3-methylglutaryl coenzyme A,HMG-CoA) 还原为甲羟戊酸。所有哺乳动物的HMGCR 都位于内质网膜上,人类的HMGCR 蛋白共有888 个氨基酸残基,被分为2 个相邻的区域,还原酶的N 末端结构域由339 个氨基酸组成,并通过8 个由短环分开的跨膜区段整合到膜中,其中第89 位和第248 位为2 个可受甾醇调节的氨基酸位点(图2)[21],还原酶的C 末端由548 个氨基酸组成,是HMGCR 发挥催化活性的主要区域。Istvan 等[22]对酵母中的HMGCR 进行研究,结果表明HMGCR 是甲羟戊酸合成途径中的关键酶,控制包括胆固醇和异戊二烯部分在内的数以千计的分子的产生。
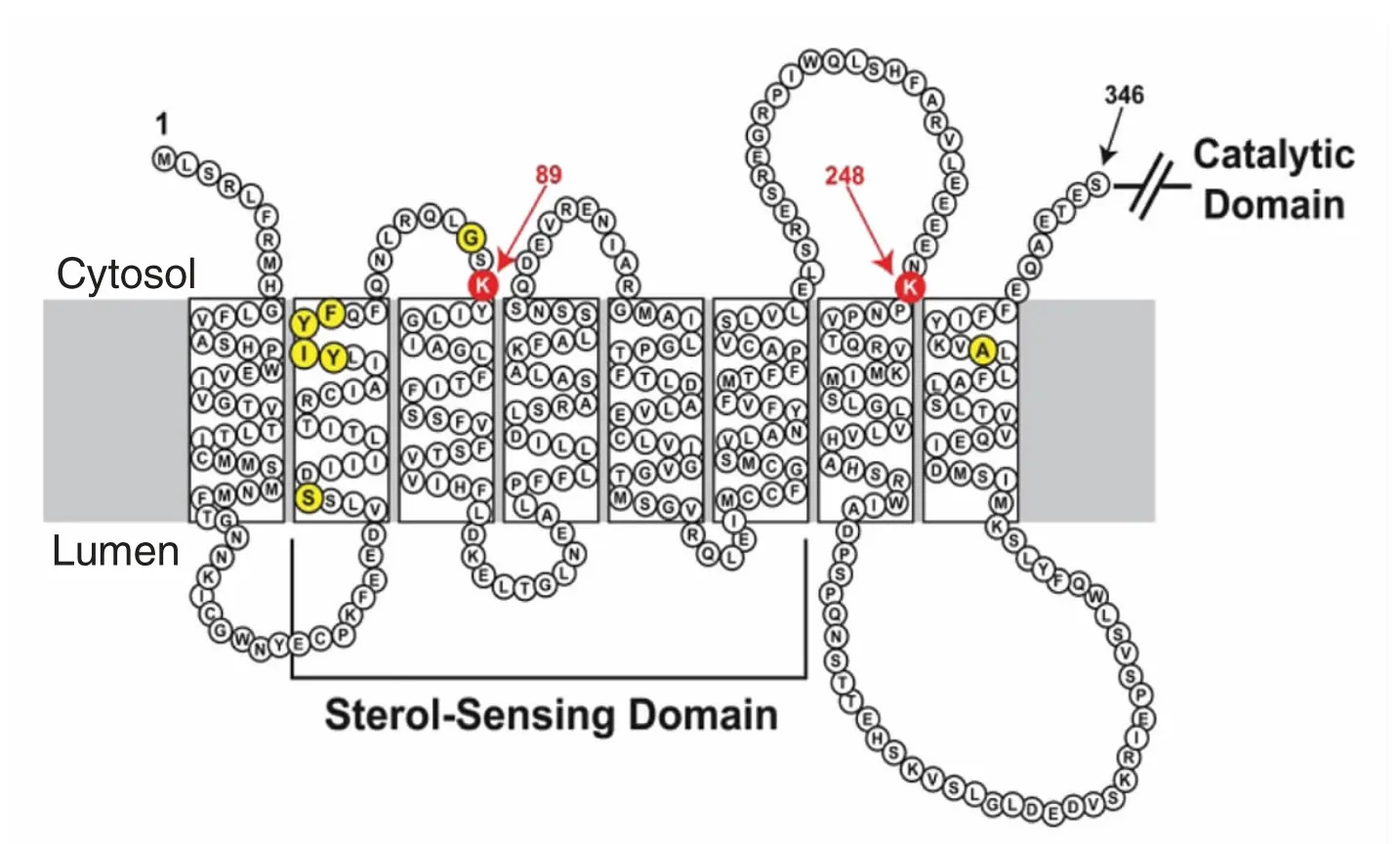
图2 HMGCR 拓扑结构图[21]Fig.2 The topology of HMGCR[21]
调节HMGCR 的活性是控制胆固醇合成量的主要方法,因此常被作为降低体内胆固醇含量的药物靶标,例如:目前医学上最常用的他汀类药物,是治疗高胆固醇血症的最常用药物之一,这种药物的作用机理就是通过抑制HMGCR 的活性来干扰胆固醇的重头合成,从而降低胆固醇含量[23]。然而,由于其负作用较大,近几年科学家们已经在研究能够起到降胆固醇作用的生物制剂,以满足大众的医疗需求。随着研究的深入,天然的健康的微生物制剂逐渐占领了研究的大部分领域。2002年Jiang 等[24]对来自海洋的腐皮镰刀菌FG319 进行研究,结果表明该菌的粗提物对HMGCR 的抑制能力随着其质量浓度的升高而增强,且当质量浓度达到150 μg/mL 时抑制率达到最高为80%,之后随着代谢粗产物质量浓度的再度升高,抑制率出现下降趋势。此外研究人员发现除了海洋微生物以外,食源性的乳酸菌也可以通过调控HMGCR 的活性来调控胆固醇的合成代谢。2016年郭均[25]发现活菌与死菌对HMGCR 的活性影响差异很大,活的乳酸菌会下调HMGCR 基因的表达从而抑制胆固醇的合成,死的乳酸菌却会上调HMGCR 基因的表达。随着研究的深入,乳酸菌对于HMGCR 的调控机理也越发明确,Hawley 等[26]研究发现腺苷酸活化蛋白激酶(5'-Adenosine monophosphate activated protein kinase,AMPK)是关键代谢酶,如HMGCR 的上游激酶,并且通过α亚基的激活环区段(大鼠AMPK 中的Thr172)内的苏氨酸残基的磷酸化而被激活。2012年Srivastava 等[27]的研究也表明AMPK 直接磷酸化可以控制许多主要代谢调控因子和主要参与控制葡萄糖和脂质代谢的转录因子的活性。之后Chen 等[28]在2016年发现乳杆菌通过与NF-κB(核因子-κB) 相关的途径,降低HepG2 细胞中的HMGCR mRNA 表达,虽然NF-κB 亚基不被AMPK 直接磷酸化,但NF-κB 信号传导的抑制是由AMPK 的几个下游靶标介导的。Lew 等[29]在2018年通过试验验证了植物乳杆菌DR7 在细胞内刺激了AMPK的磷酸化,随着AMPK 磷酸化水平的增加,HMGCR 的活性受到抑制,基因的表达量显著降低。总的来说,乳酸菌通常是通过促进AMPK 的磷酸化,从而导致HMGCR 基因的表达降低。
2.2 胆固醇分解代谢关键控制因子及乳酸菌调控机制
降低胆固醇的另一个主要途径就是通过促进胆固醇在体内的分解作用,减少其在体内的含量,CYP7A1 是胆固醇转化为胆汁酸(Bile acid,BA)途径中的合成限速酶,仅在肝脏中表达,每天能为人体排除400~600 mg 多余的胆固醇。对于这个因子的调控方式首先就是人们熟知的运动法,由Mani[30]研究表明脂肪堆积会显著降低体内CYP7A1 mRNA 的表达,从而影响胆固醇向胆汁酸转化。随着研究的深入,对于此因子的调控不仅限于运动这一种方式,由Kir 等[31]在2012年发现了成纤维细胞生长因子19(FGF19)通过涉及核受体SHP 的机制抑制CYP7A1 转录,研究显示核受体HNF4α 和LRH-1 对于CYP7A1 的调节作用具有双重性。首先,研究人员通过促进CYP7A1 启动子上的活性转录组蛋白合作维持CYP7A1 的基础表达,其次,它们使SHP 与CYP7A1 启动子结合,从而促进FGF19 介导的胆汁酸合成的抑制作用。总之,HNF4α 和LRH-1 是体内CYP7A1 转录的重要调节因子。
近几年,随着乳酸菌调控胆固醇代谢相关研究的深入,人们逐渐发现了乳酸菌可以通过提高CPY7A1 的表达来加速肝脏内胆固醇的降解。Martinez 等[32]通过给大鼠喂食植物乳杆菌,验证了活菌可显著降低大鼠低密度脂蛋白胆固醇和血浆三酰甘油水平,使粪便胆汁酸排泄加速45%,通过检测发现活菌组CYP7A1 的基因表达和蛋白水平显著上调(mRNA 上调至80%,蛋白质表达上调至60%),足以证明该菌对CYP7A1 的表达具有一定的促进作用。随后人们发现对CYP7A1 起调控作用的是乳酸菌中的胆盐水解酶(Bile salt hydrolase,BSH),肠道内乳酸菌含有胆盐水解酶,此酶会增加体内游离胆汁酸的分泌,这些游离胆汁酸会抑制法尼醇X 受体(Farnesoid X receptor,FXR),再由FXR/Fgf15 将信号从肠道传递到肝脏,从而上调肝脏内CYP7A1 的表达,以此加快胆固醇向胆汁酸转化的速度,降低肝脏内胆固醇的含量[33]。Potthoff 等[34]也证实了益生菌可以在功能性FXR 信号通路的辅助下促进粪便BA 的流失并诱导肝脏BA 合成。
2.3 胆固醇吸收、转运代谢关键控制因子及乳酸菌调控机制
2.3.1 乳酸菌对小肠内胆固醇的吸收及转运的调控 如图3所示[35],小肠也是胆固醇合成部位之一,然而其合成量紧占体内胆固醇含量的10%。在小肠内胆固醇主要存在吸收和转运2 种代谢,这2 种代谢主要由NPC1L1 蛋白及ABCG5/G8 蛋白控制,膳食中的胆固醇需要与小肠上皮细胞中的NPC1L1 蛋白特异性结合才能进入到肠腔中,完成小肠对胆固醇的吸收过程,而肠腔内的游离胆固醇以胶束状态被转运到刷状缘膜表面,在小肠的刷状缘膜表面存在着ABCG5/G8 蛋白,此蛋白是调控肠腔中游离胆固醇转运的关键蛋白,通过它胆固醇才可以进入肠上皮细胞,在细胞内经过酯化作用形成乳糜微粒被转运出细胞,完成小肠中胆固醇的转运过程[36]。
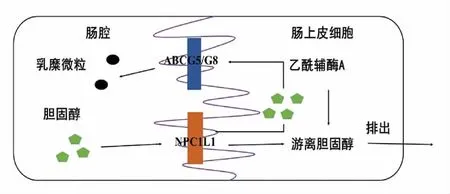
图3 胆固醇肠代谢模型[35]Fig.3 The model of cholesterol metabolism in intestine[35]
乳酸菌对小肠内胆固醇的吸收及转运代谢的调控也是通过调控这2 个关键蛋白的表达实现的。最近有研究表明NPC1L1 蛋白是人体吸收胆固醇所必需的蛋白质,其在吸收性肠上皮细胞的顶端高度表达[37]。小肠中的胆固醇在近端空肠区域表达量较高,此处恰好是胆固醇的吸收部位,胆固醇通过与NPC1L1 蛋白结构域的特定结合,实现高度特异性的转运,穿过肠上皮细胞后,经过一系列转运最终到达肝脏[38]。在此过程中,下调NPC1L1 蛋白的表达就能在一定程度上调控小肠对胆固醇的吸收,最终达到降低肝脏内胆固醇含量的效果[39]。对NPC1L1 有调控作用的物质有很多,比如谭志辉等[40]研究发现三磷酸鸟苷结合蛋白酶家族成员cdc42 能与NPC1L1 相互作用共同调控胆固醇的转运;Xie 等[41]也发现,SREBP-2 在NPC1L1 蛋白启动子处与胆固醇酰基转移酶(Acyl coenzyme A:cholesterol acyltransferase,ACAT)结合,激活NPC1L1 蛋白启动子的活性,增强NPC1L1 蛋白的表达,肝细胞核因子4α(HNF4α)和肝X 受体(Liver X receptors,LXRs)均 有降低NPC1L1 蛋白表达的作用。ABCG5/G8 这对基因主要在肝细胞、胆管细胞、胆囊上皮细胞以及小肠上皮细胞刷状缘表达。在小肠中该蛋白主要在小肠上皮细胞的刷状缘膜表达[42]。最近有研究表明增加ABCG5 蛋白和ABCG8 蛋白在小肠中的表达可显著降低胆固醇吸收[43]。且有研究发现ABCG5 蛋白和ABCG8 蛋白是LXRs 在肠道中的直接靶基因,两者需要共同作用才能对胆固醇起到有效的调节作用,Repa 等[44]通过原位杂交试验发现在LXR 激动剂治疗的肠细胞中,ABCG5 蛋白和ABCG8 蛋白的表达水平显著增加,这足以证明维持体内胆固醇稳态是由肠中ABC 甾醇转运蛋白和LXR 依赖性表达协同调节的。
在小肠中,乳酸菌对于NPC1L1 蛋白和ABCG5/G8 蛋白这两种因子的调控是依靠肝脏X受体(LXRs)介导的。LXR 主要包括2 种核受体LXR-α 和LXR-β,它需与类视黄醇X 受体(Retinoid X receptor,RXR)结合形成杂合二聚体后才具有转录因子活性。在肠道内LXR/RXR 杂合二聚体通过下调NPC1L1 蛋白的表达来抑制肠道对胆固醇的吸收。由Huang 等[45]研究表明嗜酸乳杆菌ATCC4356 对体内胆固醇代谢有影响,饲喂嗜酸乳杆菌ATCC4356 后,十二指肠和空肠内NPC1L1 蛋白的表达显著降低,通过研究其机理发现饲喂乳杆菌的小鼠肝脏内的肝脏X 受体被激活,下调了NPC1L1 蛋白的表达,因此才会起到抑制胆固醇合成的作用。LXR/RXR 杂合二聚体在下调NPC1L1 蛋白的表达,抑制胆固醇合成的同时还会上调ABCG5/G8 蛋白的表达,促进肠道内胆固醇的外排,从而减少体内胆固醇的含量[46]。两年后由Huang 等[47]再次通过小鼠试验证明嗜酸乳杆菌ATCC4356 具有上调LXR 在小肠中的表达水平的能力,且LXR 的激活显著上调了ABCG5/G8蛋白的表达水平,这有利于胆固醇从细胞输出到腔内基底外侧隔室。可见乳酸菌完全可以通过LXR 调控ABCG5/G8 蛋白和NPC1L1 蛋白的表达进而调控小肠内胆固醇的代谢。
2.3.2 乳酸菌对肝脏内胆固醇的吸收及转运的调控 肝脏通过LDLR 通路获得血液中的低密度脂蛋白胆固醇(LDL-C),同时当LDLR 表达量过高时会刺激肝脏内的包吞作用,以减少胆固醇的含量[48]。研究发现LDLR 通路主要受到SREBPs 蛋白的调节,SREBPs 蛋白共有3 种形式的异构体,即SREBP-1a,SREBP-1c 和SREBP-2,其中SREBP-2 主要参与调节胆固醇的合成,在肝脏中含量最高[49]。SREBPs 蛋白的活动由细胞的胆固醇含量控制,当细胞内胆固醇含量过高时,SREBPs 蛋白虽然还能与内质网(ER)膜结合,但是活性很低。当细胞耗尽固醇时,SREBPs 蛋白就会转移到高尔基体,在那里,两个蛋白酶释放了SREBPs 蛋白的活性部分,然后进入细胞核,激活目标基因的转录。研究显示胰岛素、生长因子、未折叠的蛋白质应答(UPR) 和细胞内K+的改变等因素都能调节SREBPs 蛋白的转录及转录后成熟的稳定性[50]。
乳酸菌可以有效降低对人体有害的低密度脂蛋白胆固醇的含量,同时还能够提高高密度脂蛋白胆固醇含量[51-52]。2012年有研究表明乳酸菌降低胆固醇的作用是通过调节SREBPs 蛋白来抑制LDLR 通路,从而减少肝脏内胆固醇的吸收[53]。2016年Lee 等[54]研究植物乳杆菌发酵大蒜中的提取物对肥胖小鼠抗肥胖的作用,发现了植物乳杆菌可以通过下调SREBP-1c 等脂肪生成相关基因的表达,来减少腹部脂肪垫和血浆脂质水平。2017年MA[55]也通过动物实验证明了干酪乳杆菌降低体内胆固醇水平的主要机制就是菌液可以抑制SREBP-1c 在体内的表达。
综上所述,胆固醇在体内的代谢主要包括3个部分;胆固醇的合成,胆固醇的分解,胆固醇的吸收及转运。3 个代谢过程都存在各自特定的控制因子,如具有限速作用的HMGCR 因子,控制胆固醇转化的CYP7A1 因子,以及控制吸收和转运作用的NPC1L1 因子、SREBP 因子、ABCG5/G8 因子,乳酸菌作为食源性菌,在安全性得到信任的同时又可以对这些因子起到直接或间接的调节作用,通过这些调控各个代谢过程中的关键因子,实现对体内胆固醇代谢的调控作用。
3 乳酸菌调控体外胆固醇代谢机理
通过体外试验对乳酸菌降解胆固醇机理的研究较多,目前为止相对前沿观点主要有2 个:(1)乳酸菌通过菌体的代谢产物来降低胆固醇含量;(2) 乳酸菌通过调控胆汁酸代谢及胆盐作用控制胆固醇含量。
3.1 乳酸菌的代谢产物对胆固醇代谢的调控作用
Sasikumar 等[56]研究显示,植物乳杆菌产生的胞外多糖(Exopolysaccharides,EPS)是一种高分子质量的葡甘露聚糖型EPS,具有优良的生化特性,目前已经研究出其具有抗氧化,抗糖尿病和降胆固醇的性质,对其进行细胞毒性测试显示该EPS对正常细胞无毒性作用。近几年也有研究发现,某些生产EPS 的益生菌菌株可以结合游离胆汁酸,同化胆汁酸后增加排放量。为了维持体内胆汁酸的正常水平肝脏会利用胆固醇合成新的胆汁酸,也就降低了胆固醇的含量。由Horácˇková 等[57]研究也显示一些肠道微生物菌群产生胆固醇还原酶,其催化胆固醇转化为不溶性的粪(甾)醇,粪醇随粪便排泄,从而减少了外源性胆固醇的量。Lye等[58]的研究表明在发酵乳杆菌中存在7α-羟基类固醇脱氢酶的基因,该基因可催化游离形式和结合形式的胆汁酸发生7α-羟基氧化,形成氧代衍生物,这会减少底物转化成更有害的次级胆汁酸,而这些氧代衍生物具有疏水性,有效抑制了肠腔对胆固醇的再吸收。以上研究均可说明乳酸菌的某些代谢产物可以起到降低体内胆固醇含量的作用。
3.2 乳酸菌通过调控胆汁酸代谢及胆盐作用调控胆固醇的代谢
胆汁酸促进肠道营养吸收和胆汁胆固醇分泌,维持胆汁酸稳态对于保护肝脏和其它组织、细胞免受胆固醇和胆汁酸毒性伤害至关重要。胆汁酸代谢受肝脏中胆汁酸合成和肠中胆汁酸生物转化的调节。胆汁酸是内源性配体,通过激活法尼醇X 受体和膜G 蛋白偶联胆汁酸受体的复杂网络来调节肝脏脂质和葡萄糖代谢稳态[59]。Patel 等[60]研究发现口服活性植物乳杆菌可以降低总胆固醇、低密度脂蛋白胆固醇和三酰甘油的水平,且最为明显的变化是胆汁酸排泄,大可推测出粪便胆汁酸排泄的增加可能是植物乳杆菌降低低密度脂蛋白胆固醇水平的主要机制。由Tsai 等[61]研究LAB降低胆固醇的能力时发现,微生物的BSH 活性是导致胆固醇含量降低的主要原因,在BSH 的催化下,肠腔内的胆固醇发生去缀合形成了去共轭胆汁酸,去共轭胆汁酸溶解性较差,不易被肠内腔吸收,更容易通过肠道排泄,从而减少了胆固醇在肠腔内的吸收,也因此降低了血清胆固醇的水平。
胆盐是一种疏水性物质,一些益生菌能够使肠腔内的胆盐脱共轭,去偶联形式下的胆盐作为乳化剂比共轭胆盐的作用更小,使胆固醇无法形成稳定的胶束,且酸性条件下的去共轭胆盐会发生质子化和沉淀现象,此时肠道胆固醇可以与去共轭胆盐发生共沉淀,大大减少了肠道对胆固醇的吸收量[62]。Wang 等[63]也证实去偶联形式的胆盐的存在对于该机制的发生是必不可少的。
4 结论
对于降胆固醇乳酸菌的研究已经进行了近半个世纪,大量的动物实验充分证明乳酸菌可以起到调控体内胆固醇代谢的作用,尽管不同菌株之间存在明显的特异性。与体外相比,对于乳酸菌在体内降解胆固醇的机制的研究相对滞后。随着近几年深入研究发现,乳酸菌在体内降解胆固醇的机制大致可从合成、吸收、转运3 个方面展开分析,且以目前的研究结果表明乳酸菌的调控作用主要是通过调节3 大代谢通路中的关键控制因子来实现的。然而,目前这些研究结果仅仅是依靠乳酸菌干预后的动物体内的蛋白质表达量的变化推测出来的,判断依据还相对表面,缺乏更深入、更本质的证据。此外,乳酸菌在体内调控胆固醇的作用是仅仅依靠其本身即可实现,还是需要其它代谢产物共同作用才能实现,是直接可以控制胆固醇代谢中的某个关键步骤,还是只能通过其它间接方式对其产生影响,都还没有很详细、明确的证明,相信随着科研的进一步深入,乳酸菌对胆固醇代谢的调控机制会更加明朗。

