食品中人星状病毒的定量检测方法
徐蕾蕊,李 丹,魏咏新,马 丹,魏海燕,汪 琦,张西萌,付溥博,刘 莉,赵晓娟,曾 静
(中国海关科学技术研究中心 北京100026)
1975年Appleton 等[1]在肠胃炎患者粪便中首次发现HAstV,其为一种无衣壳的单股正链RNA病毒,具有5~6 个小角,呈星星状。星状直径28~35 nm,基因组全长6.8 kb,包含5’非编码区(Noncoding region,NCR)和ORF1a、ORF1b、ORF2 共3个开放阅读框。HAstV 分为8 个血清型,其中,可在婴幼儿、年长者和免疫低下人群中引起严重的急性病毒性肠胃炎的血清型是人星状病毒1 型(Human astrovirus type1,HAstV-1)[2]。
食源性病毒的感染剂量非常低,10~200 个病毒粒子即可引起感染,在人体肠道中经过繁殖后,通过粪便污染环境,并进一步通过受粪便污染的水或者淤泥、土壤等诸多途径传播[3]。鉴于此,需要提高HAstV 检测的灵敏度和准确度,建立一种简便易操作的食品中HAstV 定量检测方法,对食品中HAstV 污染水平实现有效监控。本研究应用RT-ddPCR,建立了一种快速、简便定量检测食品中HAstV 的方法,为开展食品中HAstV 等食源性病毒暴露评估工作提供新的技术手段。
1 材料与方法
1.1 主要试剂与仪器
HAstV、轮状病毒、诺如病毒、甲肝病毒RNA,本实验室保存;MS2 噬菌体悬液,本实验室保存;pcDNAⅡ载体,美国Invitrogen 公司;焦碳酸二乙酯(Diethyl paracabonate,DEPC)处理H2O,北京天根生化科技有限公司;总RNA 抽提试剂Trizol,美国Invitrogen 公司;乙醇、异丙醇、氯仿、异戊醇,北京化学试剂公司;核糖核酸酶抑制剂(Recombinant RNasin®ribonuclease inhibitor),美国Promega 公司;一步法定量实时荧光聚合酶链式反应试剂盒(SuperScript®ⅢPlatinum®one-step quantitative RT-PCR system),美国Invitrogen 公司;病毒核糖核酸提取试剂盒(QIAamp viral RNA mini kit),德国QIAGEN 公司;蛋白酶K,天根生化科技(北京) 有限公司;核糖核酸磁珠纯化试剂盒(Dynabeads®mRNA purification kit),美国Life Technology 公司;微滴生成油,美国Bio-Rad 公司。
7900HT Fast 实时荧光PCR 仪、Veriti 96-Well 热循环仪,美国ABI 公司;QX200 微滴数字PCR 系统、8 孔微滴生成卡、QX200 微滴生成仪、铝箔热封膜,美国Bio-Rad 公司;CP413 电子天平,奥豪斯仪器上海有限公司。
1.2 试验方法
1.2.1 引物探针设计和特异性筛选 根据HAstV ORF2 中编码衣壳蛋白的靶序列,利用Prime Express V4.0 设计HAstV 特异性引物和探针组合。提取HAstV RNA 后,利用实时荧光定量PCR(Real-time fluorescent quantitative polymerase chain reaction,qRT-PCR)筛选引物探针。
1.2.2 引物探针的特异性验证 应用HAstV 和轮状病毒、甲肝病毒、诺如病毒RNA,验证引物探针的特异性。反应体系包括2×一步法逆转录微滴式数字聚合酶链式反应预混液(2×One-step RTddPCR supermix) 15 μL,25 mmol/L 醋酸镁(Manganese acetate solution) 0.8 μL,上游引物/下游引物(10 μmol/L) 各1.8 μL,探针(10 μmol/L)0.5 μL,RNA 模板2 μL,DEPC 处理水补齐至20 μL。反应步骤:将20 μL 以上反应体系和65 μL 微滴生成油分别加入到8 孔微滴生成卡内,QX200 微滴生成仪内生成微滴。将生成的微滴(约40 μL)缓慢转移到96 孔板内,铝箔热封膜处理后,置于Veriti 96-Well 热循环仪中进行PCR 扩增。扩增结束后,在微滴读取仪中测量反应体系中RNA 模板浓度,计算样品RNA 模板浓度。
1.2.3 RT-ddPCR 条件优化 将1.2.2 节中反应体系分别在不同退火温度下进行扩增反应,比较不同扩增温度下的扩增效率,优化得到最佳退火温度。
1.2.4 HAstV RT-ddPCR 的定量低限、准确度、重复性分析
1.2.4.1 HAstV RNA 标准样品制备 利用pcDNAII 载体构建含HAstV RT-ddPCR 检测目的序列的重组质粒,单酶切后体外转录合成获得含HAstV RT-ddPCR 检测方法目的序列的RNA 片段,研制HAstV RNA 标准样品,并按照ISO Guide 35:2006[4]要求,确定其特性值。
1.2.4.2 定量低限和准确度 多倍梯度稀释HAstV RNA 标准样品,每个梯度各取2 μL,采用RT-ddPCR 检测,反应体系同1.2.2 节。各稀释梯度重复检测4 次,计算测量值的相对标准偏差(Relative standard deviation,RSD),分析确定RTddPCR 测量值与理论值的相关性,确定定量低限,验证准确度。
1.2.4.3 重复性 取3 份HAstV RNA 标准样品按10 倍梯度分别稀释,采用RT-ddPCR 分别检测各份标准样品稀释系列中的高、低2 个梯度,每个梯度各取2 μL,每份样品各梯度分别进行6 次重复检测,反应体系同1.2.2 节,同时设置1 个空白对照(以DEPC 水代替模板RNA)。计算测量值与理论值偏差,确定重复性。
1.2.5 不同种类食品基质的检测限和回收率 采用MS2 噬菌体制备人工污染样品。采用双层琼脂培养法[5]确定MS2 噬菌体悬液中MS2 噬菌体效价为7.2×108PFU(噬菌斑形成单位,Plaque forming unit)/μL,制备 成7.2×105,7.2×104,7.2×102,7.2×101,3.6×101,1.8×101PFU/μL 梯度稀释液,作为HAstV 模拟污染液。
1.2.5.1 食品基质种类及来源 食品基质种类:贝类消化腺(牡蛎)、硬表面食品(苹果)、生食蔬菜(生菜)和酸性软质水果(草莓)。所有样品均购自超市,购入后立即进行人工污染或者分别保存于-80 ℃(牡蛎)和4 ℃(苹果、生菜、草莓),人工污染前,去除外壳不完整的牡蛎样品,用无菌水冲掉生菜、苹果和草莓样品表面的泥沙和浮尘,晾干表面水珠后备用。
1.2.5.2 人工污染样品制备 牡蛎:剥离出消化腺,匀浆后,分为2 g/份,添加100 μL 模拟污染液,室温静置30 min,每个污染梯度均设置3 份样品,每份样品重复检测3 次。
苹果:取100 μL 模拟污染液点涂到表面,涂抹面积≤100 cm2,室温静置30 min,每个污染梯度均设置3 份样品,每份样品重复检测3 次。
生菜:称取生菜25 g,取100 μL 模拟污染液点涂到表面,室温静置30 min,每个污染梯度均设置3 份样品,每份样品重复检测3 次。
草莓:称取草莓25 g,取100 μL 模拟污染液点涂到表面,室温静置30 min,每个污染梯度均设置3 份样品,每份样品重复检测3 次。
1.2.5.3 人工污染样品前处理及核酸提取 不同种类人工污染食品样品中的病毒洗脱和浓缩等前处理操作均按ISO/TS 15216-2:2013[6]标准方法进行。用Trizol 方法提取前处理液中的病毒RNA,采用100 μL DEPC 水溶解提取的RNA。取50 μL 直接用RT-ddPCR 检测,剩余的50 μL 核酸经磁珠纯化试剂盒纯化后再用RT-ddPCR 检测。
1.2.5.4 MS2 噬菌体RT-ddPCR 检测方法 参考文献[7-8]研究中的引物和探针(表1),建立MS2噬菌体RT-ddPCR 检测方法。反应体系及微滴生成、核酸含量计算同1.2.2 节所述方法。
1.2.5.5 计算人工污染样品回收率 回收率为经RT-ddPCR 方法得到的人工污染样品检测值与添加的模拟污染液理论值的比值,判定人工污染样品中模拟病毒的回收和病毒RNA 提取的有效性时,要求该回收率>1%。
1.3 统计分析
采用SPSS 17.0 统计软件分析,采用t-检验和F-检验比较组间均数,P<0.05 时,差异有统计学意义。
2 结果与分析
2.1 引物探针特异性
根据HAstV ORF2 编码衣壳蛋白靶序列,设计引物探针3 组,以及检测标准SN/T 2519-2010中HAstV 引物探针ORF2-F1/ORF2-R1/ORF2-P1,用于RT-ddPCR 引物探针筛选。qRT-PCR 对设计的引物探针筛选结果表明:仅ORF2-F4/ORF2-R4/ ORF2-P4(序列未给出)不能扩增出靶基因,且ORF2-F1/ ORF2-R1/ ORF2-P1 信号最强(图1)。特异性验证说明,ORF2-F1/ ORF2-R1/ORF2-P1(序列见表1)对轮状病毒、甲肝病毒和诺如病毒RNA 均无扩增(图2)。
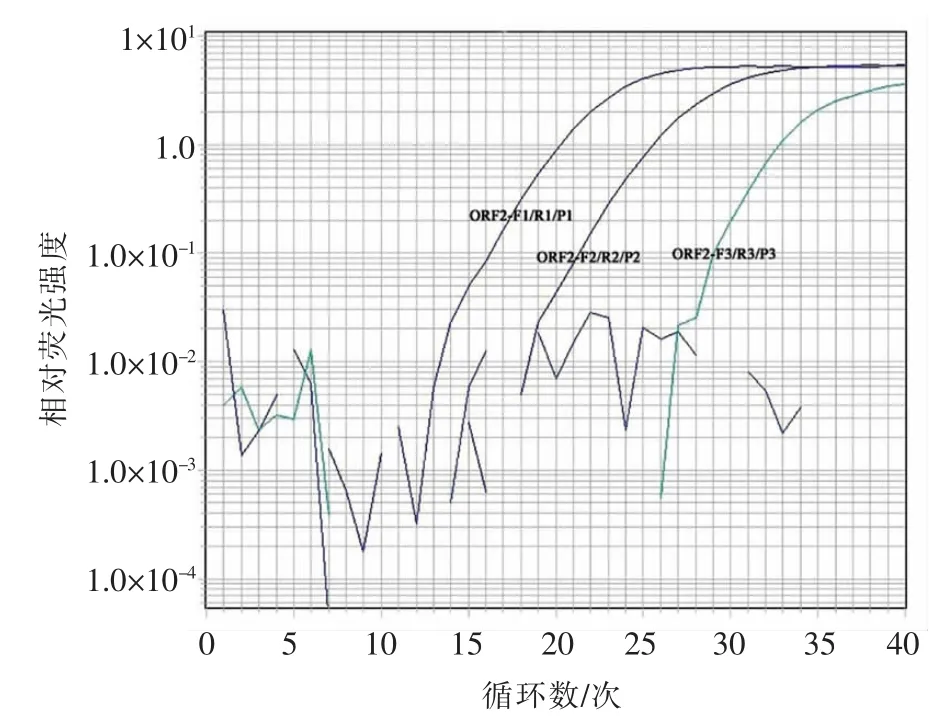
图1 HAstV 引物探针筛选Fig.1 HAstV primer and probe filtrating
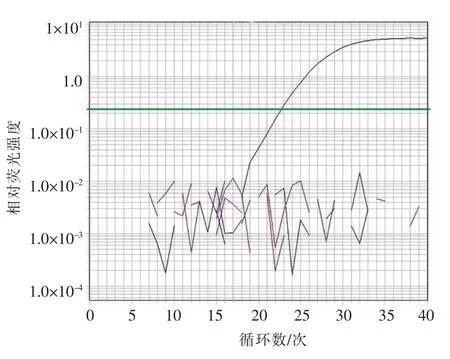
图2 ORF2-F1/ ORF2-R1/ ORF2-P1 特异性验证Fig.2 Specificity of ORF2-F1/ ORF2-R1/ ORF2-P1

表1 RT-ddPCR 反应引物探针序列Table 1 Primer and probe sequence for RT-ddPCR
2.2 建立及优化HAstV RT-ddPCR 方法
2.2.1 RT-ddPCR 方法 筛选出引物探针OFR2-F1/ ORF2-R1/ ORF2-P1 后,建立HAstV RTddPCR 方法。根据RT-ddPCR 特异性结果表明(图3),仅HAstV RNA 出现阳性微滴,且在对体系扩增温度进行优化前,阳性、阴性微滴簇之间有明显分界;其它病毒RNA 均未出现阳性微滴,可见该RT-ddPCR 方法对HAstV RNA 特异性良好。
2.2.2 退火温度的优化 由图4可知,目的基因片段扩增效率在退火温度为55 ℃或60 ℃时均比较高,阳性微滴簇比较明显,60 ℃时,阳性微滴的荧光信号强度略高于55 ℃。故60 ℃为优化的退火温度。
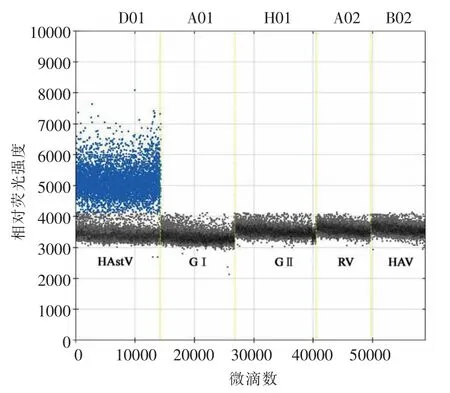
图3 HAstV RT-ddPCR 方法特异性Fig.3 Specificity of HAstV RT-ddPCR assay
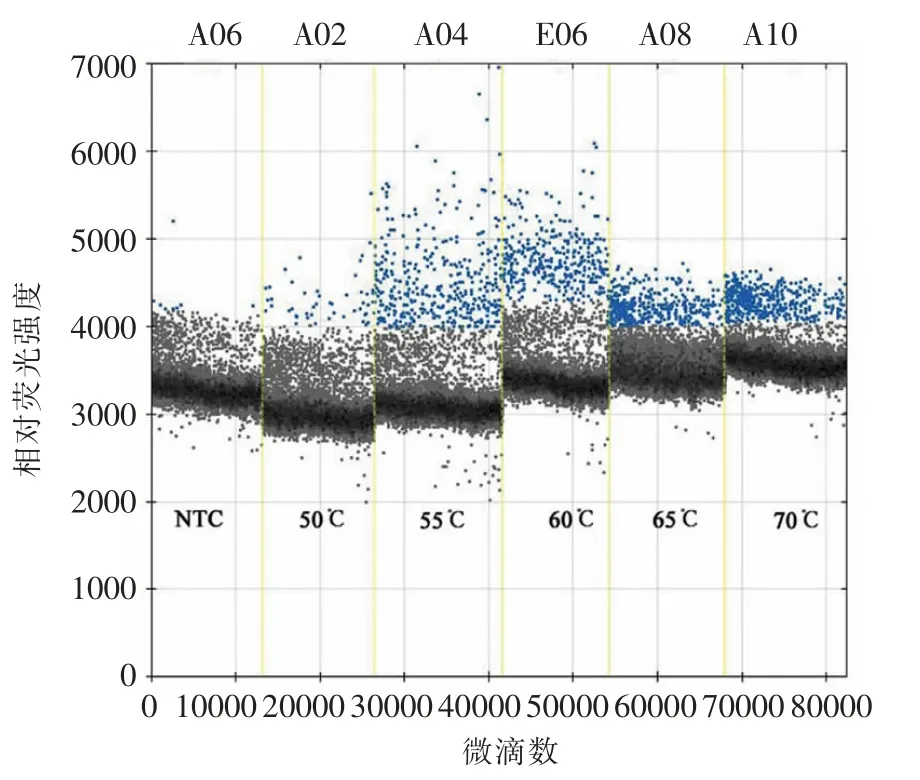
图4 优化HAstV RT-ddPCR 方法退火温度Fig.4 Annealing temperature optimizing of HAstV RT-ddPCR assay
2.3 HAstV RNA 标准样品
采用筛选出的特异性引物ORF2-F1/R1 扩增出含HAstV RT-ddPCR 目的序列的DNA 片段,构建重组质粒pcDNAII-HAstV,将该重组质粒线性化酶切后,采用T7 启动子进行体外转录,得到大约310 bp 的RNA 片段,将该片段的测序结果通过NCBI 在线工具BLAST 进行序列分析和比对,与GenBank 中HAstV-1 的基因序列的同源性可达100%,说明成功构建了含HAstV RT-ddPCR目的序列的RNA 片段。将该RNA 片段稀释,分装保存于-80 ℃。采用多家实验室联合定值方法确定该HAstV RNA 标准样品的特性值为5.52×106拷贝/μL。
2.4 HAstV RT-ddPCR 方法的定量低限和准确度
多倍梯度稀释HAstV RNA 标准样品,理论值分别为552 000.00,55 200.00,5 520.00,552.00,55.20,27.60,13.80,5.52 拷贝/μL。结果表明,552 000.00 拷贝/μL 超过了HAstV RT-ddPCR 检测方法的检测范围;在552 000.00~5.52 拷贝/μL范围内,各稀释度定量结果的RSD 值为3.7%~15.6%(表2),RT-ddPCR 测量值与理论值呈正相关,直线回归方程和决定系数分别为Y=1.050X-50.214,R2=0.9972(P<0.0001),说明HAstV RTddPCR 检测值与理论值相符,可定量检测HAstV RNA 浓度(图5)。浓度低至5 拷贝/μL 左右时,测量值RSD值小于25%,与理论值十分接近,说明HAstV RT-ddPCR 方法的定量低限为5 拷贝/μL。
2.5 HAstV RT-ddPCR 方法的重复性
高浓度的检测RSD 值分别为11.86%,7.48%和10.40%,3 份平行样品的定量结果分别为5 310.67,5 511.50,5 561.83 拷贝/μL,与理论值的偏差分别为3.79%,0.15%,0.76%;低浓度的检测RSD 分别为7.74%,5.51%和10.44%,3 份平行样品定量结果分别为5.30,5.63,4.98 拷贝/μL,与理论值的偏差分别为3.99%,1.99%和9.78%(表3)。结果表明,检测方法的重复性较好,同时高浓度的稀释梯度3 个平行样品的测量偏差总体上均低于低浓度的稀释梯度(图6)。由此可见,RT-ddPCR检测方法需要选择适合的稀释梯度对样品进行稀释,样品在稀释时的均匀性对HAstV RT-ddPCR的定量结果有较大影响。
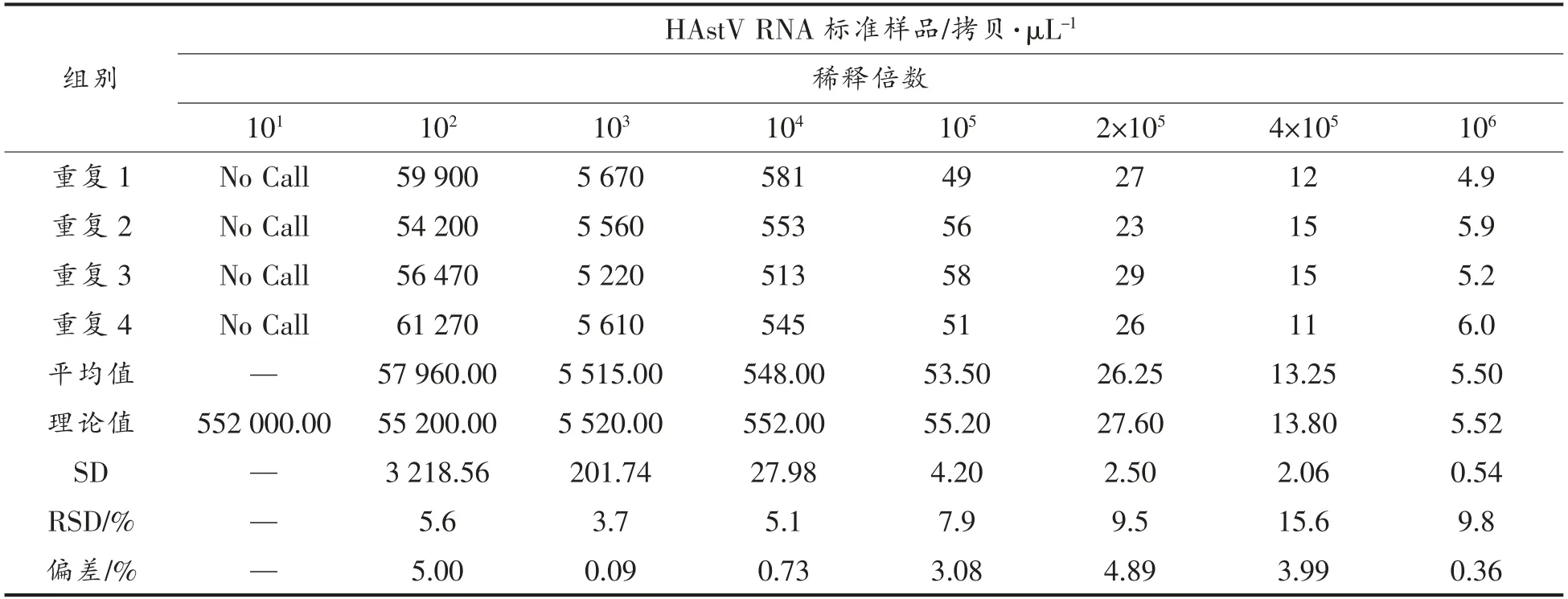
表2 HAstV RT-ddPCR 方法的定量低限与准确度Table 2 Lower limit of quantification and accuracy of HAstV RT-ddPCR assay
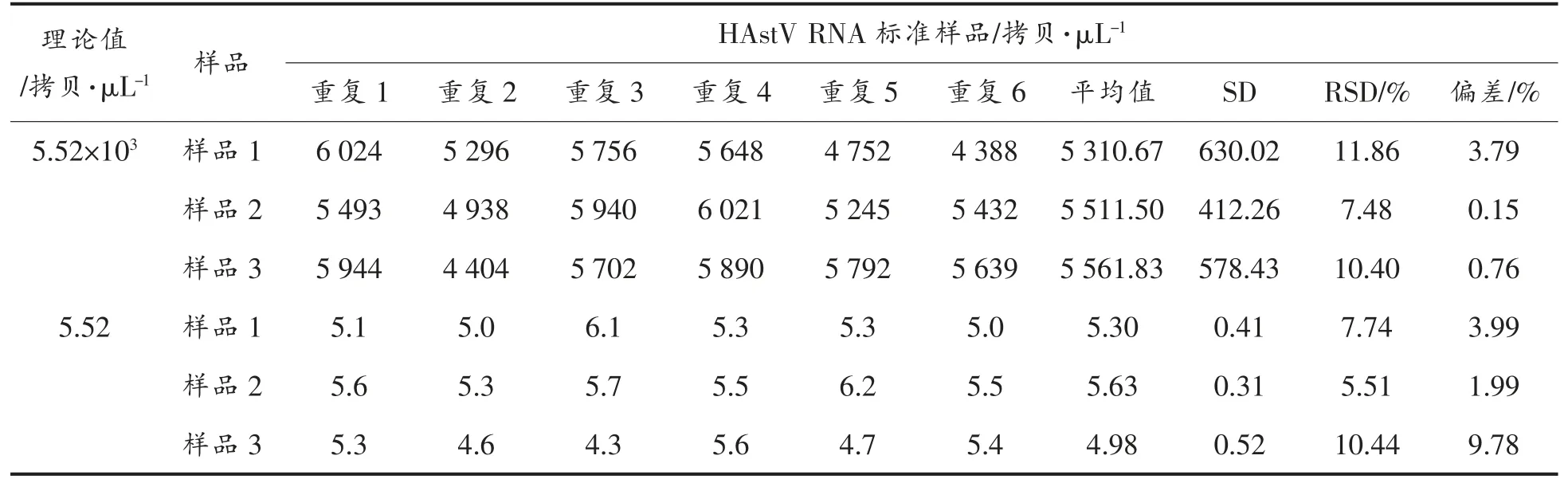
表3 HAstV RT-ddPCR 检测方法的重复性Table 3 Repeatability of HAstV RT-ddPCR assay
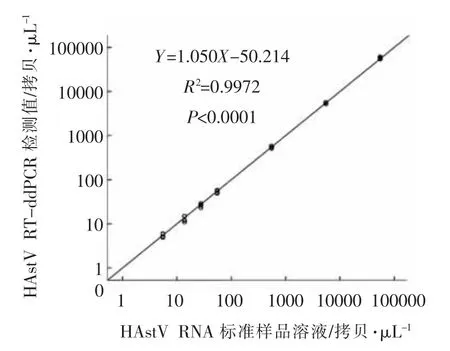
图5 HAstV RT-ddPCR 方法的线性相关性Fig.5 Linear relationship of HAstV RT-ddPCR assay
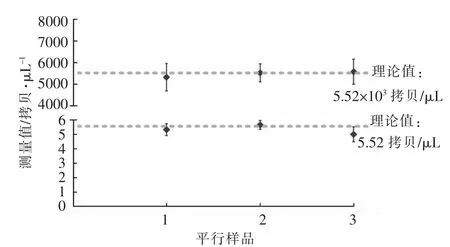
图6 HAstV RT-ddPCR 检测方法的精密度Fig.6 Precision of HAstV RT-ddPCR assay
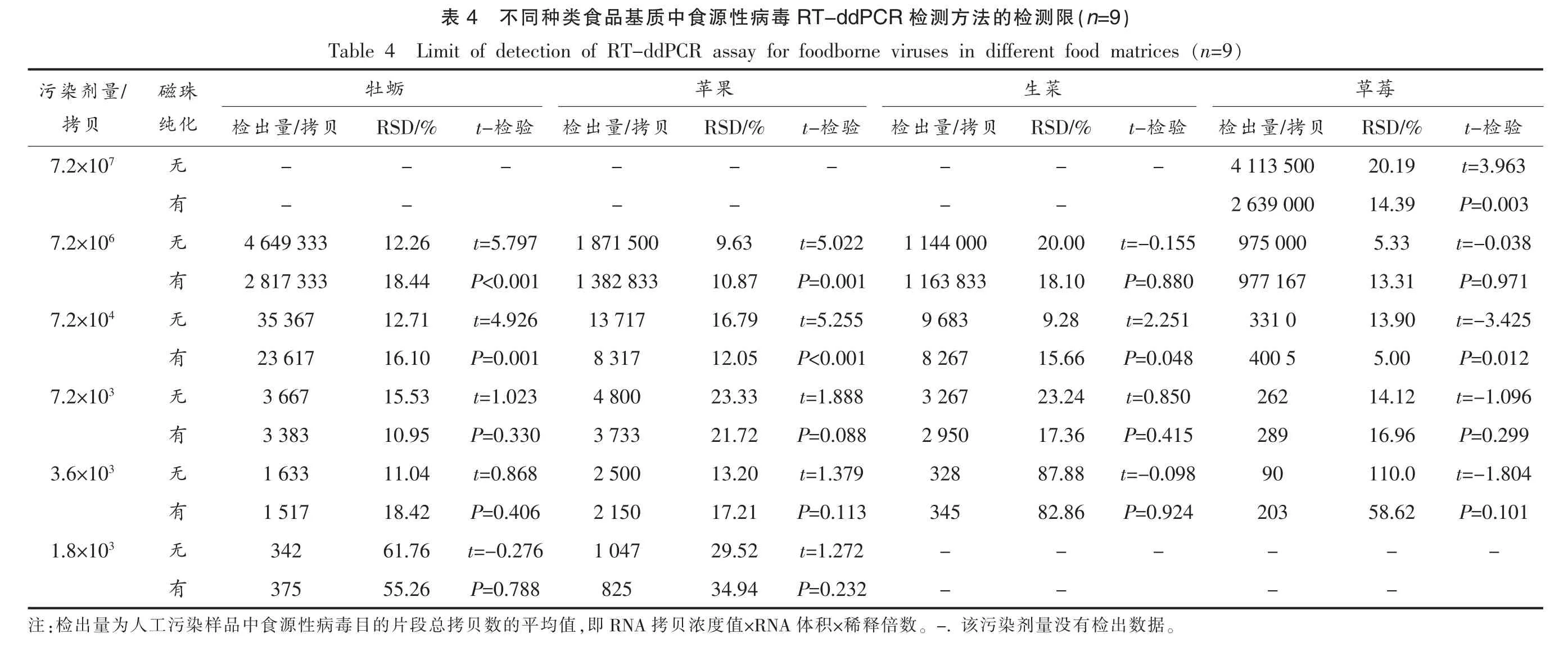
2.6 不同种类食品基质中的检测限
由表4可见,模拟病毒颗粒添加量为1.8×103拷贝时,牡蛎消化腺和苹果样品检出量的相对标准偏差(Relative standard deviation,RSD)均大于25%;模拟病毒颗粒添加量为3.6×103拷贝时,生菜和草莓样品的检出量RSD 值均大于25%。因此,贝类消化腺(牡蛎)和硬表面食品(苹果)样品中食源性病毒检测限为7.2×106~3 600 拷贝,生食蔬菜(生菜) 样品中食源性病毒的检测限为7.2×106~7 200 拷贝,软质水果(草莓)样品中食源性病毒检测限为7.2×107~7 200 拷贝。t-检验结果显示,不同种类食品基质样品中模拟病毒的添加量较高时,磁珠纯化的病毒检出量明显低于未经磁珠纯化的病毒检出量,差异有统计学意义(P<0.05),说明磁珠纯化后的模拟病毒模板含量降低,从人工污染样品提取的模拟病毒模板含量超过了磁珠纯化的最大载量;样品中模拟病毒的添加量为7 200~1 800 拷贝时,磁珠纯化没有明显提高各添加梯度样品的模拟病毒检出量,说明RT-ddPCR检测方法对扩增抑制剂有较高的耐受性,这与数字PCR 的原理有关。
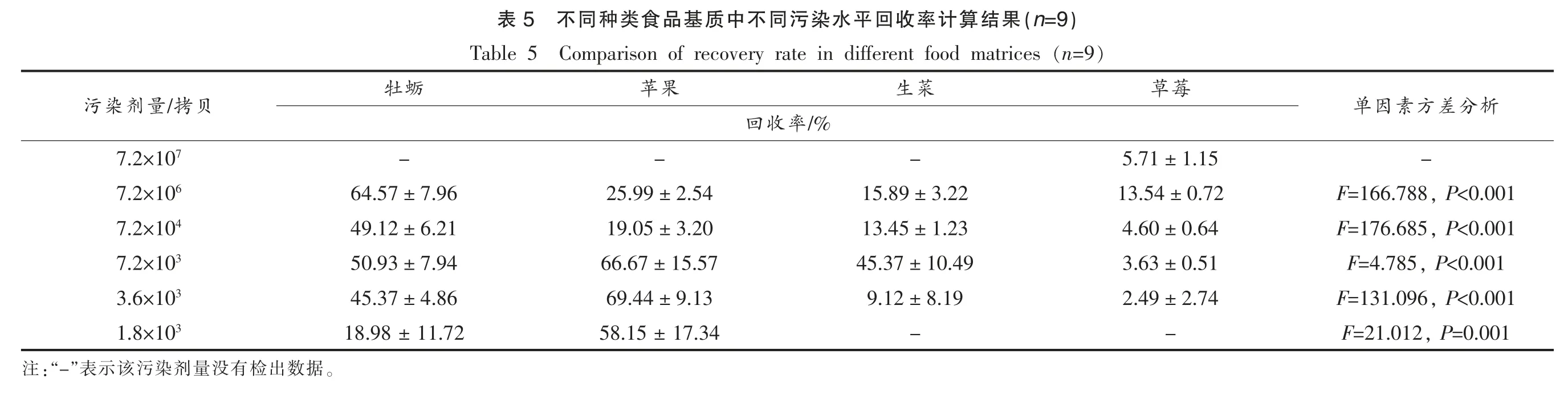
表5显示,贝类消化腺(牡蛎)、硬表面食品(苹果)、生食蔬菜(生菜)和软质水果(草莓)样品中模拟病毒回收率分别为18.98%~64.57%,11.55%~69.44%,9.12%~45.37%和2.49%~13.57%,其中,生食蔬菜和软质水果的回收率低于贝类消化腺和硬表面食品。单因素试验分析结果发现,各污染剂量的不同种类食品基质的模拟病毒回收率之间存在显著性差异(P<0.001),Turkey 多重比较分析发现,各污染剂量下,不同种类食品基质的回收率之间均有显著性差异(P<0.05)。
3 讨论
目前,qRT-PCR 方法是HAstV 分子检测的主要标准方法[6,9-10],该方法定量检测食品中星状病毒核酸时,标准曲线的制作和使用过程会给qRTPCR 定量结果引入额外偏倚[11]。qRT-PCR 定量检测的前提是未知样本的扩增效率和标准曲线的扩增效率完全一致,然而实际试验中,未知样本提取的核酸中可能存在扩增抑制剂,产生额外偏倚[12-13]。与qRT-PCR 相比,微滴数字PCR 不需要循环阈值标准曲线,可直接定量检测模板拷贝浓度,对核酸中的抑制剂有更好的耐受性[14-15],在提高核酸定量分析准确性和可靠性的优势比较明显。Tang 等[16]比较ddPCR 与qRT-PCR 对HBV 病毒质粒标准品定量结果时发现,ddPCR 对低拷贝质粒标准品的定量结果重复性优于qRT-PCR,两种方法对实际样品的定量结果具有很高的一致性。Hayden 等[17]指出,ddPCR 对高浓度巨细胞病毒标准品定量结果的变异系数较小,qRT-PCR 对于浓度较低的实际样品的变异系数较小且灵敏度更高。然而也有研究发现,ddPCR 能够从qRT-PCR 检测为阴性的咽拭子标本中检测出流感病毒载量,检测灵敏度更高[18]。本研究发现,HAstV RT-ddPCR 定量结果与理论浓度相符,相关系数为0.9972,定量范围可包括104~100(拷贝/μL)5 个数量级,最低定量限可达5 拷贝/μL,检测方法显示了良好的重复性。
由于HAstV 阳性生物样品有一定的生物安全问题,且培养纯化步骤繁琐,病毒浓度需要通过病毒侵染相应的宿主细胞系来确认,采用HAstV颗粒制备人工污染阳性样品的操作比较难以实现。MS2 噬菌体是一种无包膜+ssRNA 病毒,大小和结构与HAstV 比较接近,可通过双层琼脂法确定病毒滴度,且对人体没有致病性[19]。本研究采用MS2 噬菌体模拟HAstV,制备人工污染样品,探索不同种类食品基质HAstV RT-ddPCR 检测限。研究结果表明贝类消化腺样品和硬表面食品、生食蔬菜、软质水果的检测限分别为:7.2×106~3 600 拷贝,7.2×106~7 200 拷贝和7.2×107~7 200 拷贝。
采用RT-ddPCR 方法对食品中HAstV 进行定量检测,其关键在于针对不同种类食品基质采用合适的前处理方法。目前,应用最多的前处理方法为病毒颗粒洗脱-浓缩法[20]。本研究将常见的食源性病毒污染的食品分为贝类消化腺、硬表面食品、软质水果和生食蔬菜4 种食品基质类型,参照ISO/TS 15216-2:2013[6]对人工污染样品进行前处理。通过计算回收率发现,不同基质样品的回收率不同,且差异具有统计学意义(P<0.05),说明不同种类食品基质中病毒颗粒的洗脱-浓缩效率和RNA 提取效率不同。其中,生食蔬菜和软质水果的回收率明显低于其它2 种食品基质。对于软质水果和生食蔬菜这些酸性成分含量较高的食品基质表面的食源性病毒,通常采用pH≥9 的碱性缓冲液洗脱[21],并在洗脱液中加入牛肉膏和甘氨酸,以降低病毒颗粒的非特异性吸附[22-23],洗脱条件苛刻,操作繁琐;此外,树莓、草莓水果含果胶比较多,会对洗脱效果产生影响,降低回收率。病毒洗脱后通常采用PEG 沉降方法进行病毒浓缩[21],回收率优于超速离心方法[24-25]。也有研究表明,PEC沉降方法可分别从添加了104,106个病毒拷贝/10 g 冷冻树莓样品中成功回收GI 和GII 2 个基因型诺如病毒颗粒,回收率分别为7.4%~61.1%和20.7%~47.7%[21,26]。
)(n=9限测检的法方测检RT-ddPCR毒病性源食中质基品食类种同不4表)(n=9 Limit of detection of RT-ddPCR assay for foodborne viruses in different food matrices Table 4 莓草菜生果苹蛎牡珠磁/量剂染污验检t-RSD/%贝拷/量出检验检t-RSD/%贝拷/量出检验检t-RSD/%贝拷/量出检验检t-RSD/%贝拷/量出检化纯贝拷t=3.963 20.19 4 113 500---------无7 7.2×10 P=0.003 14.39 2 639 000------有t=-0.038 5.33 975 000 t=-0.155 20.00 1 144 000 t=5.022 9.63 1 871 500 t=5.797 12.26 4 649 333无6 7.2×10 P=0.971 13.31 977 167 P=0.880 18.10 1 163 833 P=0.001 10.87 1 382 833 P<0.001 18.44 2 817 333有t=-3.425 13.90 331 0 t=2.251 9.28 9 683 t=5.255 16.79 13 717 t=4.926 12.71 35 367无4 7.2×10 P=0.012 5.00 400 5 P=0.048 15.66 8 267 P<0.001 12.05 8 317 P=0.001 16.10 23 617有t=-1.096 14.12 262 t=0.850 23.24 3 267 t=1.888 23.33 4 800 t=1.023 15.53 3 667无3 7.2×10 P=0.299 16.96 289 P=0.415 17.36 2 950 P=0.088 21.72 3 733 P=0.330 10.95 3 383有t=-1.804 110.0 90 t=-0.098 87.88 328 t=1.379 13.20 2 500 t=0.868 11.04 1 633无3 3.6×10 P=0.101 58.62 203 P=0.924 82.86 345 P=0.113 17.21 2 150 P=0.406 18.42 1 517有------t=1.272 29.52 1 047 t=-0.276 61.76 342无3 1.8×10----P=0.232 34.94 825 P=0.788 55.26 375有。据数出检有没量剂染污该。-.数倍释稀×积体×RNA值度浓贝拷RNA,即值均平的数贝拷总段片的目毒病性源食中品样染污工人为量出:检注
)(n=9果结算计率收回平水染污同不中质基品食类种同不5表)(n=9 Comparison of recovery rate in different food matrices Table 5 莓草菜生果苹蛎牡析分差方素因单贝拷/量剂染污/%率收回-5.71±1.15---7 7.2×10,P<0.001 F=166.788 13.54±0.72 15.89±3.22 25.99±2.54 64.57±7.96 6 7.2×10 F=176.685,P<0.001 4.60±0.64 13.45±1.23 19.05±3.20 49.12±6.21 4 7.2×10,P<0.001 F=4.785 3.63±0.51 45.37±10.49 66.67±15.57 50.93±7.94 3 7.2×10,P<0.001 F=131.096 2.49±2.74 9.12±8.19 69.44±9.13 45.37±4.86 3 3.6×10,P=0.001 F=21.012--58.15 ± 17.34 18.98 ± 11.72 3 1.8×10。据数出检有没量剂染污该示:“-”表注
本研究建立的食品中HAstV 定量方法可概括为HAstV 与食品基质洗脱、浓缩后,提取HAstV RNA,RT-ddPCR 方法定量样品中HAstV RNA 含量,不考虑HAstV 回收率,灵敏度理论上可达5拷贝/μL。在实际检测食品样品时,HAstV 浓缩回收率和RNA 提取率都不可能达到100%,RTddPCR 定量检测结果不能反映实际样品中HAstV实际载量。因此在后续研究中,需要建立过程控制方案,反应实际样品中HAstV 回收率,通过该回收率可以实现食品样品中HAstV 的实际载量的检测和计算。

