基于谱效关系的辣木叶降糖活性物质研究
包伊凡,沈新春,韩欣然,张 羽,汪 芳
(南京财经大学食品科学与工程学院 江苏省现代粮食流通与安全协同创新中心江苏高校粮油质量安全控制及深加工重点实验室 南京210023)
糖尿病(Diabetes mellitus,DM)是一种以高血糖为特征的慢性代谢疾病。根据国际糖尿病联盟(IDF) 最新数据显示,2019年全球约有4.63 亿糖尿病患者,预计到2045年,将增加到7 亿[1]。糖尿病患者血糖水平不受控制的增加,可能导致心血管并发症、神经病变、肾衰竭,甚至增加癌症的风险。糖尿病有2 种类型:I 型糖尿病(T1DM)是胰岛β 细胞自身免疫性破坏的结果,仅占所有病例的5%;II 型糖尿病(T2DM)是最常见的疾病形式,占所有病例的90%以上。糖尿病发病机制主要是胰岛素抵抗和胰岛细胞功能障碍,而胰岛素抵抗是导致II 型糖尿病(T2DM)的主要原因。
辣木(Moringa oleifera Lam)是一种生长迅速的热带树种,为辣木科辣木属植物,被称为“鸡腿树”或“辣根树”,在全世界的热带和亚热带地区都有种植,在印度自古以来,它的不同部位就被用来当作食物和药物。辣木的花、根、叶和树皮可作为营养补充剂,并且其中的生物活性成分广泛应用于食品添加剂、护肤品、香水等领域[2-8]。辣木叶于2012年11月被我国卫生部批准成为新资源食品[9]。辣木叶中含有维生素、多酚、黄酮、酚酸、生物碱、芥子油苷、异硫氰酸酯、丹宁酸、皂苷等[10],具有降血糖,抗氧化,抗炎,保肝,抗肿瘤等作用[11-13]。大量研究表明,辣木叶中所含有的多糖、黄酮类物质、水溶性蛋白等物质具有抗氧化,降血脂,降血糖等活性,极具开发利用价值。研究表明,辣木叶具有预防II 型糖尿病的作用[14],且能有效缓解胰岛素抵抗[15]。在Ndong 等[16]的研究中,用GK 大鼠作为糖尿病模型,通过口服200 mg/kg 辣木叶粉,发现其能够改善糖尿病大鼠的血糖。Kumari[17]研究发现40 d 内每天服用辣木叶粉,能够显著降低30~60 岁的II 型糖尿病患者的空腹血糖水平(FBG)和餐后血糖水平(PPPG)。
指纹图谱技术是定性、定量区分和评价药材中各种化学成分含量差异的有效方法。随着分析技术的进步,指纹图谱技术越来越成熟,已得到国际认可[18]。谱效学是结合基础生物活性研究成果,通过生物信息学方法,得到“谱-效”关系,用于预测活性物质的方法[19]。
辣木叶中含有多种化学成分[20],其提取物具有显著的降糖作用[14,21-24],然而其活性物质基础并不明确。基于此,本研究建立IR-HepG2 胰岛素抵抗模型,评价正交试验得到的辣木叶提取物的降糖活性,采用谱效相关性分析法初步探讨辣木叶中具有降糖活性的化学成分。
1 材料与方法
1.1 材料与试剂
辣木叶,云南省昆明市;胎牛血清(FBS)、DMEM 培养基(低糖/高糖)、青霉素-链霉素混合液(Penicillin-Streptomycin)、胰蛋白酶-EDTA(Trypsin EDTA,0.05%)、PBS 缓冲液,美国Gibco公司;二甲基亚砜(DMSO)、MTT,美国Sigma 公司;重组人胰岛素细胞培养级,源叶生物;甲醇(色谱级),德国Meker 公司;葡萄糖测定试剂盒,上海荣盛生物技术有限公司;其它试剂均为国产分析纯级。
1.2 仪器与设备
SpectraMax M2e 多功能酶标仪,美国Molecular Devices 公司;SL-N 系列电子天平,上海民桥精密科学仪器有限公司;WH-2 微型漩涡混合仪,上海沪西分析仪器厂有限公司;Milli-Q Academic超纯水系统,美国Millipore 公司;PHS-3C pH 计,上海雷磁分析仪器有限公司;84-1A 磁力搅拌器,上海皖宁精密科学仪器有限公司;HH-2 数显恒温水浴锅,国华电器有限公司;生物安全柜,美国Thermo Fisher 公司。
1.3 试验方法
1.3.1 辣木叶提取物的制备 取辣木叶约20 g,按表1回流提取2 次,减压浓缩,用蒸馏水定容至400 mL,得质量浓度50 mg/mL 的辣木叶提取物。

表1 L9(34)正交试验因素水平Table 1 Design for factors and levels of L9(34) orthogonal test
1.3.2 不同方法的辣木叶提取物指纹图谱测定
1.3.2.1 供试品溶液和对照品溶液的制备 分别取1.3.1 中9 组辣木叶提取物,加超纯水稀释成5 g/mL 的溶液,过0.45 μm 滤膜,即得供试品溶液。称取芹菜素-7-O-葡萄糖苷、槲皮素-3-O-葡糖苷、山柰酚二乙酰-鼠李糖苷、山柰酚标准品适量分别溶于甲醇中,过0.45 μm 滤膜,即得对照品溶液。
1.3.2.2 指纹图谱测定 色谱柱:Agilent Extend-C18(4.6 mm×250 mm,5 μm)C18柱,以0.1%乙酸水为流动相A,以甲醇为流动相B,梯度洗脱:0~40 min,10%~40%B;40~50 min,40%~60%B,流速1 mL/min,柱温25 ℃,检测波长254 nm。
1.3.3 IR-HepG2 模型的建立
1.3.3.1 HepG2 细胞的培养[25]用DMEM 高糖培养基配制好含10%胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素的培养液。用配制好的培养液在5%CO2、37 ℃条件下培养细胞,每天观察,待细胞贴壁并长至80%进行细胞传代,即培养2 d 就可进行传代,传代后继续培养观察,待细胞以对数成倍增长至80%时用于试验。
1.3.3.2 胰岛素对细胞活力的影响测定(MTT 法)通过MTT 法筛选对HepG2 细胞活性影响较小的胰岛素浓度。取对数生长期的HepG2 细胞,进行细胞计数,以每孔10 000 个的细胞密度接种于96 孔板中,每孔体积为100 μL。将细胞置于37℃,CO2恒温培养箱中培养24 h 后,更换用新鲜培养液配制的不同浓度梯度的胰岛素,分别为10-9,10-8,10-7,5×10-7,10-6,5×10-6,10-5,5×10-5,10-4mol/L,100 μL/孔,并设立对照组,每个浓度取6 个平行。摇匀后在5%CO2、37 ℃条件下分别孵育12,24,36 h;孵育过后,每孔加入20 μL 5 mg/mL 的MTT 溶液,继续孵育3~4 h 后,弃上清液,每孔加入100 μL 的DMSO 溶出紫色晶体,振荡15 min,用酶标仪测定波长570 nm 处的吸光度,计算细胞存活率,见式(1)。

1.3.3.3 IR-HepG2 细胞模型的建立 观察细胞,待细胞长至80%处于对数生长期时,以每孔10 000 个的细胞密度接种于96 孔板中,每孔的体积为100 μL,在5%CO2,37 ℃恒温培养箱中培养24 h 后,更换为含10-9,10-8,10-7,5×10-7,10-6,5×10-6,10-5,5×10-5,10-4mol/L 不同浓度的胰岛素全培液和对照全培液100 μL/孔,每个浓度设6 个平行,5%CO2,37 ℃条件下分别孵育12,24,36 h 后,采用葡萄糖氧化酶法测定各孔葡萄糖的消耗量,计算葡萄糖的消耗量,见式(2)。

1.3.4 辣木叶提取物及二甲双胍对IR-HepG2 细胞葡萄糖消耗量的影响
1.3.4.1 辣木叶提取物及二甲双胍对HepG2 细胞活性的影响 通过MTT 法测定0.2,1,5 μg/mL 的辣木叶提取物及二级双胍对于HepG2 细胞活性的影响,方法同1.3.3.2。
1.3.4.2 辣木叶提取物及二甲双胍对IR-HepG2细胞葡萄糖消耗量的影响 取处于对数生长期的HepG2 细胞,以每孔10 000 个的细胞密度接种于96 孔板中,每孔体积为100 μL,于5%CO2,37 ℃培养24 h。将HepG2 细胞分组:正常组、模型组、样品组分别为5,10,20 μg/mL,每个浓度设置6 个平行。在5%CO2,37 ℃条件下孵育24 h 造成胰岛素抵抗细胞模型。造模后,按上述方法将受试品在培养箱中继续孵育24 h 后,按照葡萄糖测定试剂盒说明书,测定各组细胞葡萄糖消耗量。用MTT 法校正由于细胞数差异导致的结果差异,方法同
1.3.3.2 。结果用葡萄糖消耗量/MTT(GC/MTT)表示。
2 结果与分析
2.1 不同方法的辣木叶提取物指纹图谱
通过正交试验设计(表1)对9 份辣木叶样品进行指纹图谱分析,比较其相似度,结果表明样品指纹图谱(图1)的相似度分别为0.978,0.987,0.984,0.994,0.991,0.994,0.996,0.939,0.995,说明9 份样品中成分类别没有显著差异。
对9 个样品共11 个色谱峰(表2)的峰面积进行热图分析(图2),发现9 份样品中的化学成分含量有一定差异,通过聚类分析可将9 份样品分为2 大类,结合正交试验结果,可知这2 类分别为水提取物(S1~S3)和乙醇提取物(S4~S9)。
2.2 辣木叶提取物的降糖活性研究
2.2.1 胰岛素对HepG2 细胞活性的影响 由图3可知,将浓度为10-9~10-4mol/L 的胰岛素作用于HepG2 细胞。当作用时间为12 h 时,与正常组相比,胰岛素组的细胞存活率不受影响,可能是胰岛素作用时间较短,从而对于HepG2 细胞活性的影响不大。当胰岛素浓度为10-9mol/L 时,胰岛素浓度过低,作用效果不明显;当胰岛素浓度为10-4mol/L 时,胰岛素浓度过高,细胞活性受到显著影响。当作用时间为36 h 时,由于胰岛素的稳定性较差易分解导致作用效果不显著。因此,本文选取浓度为10-8~5×10-5mol/L 的胰岛素作用24 h建立IR-HepG2 模型。

表2 11 个峰的保留时间和峰面积Table 2 Retention time and peak area regarding eleven common peaks
2.2.2 胰岛素浓度筛选 通过胰岛素浓度筛选试验可知,当胰岛素浓度为5×10-8mol/L 和5×10-7mol/L 时,与正常组相比,HepG2 细胞的葡萄糖消耗量无显著差异(P>0.05),而当胰岛素浓度达到5×10-7mol/L 和10-6mol/L 时,HepG2 细胞的葡萄糖消耗量已明显低于正常对照组(P<0.05),随着胰岛素浓度的升高,HepG2 细胞的葡萄糖消耗量持续降低,而5×10-7mol/L 和10-6mol/L 的胰岛素已能引起细胞摄取葡萄糖能力受损,为避免高胰岛素对细胞造成毒性,本试验选用最小有效浓度5×10-7mol/L 为造模用胰岛素浓度(图4)。

图1 辣木叶不同提取方式样品的指纹图谱Fig.1 The chemical fingerprints of different Moringa oleifera leaves extracts
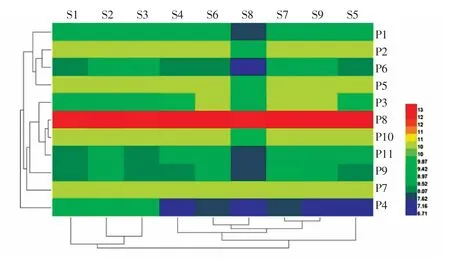
图2 正交试验中9 份辣木叶样品中的11 个共有峰峰面积热图Fig.2 Heat map analysis of 11 common peaks of Moringa oleifera leaves in orthogonal test
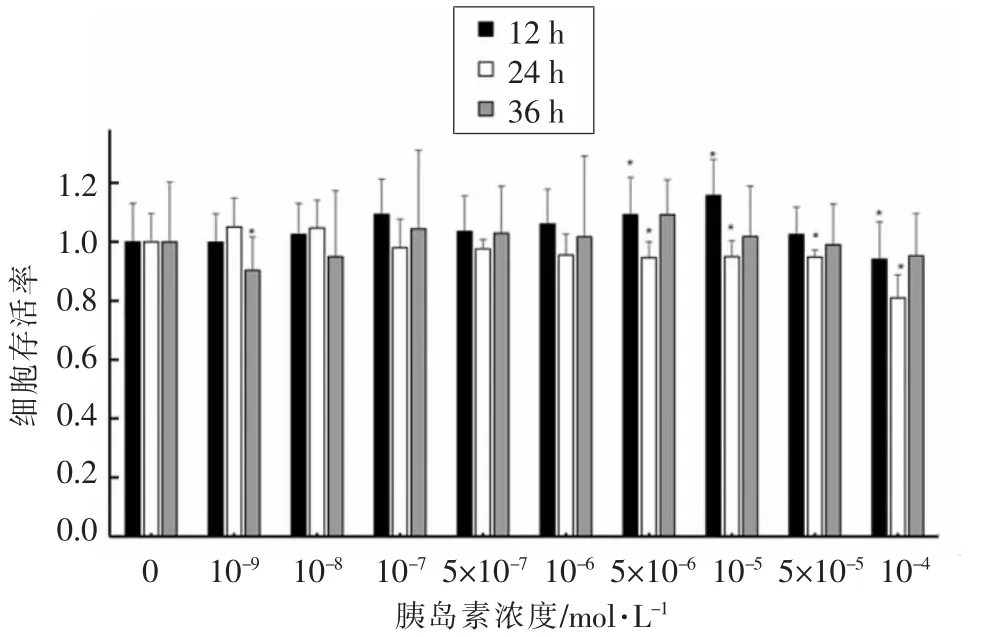
图3 不同浓度不同作用时间的胰岛素对HepG2细胞活性的影响Fig.3 Effects of insulin on HepG2 cell activity in different concentrations and at different time periods

图4 不同浓度的胰岛素作用24 h 对HepG2 细胞葡萄糖消耗量的影响Fig.4 Effects of insulin on glucose consumption of HepG2 cells in different concentrations in 24 h
2.2.3 辣木叶提取物对IR-HepG2 细胞葡萄糖消耗量的影响
2.2.3.1 辣木叶提取物对HepG2 细胞活性的影响由图5可知,与对照组相比,不同提取方式、提取时间的辣木叶提取物和二甲双胍作用后的HepG2 细胞存活率均在90%以上,故采用不超过20 μg/mL 的样品浓度用于后续试验。
2.2.3.2 辣木叶提取物对IR-HepG2 细胞葡萄糖消耗量的影响 由图6可知,与对照组相比,模型组HepG2 细胞在高浓度胰岛素条件下,葡萄糖消耗量显著下降(P<0.01),说明模型组细胞的葡萄糖吸收能力损伤,胰岛素敏感度下降,造模成功。5~20 μg/mL 的辣木叶提取物能显著促进IRHepG2 细胞对葡萄糖的吸收(P<0.05),能够有效缓解胰岛素抵抗,且具剂量依赖性。

图5 辣木叶提取物对HepG2 细胞活性的影响Fig.5 Effects of Moringa oleifera leaves extracts on HepG2 cell activity
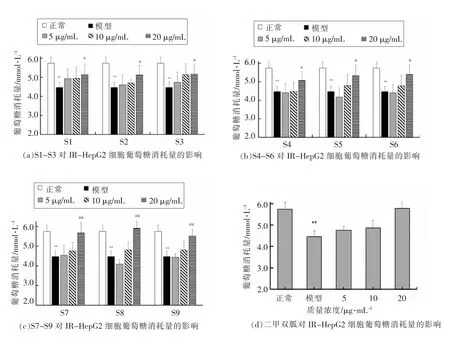
图6 辣木叶提取物对IR-HepG2 细胞葡萄糖消耗量的影响Fig.6 Effects of Moringa oleifera leaves extracts on glucose consumption in IR-HepG2 cells
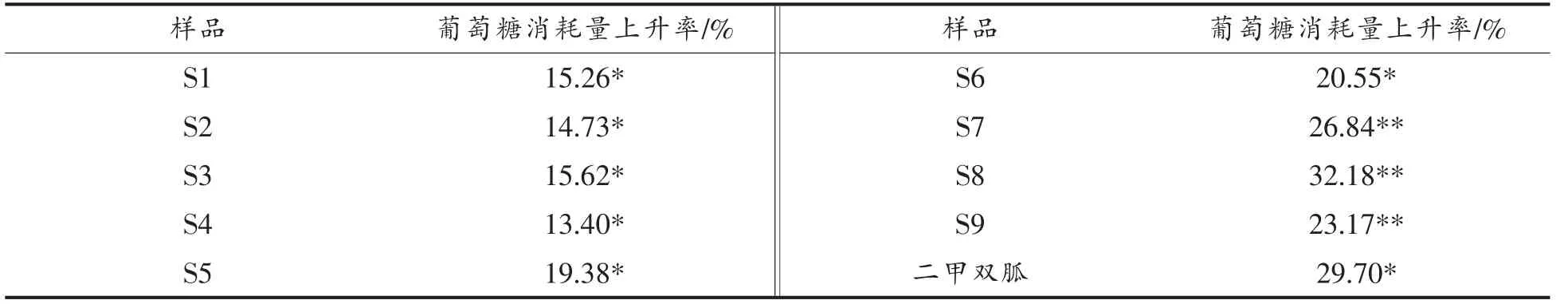
表3 20 μg/mL 时样品较模型组的葡萄糖消耗量上升率Table 3 Increasing rate of glucose consumption in each group of Moringa oleifera leaves extract samples and metformin compared with model group at 20 μg/mL
2.3 辣木叶提取物的降糖活性分析
2.3.1 正交试验结果 比较正交试验结果(表4)可知,各因素对辣木叶降糖活性影响顺序为:乙醇浓度(A)>提取时间(C)>溶剂体积(B),且降糖活性最适宜条件为A3B2C1,即80%乙醇、10+8 倍体积,提取时间1 h。
2.3.2 谱效双变量相关分析 采用SPSS for windows 16.0 中双变量相关分析法处理,计算指纹图谱中11 个共有峰与降糖活性的Person 相关系数(表6)。由图7可知峰6,7,8,9,10 与降糖活性呈显著正相关,其中峰6,7,8,9 与降糖活性的相关性极显著(P<0.01)。通过与对照品比对,色谱峰6 为芹菜素-7-O-葡萄糖苷,色谱峰7 为槲皮素-3-O-葡糖苷,色谱峰8 为山柰酚二乙酰-鼠李糖苷,色谱峰9 为山柰酚(图3)。

表4 L9(34)正交试验设计及结果Table 4 The design and results of L9(34) orthogonal test

表5 L9(34)正交试验方差分析Table 5 The ANOVA of L9(34) orthogonal test

表6 正交试验中9 份辣木叶提取物11 个共有峰与降糖活性的Pearson 相关系数Table 6 The Pearson correlation coefficient of 11 common peaks regarding the nine Moringa oleifera leaves extract samples in orthogonal test

图7 辣木叶提取物液相色谱图(a)及混合标准品色谱图(b)Fig.7 HPLC chromatogram of Moringa oleifera leaves extract(a) and mixed standard(b)
2.3.3 验证分析 辣木叶中4 个主要活性成分峰为6~9 号峰,即芹菜素-7-O-葡萄糖苷、槲皮素-3-O-葡糖苷、山奈酚二乙酰-鼠李糖苷和山奈酚,进而验证4 种单体化合物在3 种质量浓度下(5,10,20 μg/mL)都能显著促进葡萄糖消耗量(图8),其结果显示当质量浓度为20 μg/mL 时,葡萄糖消耗量上升率均在20%以上(表7)。同时,为比较这4 种活性成分对于辣木叶降糖活性的相对活性贡献度,测定其在9 份辣木叶提取物样品的含量分别为:芹菜素-7-O-葡萄糖苷(0.09~0.13 mg/g)、槲皮素-3-O-葡糖苷(0.40~0.65 mg/g)、山奈酚二乙酰-鼠李糖苷(26.50~29.99 mg/g)和山奈酚(0.02~0.12 mg/g),计算4 种活性成分在辣木叶中的相对活性贡献度,公式为:相对活性贡献度=各单体化合物葡萄糖消耗量上升率×相对含量(相对含量是指每mg 辣木叶中所含的各单体化合物的量),其中山奈酚二乙酰-鼠李糖苷是辣木叶降糖的主要活性物质(图9)。
3 结论

图8 芹菜素-7-O-葡萄糖苷、槲皮素-3-O-葡糖苷、山奈酚二乙酰-鼠李糖苷和山奈酚对IR-HepG2 细胞葡萄糖消耗量的影响Fig.8 Effects of apigenin-7-O-glucoside,quercetin-3-O-glucoside,kaempferol diacetyl-rhamnoside,kaempferol on glucose consumption in IR-HepG2 cells
我国是糖尿病大国,糖尿病患者逐年增加,且患者主要为II 型糖尿病[26]。II 型糖尿病主要是由胰岛素抵抗而产生的胰岛素相对缺乏导致[27-29]。目前控制糖尿病多采用西药降糖,长期服用西药将对身体产生不同程度的副作用,如使肝脏、肾脏出现功能障碍,使胃肠道出现不良反应等症状。尤其是双胍类药物,会对肾脏、肝脏功能产生非常显著的影响。长期服用降糖药物也容易使患者产生药物抵抗的现象,使药效明显降低。因此,运用高效低毒性的纯天然降糖活性物质来辅助降糖是未来控制糖尿病的研究方向。
辣木叶作为一种植物新资源食品,其较高的营养价值,以及多方面的生物活性使其受到深入研究和开发[30]。辣木叶的降血糖活性在临床上也得到了验证[31-32],能显著降低血糖水平,提高胰岛素敏感性。本文考察提取过程中的乙醇浓度、溶剂体积和提取时间对于辣木叶降糖活性的影响,故采用正交试验优化提取方式,建立IR-HepG2 细胞胰岛素抵抗模型,以细胞的葡萄糖消耗量为指标,评价辣木叶提取物的降糖活性,结合正交设计优化提取方式,发现提取时间对于辣木叶降糖活性的影响较大。同时结果表明80%乙醇、10+8 倍溶剂体积,提取时间1 h 条件下的辣木叶提取物具有最强的降糖活性。

表7 20 μg/mL 标品较模型组的葡萄糖消耗量上升率Table 7 Increasing rate of glucose consumption in apigenin-7-O-glucoside,quercetin-3-O-glucoside,kaempferol diacetyl-rhamnoside,kaempferol compared with model group at 20 μg/mL
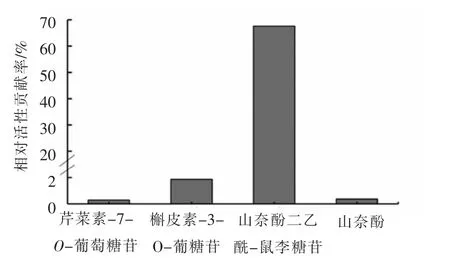
图9 芹菜素-7-O-葡萄糖苷、槲皮素-3-O-葡糖苷、山奈酚二乙酰-鼠李糖苷和山奈酚在辣木叶中的相对活性贡献率分析Fig.9 The relative active contributions regarding apigenin-7-O-glucoside,quercetin-3-O-glucoside,kaempferol diacetyl-rhamnoside,kaempferol in Moringa oleifera leaves
本文测定了9 种辣木叶提取物的指纹图谱,通过相似度分析发现其化学成分差异不大。通过建立IR-HepG2 模型评价辣木叶提取物的降糖活性,随着辣木叶提取物浓度的上升,HepG2 细胞摄取葡萄糖的能力上升,有效缓解胰岛素抵抗。而辣木叶组成复杂,化学指纹图谱无法确定其中的活性物质,因此,将指纹图谱与降糖活性评价相结合,通过相关性分析研究其谱效关系,初步探索辣木叶中的降糖活性成分群。本文通过分析辣木叶降糖活性与其指纹图谱的相关性,发现辣木叶中降糖活性物质可能为芹菜素-7-O-葡萄糖苷、槲皮素-3-O-葡糖苷、山柰酚二乙酰-鼠李糖苷和山柰酚,这4 种物质与降糖活性的相关性极显著,而山柰酚二乙酰-鼠李糖苷是辣木叶中起到降糖作用的主要活性成分。与文献[33-34]报道中山奈酚与槲皮素及其衍生物能够缓解HepG2 的胰岛素抵抗,芹菜素-7-O-葡萄糖苷能够作为α-葡萄糖苷酶发挥降糖作用[35]相吻合。辣木叶组成复杂,各成分也可能存在相互作用,各降糖活性成分缓解胰岛素抵抗的作用机制仍需进一步研究。
本文结合化学指纹图谱与降糖活性评价,通过建立谱效关系,初步定位了辣木叶中具有降糖活性的成分,本研究为辣木叶降糖活性成分的分离纯化提供了参考依据。

