几种植物多糖降血糖活性的对比研究
刘丹奇,任发政,2,侯彩云,2*
(1 北京食品营养与人类健康高精尖创新中心 中国农业大学食品科学与营养工程学院 北京100083 2 食品质量安全北京实验室 中国农业大学食品科学与营养工程学院 北京100083)
糖尿病是一种常见的非传染性内分泌代谢紊乱疾病。近年来,世界范围内的糖尿病患病率呈上升趋势,预测到2035年,病例数将增加到约5.92亿人次,平均每12 人中就有1 位糖尿病患者[1]。目前市场上治疗糖尿病的药物毒副作用较强,为寻求安全性更好的辅助治疗成分,许多研究者对功能性多糖进行了研究,已发现多种具有降血糖活性的植物来源多糖[2]。其中,被列入国家“药食同源”目录的茶、枸杞、桑叶为原料提取的多糖,均被证实具有一定的降血糖功效[3-5]。
茶多糖是茶叶中存在的一类功能成分,目前研究表明其大多是与蛋白质结合的酸性糖蛋白[6]。目前,对绿茶、红茶、乌龙茶等原料中茶多糖降血糖功能的研究较集中,其中红茶多糖表现出较优的降血糖活性[3]。枸杞果实被用于传统中医已有1900 余年,枸杞多糖被认为是果实中的主要活性成分[7]。已有研究表明枸杞多糖具有治疗糖尿病的生物功效,能够缓解糖尿病兔的氧化应激,调节肥胖饮食小鼠的血糖和血脂代谢,改善糖尿病兔的肾病并发症[4,8-10]等。我国历代均有用桑叶治疗糖尿病的记载,桑叶中的功能成分桑叶多糖被证实对糖尿病具有一定的治疗作用[5],并且已有多位学者研究了桑叶多糖的具体降血糖机制[11-15]。
为对比茶多糖与不同植物来源多糖降血糖效果的差异,本研究以白琳工夫为原料提取的红茶茶多糖为研究对象,以同属“药食同源”名录的枸杞、桑叶中提取的多糖作对比,通过对不同指标的测定,研究植物多糖的降血糖效果,分析所选多糖提取物的降血糖机制,为植物多糖的开发利用提供参考。
1 材料与方法
1.1 材料、试剂与实验动物
红茶多糖提取物、枸杞多糖提取物、桑叶多糖提取物,陕西杨凌慈缘生物技术有限公司。
盐酸二甲双胍药物,中美上海施贵宝制药有限公司;葡聚糖标准品、单糖标准品、链脲佐菌素粉末状(Streptozotocin,STZ),美国Sigma 公司;Trizol 试剂、DEPC 水,碧云天生物科技有限公司;无水乙醇、氯仿、异丙醇等(分析纯级),北京化工厂有限责任公司;EvaGreen 2X qPCR MasterMix-No Dye 试剂盒、5X All-In-One RT MasterMix 试剂盒,美国abm 公司;小鼠引物材料,生工生物工程(上海)股份有限公司。
雄性4 周龄SPF 级ICR 小鼠(许可证号SCXK(京)2016-0002),北京斯贝福生物技术有限公司;高糖高脂饲料(45%脂肪供能),北京华阜康生物科技股份有限公司。小鼠实验环境为屏障环境动物房:12 h 昼夜交替,压差20~50 Pa,湿度(50±5)%,温度(22±2)℃。
1.2 仪器与设备
DIONEX ICS-3000 USA 离子色谱测定仪,瑞士万通中国有限公司;Wyatt Technology DAWN EOS 多角度激光光散射仪,美国怀雅特技术公司;Epoch 酶标检测仪,美国伯腾仪器有限公司;Roche 活力型血糖仪,德国罗氏诊断有限公司;Nikon Eclipse Ci 光学显微镜,尼康仪器(上海)有限公司;Thermofisher Nanodrop 2000 核酸蛋白检测仪,赛默飞世尔科技(中国) 有限公司;Roche lightcycler 96 荧光定量PCR 仪,德国Roche 公司;Biometra T-personal 梯度PCR 仪,北京世贸远东科学仪器有限公司。
1.3 方法
1.3.1 植物多糖提取物样品分子质量的测定 多糖提取物样品的绝对重均分子质量测定仪器为尺寸排除色谱和多角度激光光散射仪联用装置(SEC-MALLS)。色谱柱型号Shodex OHpak SB-806MHQ(8 mm×300 mm),检测仪器种类为示差折光检测器。检测波长658.0 nm,柱温保持25 ℃,选用0.1 mol/L 氯化钠+叠氮化钠的水溶液作为检测流动相,样品溶液质量浓度1 mg/mL,进样量200 μL,洗脱流速0.5 mL/min,最后过滤选用0.2 μm滤膜。对照样品为葡聚糖标准品(40 000 u)。
1.3.2 植物多糖提取物样品的理化成分测定 参照已有研究方法,各理化成分测定方式分别为:多糖含量:苯酚-硫酸比色法[16];蛋白质含量:考马斯亮蓝试剂盒;多酚含量:福林酚法[17];总黄酮含量:三氯化铝比色法[18]。
1.3.3 植物多糖提取物样品的单糖组成测定 水解管中放入称取的10 mg 多糖,加入4 mL 4 mol/L的三氟乙酸,之后充氮1 min 排尽管内空气,旋紧管盖,于120 ℃条件下水解2 h。冷却后氮气吹干水解液,去除过量的三氟乙酸,倒入超纯水定容至10 mL。稀释后,使用0.2 μm 滤膜过滤,静置准备进样。采用同样方法处理单糖标准品。
离子色谱条件:分析柱型号Carbo PacTMPA20 3 mm×150 mm Analytical,250 mmol/L NaOH作为淋洗液,柱温35 ℃,流速0.5 mL/min,进样体积10 μL,采用脉冲安培检测器和金电极。
木糖和甘露糖洗脱流程:A 为水,B 为250 mmol/L 的NaOH;0~20 min,99%A,1%B;20~20.1 min,20%A,80%B;20.1~30 min,20%A,80%B;30.1~40 min,99%A,1%B。
其它单糖和糖醛酸洗脱流程:A 为水,B 为250 mmol/L 的NaOH,C 为1 mol/L 的NaAC;0~20 min,94%A,6%B,0%C;20~20.1 min,89%A,6%B,5%C;20.1~35 min,74%A,6%B,20%C;35.1~45 min,20%A,80%B;45.1~55 min,94%A,6%B。
1.3.4 动物实验
1.3.4.1 小鼠糖尿病造模方式和分组 小鼠适应性喂养7 d,任意抽取10 只为正常对照组(NC),饲料不变,其余小鼠喂养高糖高脂饲料(45%脂肪供能),持续4 周,12 h 隔夜禁食,使用pH 4.2~4.5柠檬酸盐缓冲液溶解粉末状STZ,采用腹腔注射110 mg/(kg·m)STZ 溶液对小鼠造模,1 周后测定各组小鼠空腹血糖(Fasting blood glucose,FBG),造模成功标准为FBG ≥11.1 mmol/L[19]。根据FBG数值对达到标准的小鼠任意分组,分为阳性对照组(PC)、模型对照组(MC)、BPS 灌胃干预组、LPS灌胃干预组、MPS 灌胃干预组,每组小鼠数量定为10 只。
1.3.4.2 灌胃剂量确定 参考已有研究[4]确定小鼠的灌胃剂量,多糖灌胃干预组均保持300 mg/(kg·d)。阳性对照组为盐酸二甲双胍,参考成年人最大剂量(1~1.5 g/d),根据文献[20]换算后确定小鼠灌胃剂量为250 mg/(kg·d)。
1.3.5 各项生化指标测定 在4 周小鼠灌胃干预实验结束时,统一12 h 隔夜禁食,采全血。收集血样置于4 000 r/min,4 ℃条件下离心15 min,分离血清,使用全自动生化分析仪测定血清谷草转氨酶(Aspartate transaminase,AST) 和谷丙转氨酶(Alanine transferase,ALT),按照试剂盒说明书方法测定血清中胰岛素(Fasting insulin,FIS)及肝组织中肝糖原含量、葡萄糖激酶(Glucokinase,GK)活性、丙酮酸激酶(Pyruvate kinase,PK)活性。
1.3.6 小鼠胰腺组织病理情况观察 剖取小鼠胰腺组织,48 h 内固定于4%多聚甲醛,常规处理后制片(厚度4 μm),染色方法采取HE 染色法,最后使用光学显微镜观察并拍照(200 倍视野)。
1.3.7 基因荧光定量PCR 检测 小鼠肝脏RNA使用Trizol 试剂抽提,处理后反转录制得cDNA第1 链,之后采用10 μL 体系荧光定量,其中加入5 μL EvaGreen 2X qPCR MasterMix-No Dye 试剂和1 μL cDNA 模板,0.3 μL 上游引物(10 nmol/L),0.3 μL 下游引物(10 nmol/L),最后加入ddH2O到预定体积。检测程序设置为:95 ℃,10 min;95 ℃,15 s;60 ℃,60 s,循环45 次。实验内参基因选择GAPDH,各基因表达情况分析采用2-ΔΔCT法[21]。
具体测定基因:硫氧还蛋白互作蛋白(Thioredoxin interacting protein,TXNIP)、叉头转录因子(Forkhead box O1,Foxo1)、磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxykinase,PEPCK)和葡萄糖-6-磷酸酶(Glucose-6-phosphatase,G6Pc),引物序列如表1所示。

表1 引物序列Table 1 Primer sequences
1.4 数据处理
统计学分析使用SPSS 20.0 软件,数值表示为均值±标准误差(±s);采用单因素方差分析不同组别数值,其中P<0.05 代表存在显著差异,P<0.01代表存在极显著差异。Origin 8.0 软件绘制图像。
2 结果与分析
2.1 分子质量测定结果
按照1.3.1 节方法测定葡聚糖标准品,精确度确定后检测提取物样品,结果如图1所示。
从图谱可见,3 种提取物均含有杂峰,同时峰形较宽,峰形未出现单一对称情况,其中LPS 存在2 个明显的吸收峰,MPS 存在3 个明显的吸收峰,三者均为不均一的杂多糖。根据图谱测定得出BPS、LPS 及MPS 的绝对重均分子质量依次为8 745,22 410,34 430 u。三者检测结果的差异可能与原料种类差异有关。
2.2 植物多糖提取物的主要成分
由表2可见,MPS 的总黄酮和多酚含量显著高于BPS 和LPS(P<0.05),LPS 的蛋白质含量显著低于BPS 和MPS(P<0.05),多糖含量无显著差异。

图1 分子质量的测定结果Fig.1 The determination result of molecular mass

表2 植物多糖提取物的主要成分Table 2 The main components of plant polysaccharides
2.3 植物多糖提取物的单糖组成测定结果
根据色谱各峰保留时间对应各单糖标准品可知,BPS 及MPS 均由阿拉伯糖、木糖、岩藻糖、鼠李糖、甘露糖、半乳糖、葡萄糖、半乳糖醛酸、葡萄糖醛酸等单糖组成。LPS 未检出岩藻糖,由其余8种单糖组成。三者在每种单糖的占比方面存在差异,按上述单糖分子质量由小到大的顺序排列单糖的摩尔质量占各自多糖的百分数,如表3所示。已有研究发现,阿拉伯半乳聚糖可能是多糖中的主要功能性成分[22-23],具有降血糖活性,其中阿拉伯糖为主要组成成分。由表3可知,在组成植物多糖的单糖中,阿拉伯糖和木糖的摩尔质量占比呈现出BPS>MPS>LPS 的规律。此外,BPS 中的甘露糖占比明显高于MPS 和LPS。推测这些差异可能对多糖的降血糖活性产生影响。

表3 植物多糖提取物的单糖摩尔质量占比对比Table 3 Comparison of monosaccharide molar amount ratio of plant polysaccharides
2.4 植物多糖提取物的降血糖效果指标分析
2.4.1 模型小鼠体重、血糖和胰岛素抵抗指数(HOMA-IR) 测定结果 糖尿病模型小鼠表现出多种典型症状,比如体重降低、多尿、多食、多饮。已有研究表明胰岛素抵抗是造成糖尿病的一种基础原因,原理为靶器官对胰岛素的敏感程度减弱,导致机体过量分泌胰岛素,进而演变成高胰岛素血症[24]。胰岛素敏感性的改善可通过减轻胰岛素抵抗程度来实现。胰岛素抵抗指数是判断的标准之一,已有研究确定其计算方法为[25]:HOMA-IR=FBG×FIS/22.5。各组小鼠不同时期体重、血糖和HOMA-IR 指标的检测情况如图2所示。


图2 植物多糖提取物对小鼠体重、始末血糖及HOMA-IR 的影响Fig.2 Effects of plant polysaccharides on body weight,whole blood glucose and HOMA-IR
由图2a 可知,正常对照组小鼠体重相对变化小,MC 组小鼠和PC 组小鼠体重变动相对较大,整体上呈降低趋势。在第3、4 周BPS 组和MPS 组小鼠体重有所回升,LPS 组体重显现出降低趋势。为更易体现组间差别,统计小鼠的体重增长率,如图2b 所示。MC 组指标为负值,推测由诱导造模糖尿病导致;LPS 组指标与MC 组未产生显著差异(P>0.05),表明其恢复小鼠体重的效果较差;BPS组和MPS 组的指标均超过MC 组,且达到显著水平(P<0.05),而PC 组指标超过MC 组,且达到极显著水平(P<0.01),这可以表明各组灌胃干预都能够改善模型小鼠体重减轻的症状。
图2c 表明,造模成功时各组小鼠FBG 无显著差异(P>0.05)。经4 周灌胃干预后,MC 组指标升高,而并未表现出显著差异(P>0.05),PC,BPS,LPS,MPS 干预组小鼠的血糖下降率依次为53.2%,61.6%,52.8%和53.8%。可知降血糖效果由高到低分别为BPS,MPS,PC,LPS。
图2d 表明,小鼠造模完成后IR 数值显著上升,MC 组小鼠指标高于NC 组小鼠指标且达到极显著差异(P<0.01)。各灌胃干预组小鼠指标低于MC 组小鼠指标,且达到极显著差异(P<0.01),均有较好的缓解效果,其中BPS 效果最佳,之后为MPS 和LPS,3 组之间未表现出显著差异(P>0.05)。
2.4.2 植物多糖提取物对糖尿病小鼠糖代谢相关生化指标的影响 糖代谢途径是机体调节血糖水平的重要途径。葡萄糖激酶(GK)可通过催化葡萄糖分解从而调节人体葡萄糖水平,在肝脏细胞中受胰岛素诱导合成;丙酮酸激酶(PK)通过参与糖酵解途径下调血糖水平。为研究茶多糖对糖代谢途径的影响,测定各组小鼠的肝脏肝糖原含量、GK 活性及PK 活性,结果如表4所示。
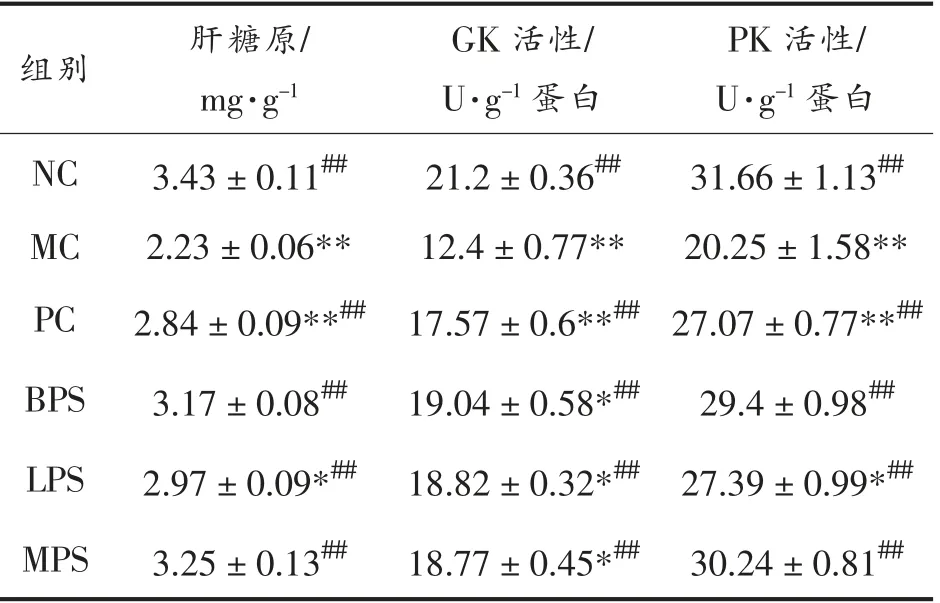
表4 小鼠糖代谢相关指标水平Table 4 Mice glucose metabolism related index level
MC 组的肝糖原含量、GK 活性和PK 活性均极显著低于NC 组(P<0.01),表明糖尿病造成小鼠机体糖代谢紊乱,抑制了糖酵解途径和肝糖原的合成,造成血糖水平升高。药物和多糖干预组肝糖原含量和GK 活性均极显著高于MC 组(P<0.01),表明干预组均能够促进葡萄糖转化为肝糖原,缓解糖尿病引起的肝糖原含量下降,并能够提高GK活性,提高胰岛素诱导合成能力。其中,MPS 增加肝糖原含量效果最优,其次为BPS 和LPS;BPS 提高GK 活性效果最优,其次为LPS 和MPS,3 组GK 活性与肝糖原含量均未能恢复至正常水平。PC 组和多糖干预组的PK 活性极显著高于MC 组(P<0.01),具有很好的促进糖酵解的效果。其中,BPS 略逊于MPS(P>0.05),优于LPS。
2.4.3 组间小鼠胰腺组织的病理状态对比 各组小鼠胰腺组织的病理状态如图3所示,可看出,正常组小鼠胰岛形态正常,同时可观察到腺泡细胞形态正常,此外视野内细胞呈均匀分布。MC 组小鼠胰岛存在变形,腺泡结构损坏且分布减少,同时存在组织增生现象,整体可看出糖尿病造模过程严重损伤了胰岛组织,并出现了脂肪变性的先兆。药物灌胃干预组胰岛存在变形情况,出现很多胞质疏松或者显现出空泡状态的细胞,部分胰岛附近观察到淋巴细胞浸润现象,整体可看出药物组小鼠的病理状况较严重,药物盐酸二甲双胍的改善效果不太显著。

图3 小鼠胰腺组织对比Fig.3 Comparison of mice pancreas
各多糖灌胃干预组小鼠的胰岛均存在变形情况,出现较少胞质疏松或者显现出空泡状态的细胞;BPS 组小鼠的部分组织周围可观察到较少炎性细胞浸润情况;MPS 组小鼠胰腺组织可观察到较多细胞胞核紧缩深染,未观察到其它明显异常情况。可推测,实验所选多糖灌胃干预后均能减轻小鼠因糖尿病造模导致的胰腺组织病变,然而总体上无法恢复正常,不同组别间也无明显差异。在减轻小鼠因糖尿病导致的胰腺组织病变方面,实验所选多糖提取物明显优于盐酸二甲双胍药物。
2.4.4 植物多糖提取物灌胃干预影响小鼠部分基因表达的对比分析 为进一步探究实验所选的植物多糖提取物可能涉及的降血糖机制途径,定量测定各组小鼠肝脏组织中部分关键基因的相对表达量,结果如图4所示。
Foxo1 基因能够抑制胰岛β 细胞增殖,是一种关键调控基因[26],表现为减少胰岛素分泌,控制血糖升高。图4a 表明,MC 组小鼠该基因相对表达量高于NC 组,且达到极显著水平(P<0.01)。与MC组相比,多糖灌胃干预均使指标极显著下降(P<0.01),其中BPS 测定结果最佳,其次为MPS、PC和LPS,干预组间未达到显著差异水平(P>0.05)。可以由此推测,实验所选多糖提取物降低糖尿病小鼠高血糖的效果可能与下调Foxo1 基因的相对表达途径有关。

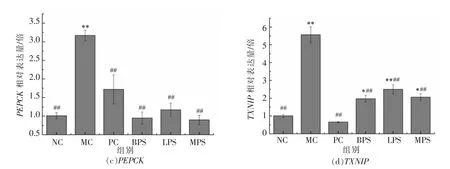
图4 植物多糖提取物影响小鼠部分基因表达的对比Fig.4 Comparison of the effects of plant polysaccharide extracts on the expression of some genes in mice
G6Pc 和PEPCK 基因都是糖异生途径中的关键调控基因,两者表达量增加后,能够推动非糖物质向葡萄糖的转化过程,并从肝脏组织转运到血管中,最终使得血糖升高[2]。图4b 和图4c 表明,MC 组小鼠两者的测定结果高于NC 组,并达到极显著水平(P<0.01)。与MC 组相比,药物和多糖干预组测定结果均极显著降低(P<0.01),而组间未表现显著差异(P>0.05),4 组中BPS 测定结果最优,之后依次为MPS、LPS 和PC。可以推测,抑制糖异生途径关键基因表达也是实验所选多糖提取物作用途径。
TXNIP 基因作为细胞炎症因子,是糖尿病发病原理中涉及的一种重要基因,有研究表明其在肝脏组织中的表达量上升会推动胰岛β 细胞的凋亡过程[27]。图4d 表明,MC 组小鼠的测定指标高于NC 组,并达到极显著水平(P<0.01)。药物和多糖干预组与MC 组对比,指标极显著下降(P<0.01)。整体可看出,药物效果明显优于多糖提取物,多糖干预组中BPS 指标测定结果最优,表明所选红茶多糖提取物在减少炎症因子表达,保护胰岛β 细胞这一途径相对效果更好。
2.5 植物多糖提取物的安全性评价
血液中ALT 和AST 水平是衡量肝脏受损的重要指标。由表5可知,造模会对小鼠造成一定程度的肝损伤,然而未达到显著差异水平(P>0.05)。PC 组小鼠ALT 水平显著高于NC 组(P<0.05),AST 水平极显著高于NC 组(P<0.01),表明二甲双胍药物会对小鼠肝脏造成明显损伤。多糖干预组ALT 和AST 水平均高于NC 组,而均未达到显著水平(P>0.05),表明所选植物多糖提取物未表现出显著肝毒性,在安全性方面优于药物二甲双胍。

表5 小鼠安全性相关指标水平Table 5 Mice safety related index level
3 结论
本试验采用的3 种植物多糖提取物在各项指标测定中均表现出减轻糖尿病典型症状的效果,其中,直观指标血糖下降率整体呈红茶多糖>桑叶多糖>枸杞多糖的规律。其中红茶多糖提取物在下调FBG,降低HOMA-IR 水平和提高GK 活性等方面效果更优;桑叶多糖提取物在缓解糖尿病造成的小鼠体重减轻,增加肝糖原含量和提高PK活性等方面效果更优。
此外,三者均能够降低G6Pc 和PEPCK 两种基因的表达,通过减少葡萄糖的生成达到血糖下降的效果;降低Foxo1 基因表达,保护胰岛β 细胞,达到减轻糖尿病症状,降低血糖水平的效果,在该指标中红茶多糖提取物最具优势;抑制TXNIP 基因表达,减轻炎症因子导致的胰岛β 细胞凋亡,其中红茶多糖提取物最具优势。整体可推测,试验所选多糖提取物产生降血糖效果的途径可能包括调控糖代谢和保护胰岛β 细胞。
植物多糖的基础结构可能受到包括原料来源、提取方法等方面的影响,导致生物活性差异。分子质量、单糖组成、糖链结构等均可能是多糖生物活性的影响因素[2]。本试验选取的植物多糖提取物分子质量差异较大,其中红茶多糖的分子质量最小,推测这使其更易被机体吸收,从而提高降血糖活性。试验所选植物多糖提取物在单糖组成方面存在差异,其中阿拉伯糖和木糖的摩尔质量占比与降血糖活性呈正相关,推测阿拉伯糖含量的增加会提高功能因子阿拉伯半乳聚糖的含量,木糖含量的增加能够使机体肠道菌群得到更好的调节[28],有助于提高多糖的吸收程度,进而提高多糖的降血糖活性。在本试验所设剂量条件下,植物多糖提取物均未表现出明显的肝脏毒性,安全性明显优于二甲双胍。
本文所选植物多糖提取物中,红茶多糖的降血糖效果最优,表明其具有开发利用的潜力。然而,多糖发挥降血糖效果的影响因素较多,作用途径繁杂,且不仅涉及一处靶点[27],结构、剂量、吸收方式、纯度、作用时间等因素的影响有待进一步研究。

