牛α-乳白蛋白-油酸复合物对肿瘤细胞能量代谢的影响
杨志轩,方 冰,任发政,冷小京
(中国农业大学营养与健康系 教育部-北京市共建功能乳品重点实验室 北京100083)
癌症是世界范围内主要的公共卫生问题[1-2],全球91 个国家的首要死因之一[3]。近年来,虽然有关癌症的预防、治疗研究进展迅猛,但其发病率亦居高不下,据报道,2006—2016年,全球癌症的发病率增加了28%[4],我国每年有1 万多人被诊断为新发癌症[5]。开发有效的、毒副作用小的抗肿瘤药物仍是国内外研究的热点[6-7],针对肿瘤细胞的分子靶向药物得到广泛关注[8]。
靶向药物是指一类能够与致癌因子特异性结合,通过一系列的生化反应使肿瘤细胞特异性凋亡或坏死,而不伤害肿瘤周围正常组织细胞的药物[9]。目前的分子靶向药物的设计靶点主要包括:表皮生长因子受体家族、血管生成相关、细胞膜特异性抗原等[10]。然而,在临床上,这类药物进入体内后,很可能造成治疗靶点发生基因突变而产生耐药性,还会激活肿瘤分子的其它信号通路,从而使药物失效[10],因此在临床上通常采用多种靶点药物联合治疗的手段[11]。由不同药物的相互作用而产生的副作用还待进一步研究[12]。有研究表明,肿瘤细胞具有能量代谢旺盛的特点,靶向抗肿瘤药物也常以此为靶点进行药物设计,从而从根本上抑制肿瘤细胞的“生命源泉”[13],并且不会产生耐药性,因此肿瘤细胞的能量代谢,成为近年来的分子靶向药物研发的热点[14-15]。
细胞可以利用葡萄糖、脂肪酸、氨基酸等底物进行氧化供能产生ATP[16-17],目前针对能量代谢这一靶点开发出的药物,基本上都是通过切断这些能量底物的供给,起到抑制肿瘤细胞的能量代谢,如2-脱氧葡萄糖(2-Deoxy-D-glucose,2-DG)能够阻止葡萄糖转换为6-磷酸葡萄糖[14],紫草素(Shikonin)或者奥利司他(Orlistat)能够阻止磷酸烯醇式丙酮酸转化为丙酮酸[14]。然而,这些药物仅能够切断某一条功能通路,在临床应用时,往往不能够真正实现细胞内ATP 总量的降低。需开发一种能够直接降低ATP 含量的抗肿瘤药物,才能够从根本上切断肿瘤细胞的能量供给。
人乳中发现的乳白蛋白-油酸抗肿瘤复合物(α-LA-OA),在细胞和动物水平均证明其有良好的抗肿瘤效果。近年来研究发现,α-LA-OA 能够影响肿瘤细胞能量代谢的相关蛋白和基因,但其能否对肿瘤细胞的能量代谢产生影响仍缺乏直接证据。α-LA-OA 可选择性杀死肿瘤细胞而不影响健康分化细胞的活性,不仅在人胶质母细胞瘤[18]和膀胱癌的小鼠模型[19]中得到验证,还在人皮肤乳头状瘤[20]和膀胱癌患者[21]身上得到证实。α-LAOA 的抗肿瘤机制研究早期多集中于其激活凋亡[22]、自噬[23]等程序性死亡通路上。近年来研究发现,其抗肿瘤机制可能是通过干扰肿瘤细胞能量代谢,最终引发细胞死亡。Storm 等[24]发现,增强糖酵解和氧化磷酸化水平的基因——c-Myc,能够促进α-LA-OA 对肿瘤细胞的致死作用,并且通过抑制己糖激酶和丙酮酸激酶同功酶M2,将糖酵解转移至磷酸戊糖途径。Fang 等[25]利用蛋白质组学技术发现,α-LA-OA 能够显著影响肿瘤细胞中参与能量代谢的相关蛋白的表达。然而,现有研究并未直接评估α-LA-OA 处理肿瘤细胞后,肿瘤细胞糖酵解、线粒体有氧呼吸这2 个能量代谢主要途径的变化。鉴于此,本文利用能量代谢仪研究α-LA-OA 处理肝癌细胞对肝癌细胞糖酵解及线粒体有氧呼吸过程的影响,为探明α-LA-OA 的抗肿瘤机制以及肿瘤靶向药物的开发,提供基础数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 主要细胞及培养条件 人肝癌细胞(HepG2),中国科学院细胞库。HepG2 培养于含10%胎牛血清的DMEM 培养基中,于37 ℃、5%CO2条件下培养。待细胞长至单层时,用含0.25%EDTA 的胰酶37 ℃消化处理2 min,按照1∶2 的体积比进行传代培养。
1.1.2 主要试剂 牛α-乳白蛋白(α-LA,纯度≥85%)、油酸(Oleic acid,OA,C18∶1∶9,顺式结构,纯度≥99.0%),Sigma-Aldrich(上海)贸易有限公司;葡萄糖(Glucose,1.0 mol/L)、L-谷氨酰胺(L-glutamine,200 mmol/L)、丙酮酸(Pyruvate,100 mmol/L),安捷伦科技(中国)有限公司;胎牛血清,美国Gibco 公司;其它化学试剂均为分析纯级。
1.2 仪器及设备
3111 二氧化碳培养箱,美国Thermo 公司;DK-98-II2KW 洁净工作台,天津泰斯特仪器公司;ZDX35BI 自动高压蒸汽灭菌器,上海申安医疗器械厂;Sigma 3K30 低温高速离心机,德国Satorious 公司;KS260 电热恒温水浴摇床,德国IKA公司;Infinite M200 Pro 全波长酶标仪,瑞士TECAN 公司;XFe24 Seahorse 细胞能量代谢分析仪,安捷伦科技贸易(上海)有限公司。
1.3 α-LA-OA 制剂的配制
根据Fang 等[26]改进的方法制备,将α-LA 溶于磷酸盐缓冲液中,加入OA 后,于45 ℃加热使二者结合。同时将不添加OA 的α-LA 溶液作为对照;将不含α-LA 的溶液作为对照缓冲液。
1.4 细胞培养和细胞活力测定
将生长在对数期的HepG2 细胞以1x104个细胞/孔的密度接种在96 孔板中,生长24 h。分3组,分别加入对照缓冲液、α-LA 和α-LA-OA,使培养基终浓度分别为10,20,60,80 μmol/L,每个处理设置4 个副孔。在37 ℃培养箱中孵育24 h后,每孔加入10 μL 细胞计数试剂盒-8(Cell counting kit-8,CCK-8) 溶液,37 ℃孵育1 h 后在波长450 nm 下读取每个孔的OD 值。细胞活力按式(1)计算。

1.5 糖酵解能力测定
细胞的操作如图1所示,将生长在对数期的HepG2 细胞以2×104个细胞/孔的密度接种在Seahorse XF24 专用细胞板中,其中设置4 个空白校正孔,将探针板用水化液在37 ℃活化12~72 h。专用细胞板在37 ℃,5%CO2下培养24 h 后,对细胞做3 种处理:分别加入对照缓冲液、α-LA、α-LA-OA,使终浓度均为0.4 μmol/L,每组设置6~7个副孔。24 h 后用只含有4 mmol/L L-谷氨酰胺的XF24 海马培养基替换原培养基,在无CO2、37 ℃条件下饥饿1 h,同时在XF24 探针板中的A,B,C孔中依次添加56 μL 葡萄糖溶液(10 mmol/L),62 μL 的寡霉素溶液(Olipomycin,1 μmol/L)和69 μL 2-脱氧葡萄糖溶液(50 mmol/L)。在Seahorse 能量代谢仪上测量HepG2 细胞中的胞外酸化率(ECAR),用以表征细胞的糖酵解能力。测定结束后,对每孔细胞进行消化、计数,用于均一化。

图1 细胞能量代谢仪的操作流程示意图Fig.1 Schematic diagram of the operation flow of the cell energy metabolism instrument
1.6 线粒体耗氧率(OCR)的测定
在能量代谢仪上测量HepG2 细胞中的线粒体耗氧率,用含有25 mmol/L 葡萄糖、4 mmol/L L-谷氨酰胺和1 mmol/L 丙酮酸的XF24 海马培养基替换原培养基,在XF24 探针板的A,B,C 孔中依次添加56 μL 寡霉素(1 μmol/L),62 μL 的三氟甲氧基苯腙羰基氰化物(1 μmol/L),69 μL 鱼藤酮(0.5 μmol/L)及抗霉素A(0.5 μmol/L)混合溶液。其它操作步骤同1.5 节。
1.7 统计分析
数值表示为至少3 次独立试验的平均值±标准差。数据用SPSS 统计软件(版本18.0)进行分析,使用单因素方差分析(ANOVA),然后进行Duncan’s 检验,其中P<0.05 视为有显著性差异。
2 结果与分析
2.1 α-LA-OA 的抗肿瘤活性
不同浓度的α-LA-OA 和α-LA 处理HepG2细胞24 h 后,细胞活力如图2所示。从图中可以看出,α-LA-OA 能够剂量依赖性的杀死肿瘤细胞,其剂量-效应关系曲线为y=-0.0111x+1.0924,R2=0.9776。而经过同样处理的α-LA 在所有测试剂量下,对肿瘤细胞的活性并无显著影响(P<0.05)。
2.2 α-LA-OA 对糖酵解的影响
用40 μmol/L 的α-LA-OA、α-LA 和对照组处理HepG2 细胞24 h 后,细胞的胞外酸化率如图3所示。糖酵解的终产物为乳酸及二氧化碳(CO2),二者含量可以通过测定细胞中的酸化水平来评估,因此,糖酵解过程的变化可以通过胞外酸化率的变化反映。不同药物处理后的细胞,经过1 h 的饥饿处理,胞外酸化率会降低至基础水平,由图3可以看出,α-LA-OA 处理细胞24 h 后,细胞内的基础糖酵解水平已低于其它2 个处理组。随着10 mmol/L 葡萄糖溶液的加入(图3Ⅰ),葡萄糖迅速被分解代谢为丙酮酸,产生乳酸或者CO2,导致细胞的胞外酸化率(ECAR)显著增加。待其稳定后,通过加入抑制剂寡霉素抑制细胞线粒体有氧呼吸的供能途径(图3Ⅱ),使细胞的氧化磷酸化被抑制,所有的葡萄糖及能量底物均进行糖酵解供能,释放出乳酸和CO2,因此胞外酸化率会进一步升高。最后通过加入糖酵解第1 步的抑制剂2-脱氧葡萄糖(图3Ⅲ),完全抑制细胞的糖酵解过程,使胞外酸化率降低到初始水平。

图2 CCK-8 法检测α-LA-OA 处理后HepG2细胞的活力Fig.2 CCK-8 assay for the viability of HepG2 cells after α-LA-OA treatment

图3 α-LA-OA 处理肿瘤细胞后的胞外酸化率变化曲线图Fig.3 Curve of extracellular acidification rate of tumor cells treated with α-LA-OA
根据图3及试剂盒方法可以计算出细胞的糖酵解能力,结果如图4所示。可以看出,α-LA-OA显著降低了细胞的糖酵解能力(P<0.05),而经过同样处理的α-LA 和对照组对细胞的糖酵解能力并无显著影响(P>0.05)。
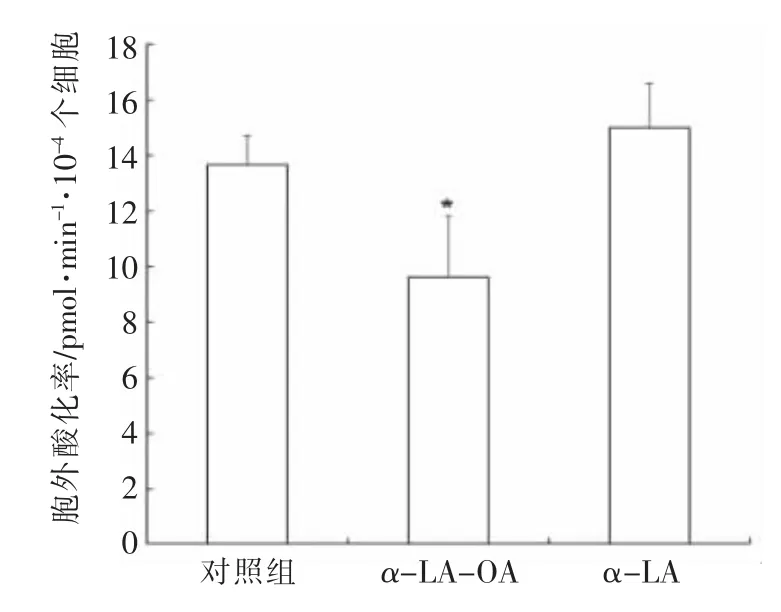
图4 α-LA-OA 处理肿瘤细胞后的糖酵解及糖酵解能力Fig.4 Glycolytic and glycolysis ability of tumor cells treated with α-LA-OA
2.3 α-LA-OA 对线粒体有氧呼吸的影响
用40 μmol/L 的α-LA-OA、α-LA 和对照组处理HepG2 细胞24 h 后,细胞的耗氧量如图5所示。有氧呼吸是指细胞在氧气参与下的一系列生化反应过程,因此有氧呼吸过程的变化可以通过耗氧率的变化反映。不同药物处理后的细胞,经过1 h 的饥饿,细胞耗氧量降低至其基础水平,由图5可以看出,α-LA-OA 及α-LA 处理细胞24 h后,细胞内的基础糖酵解水平均低于对照组。随着ATP 合酶抑制剂,寡霉素(图5Ⅰ)的加入,使细胞用于ATP 合成的耗氧量减少,即此时减少的耗氧是机体用于ATP 合成的耗氧量;待其稳定后,通过加入线粒体氧化磷酸化解偶联剂——三氟甲氧基苯腙羰基氰化物(图5Ⅱ),破坏线粒体内膜,使大量质子回流,使氧被最大程度的消耗,因此细胞的耗氧率会进一步升高[27];最后加入呼吸链抑制剂——鱼藤酮-抗霉素A 复合溶液(图5Ⅲ),使线粒体呼吸作用停止,并使其耗氧率降低至由非线粒体呼吸作用产生的水平。
根据图5及试剂盒方法可以计算出基础呼吸值、ATP 产生量,结果如图6所示。可以看出,虽然图5中α-LA-OA 及α-LA 处理组的细胞耗氧率曲线均低于对照组,但经过计算发现,仅α-LAOA 处理组能够显著降低细胞的基础呼吸(P<0.05),而经过同样处理的α-LA 和对照组对细胞的基础呼吸并无显著影响(P>0.05);α-LA-OA 显著降低了线粒体ATP 产生量(P<0.05),而经过同样处理的α-LA 和对照组对细胞的ATP 产生量并无显著影响(P>0.05)。

图5 α-LA-OA 处理肿瘤细胞后的耗氧率变化曲线图Fig.5 Curve of oxygen consumption rate of tumor cells treated with α-LA-OA

图6 α-LA-OA 处理肿瘤细胞后的基础耗氧及ATP 产生量Fig.6 Basic oxygen consumption and ATP production of tumor cells treated with α-LA-OA
3 结论
综上所述,本研究证明了α-LA-OA 能够显著降低人肝癌细胞的糖酵解能力和线粒体有氧呼吸能力,并降低ATP 的产生量和基础呼吸(P<0.05),而经过相同处理的蛋白本身(α-LA)和溶剂对照组均无上述作用。因此,α-LA-OA 能够干预肿瘤细胞的能量代谢过程,通过降低肿瘤细胞基础代谢能力阻断其ATP 供应,为今后抗肿瘤药物的开发提供了新的机遇。

