PLIN2通过调控SREBP2促进RAW264.7巨噬细胞脂质蓄积*
蒋思怦, 张 瑞, 李晓歌, 张 荣, 郭东铭, 袁中华
(南华大学心血管疾病研究所,动脉硬化学湖南省重点实验室,湖南省动脉硬化性疾病国际科技创新合作基地,湖南衡阳421001)
动脉粥样硬化(atherosclerosis,AS)的发病机制复杂,至今未被完全阐明,其中脂质代谢紊乱和炎症反应被广泛认为是诱导AS 发生发展的原因。低密度脂蛋白(low-density lipoprotein,LDL)经氧化修饰[氧化LDL(oxidized LDL,ox-LDL)]后被巨噬细胞所吞噬,转化为泡沫细胞,大量堆积在血管内皮下,促进动脉粥样斑块的形成与发展[1]。脂滴包被蛋白2(perilipin 2,PLIN2)是围绕在细胞内脂滴表面的主要脂滴相关蛋白之一,高表达在泡沫细胞中[2-3],对脂滴的合成和降解起着重要的作用,可作为脂质蓄积的标志。大量研究表明,PLIN2 具有一定的促进AS作用[4],但其具体机制尚未阐明。固醇调节元件结合蛋 白(sterol regulatory element binding proteins,SREBPs)是一类可激活涉及胆固醇、甘油三酯等生物合成及脂质代谢所需酶转录的转录因子超家族,其中SREBP2广泛存在于各种组织,主要参与胆固醇代谢酶转录的调控[5]。内质网是真核细胞动态的膜细胞器,一旦受到有害因素(如饥饿、病毒感染等)侵袭,大量的错误折叠及未折叠蛋白在内质网腔内募集,将诱发内质网应激(endoplasmic reticulum stress,ERS)。新近研究表明,PLIN2敲除小鼠的ERS 受到显著抑制,同时肝脏中SREBPs 活性降低,血清脂质蓄积水平减少,SREBP2 表达降低[6],提示 PLIN2 与ERS 和SREBP2 活性具有密切联系。我们前期研究显示,PLIN2 可以促进巨噬细胞中脂滴聚积[7]。因此,本研究旨在探讨PLIN2 是否通过影响ERS 调控SREBP2的表达,从而影响巨噬细胞内脂质蓄积。
材 料 和 方 法
1 主要材料
RAW264.7小鼠单核/巨噬细胞白血病细胞来自上海生科院细胞生物学研究所。RPMI1640 培养液(苏州巨能世纪公司);新生胎牛血清(杭州四季青公司);ox-LDL(广州奕源公司);游离胆固醇(free cholesterol,FC)检测试剂盒(Applygen);内质网提取试剂盒(上海贝博生物科技有限公司);无内毒素质粒提取试剂盒(Omega Bio-tek);SYBR Green 和Trizol(TIANGEN);4-苯基丁酸(4-phenylbutyric acid,4-PBA;北京索莱宝公司);Lipo6000TM转染试剂(上海碧云天公司);油红O(北京鼎国昌盛公司);鼠抗3-羟基-3-甲基戊二酰辅酶A 还原酶(3-hydroxy-3-methylglutaryl-coenzyme A reductase,HMGCR)Ⅰ抗(武汉爱博泰克生物技术有限公司);鼠抗β-actin Ⅰ抗,兔抗PLIN2、SREBP2 和葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)Ⅰ抗,山羊抗鼠/抗兔IgG Ⅱ抗(Proteintech);其它试剂均为进口或国产分析纯。所用引物由生工生物工程(上海)股份有限公司根据设计合成,见表1。

表1 RT-qPCR引物序列Table 1.Sequences of the primers for RT-qPCR
2 主要方法
2.1 细胞培养及实验分组 将RAW264.7 细胞置于5% CO2、37℃的培养箱中培养,每天换液,当细胞贴壁率达到75%时传代。实验分为4 步。实验一:细胞经 ox-LDL 处理不同时间(0、6、12、24 和48 h),构建泡沫细胞模型[8]。实验二:(1)PLIN2 过表达实验,分为 PLIN2-Con 组(将 pQCXIP 转染入细胞)、PLIN2-Con+ox-LDL 组、HA-PLIN2 组(将 pQCXIP-HAAdipophilin 转染入细胞)和 HA-PLIN2+ox-LDL 组;(2)PLIN2沉默实验,分为siRNA-Con 组(将pSuperscramble siRNA 转染入细胞)、siRNA-PLIN2 组(将pSuper-Adipophilin siRNA 转染入细胞)、siRNAPLIN2+ox-LDL 组和 siRNA-Con+ox-LDL 组。实验三:分为HA-PLIN2 组及siRNA-PLIN2 组。实验四:ERS抑制剂4-PBA 处理实验,分为control 组(空白对照组)、ox-LDL组、4-PBA组和ox-LDL+4-PBA组。
2.2 提取与鉴定质粒 将含pQCXIP、pQCXIP-HAPLIN2、pSuper-scramble siRNA 和 pSuper-retro-PLIN2 siRNA 质粒的菌液解冻混匀,接种在含氨苄西林的琼脂培养基上,在细菌培养箱中培养12~16 h后挑出阳性单菌落置于含氨苄西林的LC 培养液中,37℃摇床震荡18~24 h(220 r/min)。取一部分菌液提取质粒并通过AGE 鉴定,余下已鉴定的菌液再划板挑取阳性单菌落接种于200 mL的LC培养液中,通过质粒提取试剂盒提取质粒,使用紫外分光光度计测量质粒的浓度。
2.3 转染pQCXIP、pQCXIP-HA-PLIN2、pSuper-scramble siRNA 和 pSuper-retro-PLIN2 siRNA 入 RAW264.7细胞 转染前1 d 将RAW264.7 细胞接种于6 孔板中,后放入细胞培养箱中继续培养。用250 μL 的DMEM 培养液稀释上面提取的pQCXIP、pQCXIPHA-PLIN2、pSuper-scramble siRNA 和 pSuper-retro-PLIN2 siRNA 质粒(各 4 μg),并用 250 μL DMEM 培养液稀释10 μL Lipo6000TM转染试剂,均在室温下静置5 min 混匀,后又置于室温中20 min,将混匀液均匀加入6 孔板中。再于细胞培养箱中培养4~6 h 后换为含10%胎牛血清的PRMI-1640 培养液继续培养,1~2 d后可通过Western blot实验检测转染效果。
2.4 Western blot 实验 将收集好的未处理的RAW264.7 细胞或经转染后的RAW264.7 细胞中加入细胞裂解混合液冰上裂解,提取总蛋白。使用BCA 试剂盒对蛋白定量。制备10%分离胶和5%浓缩胶,蛋白经SDS-PAGE 分离后转移至PDVF 膜上;转膜结束后经脱脂牛奶封闭,后分别加入相应Ⅰ抗,摇床震荡孵育6~8 h(4℃过夜);接着加入对应的Ⅱ抗,摇床摇动孵育2 h(室温),开始显影。
2.5 油红O 染色 配制油红O 工作液(油红O 储存液∶双蒸水=6∶4),使用4%多聚甲醛(30 min)固定细胞后使用 PBS 洗涤 3 次,每次 10 min;将油红 O 染液加入24 孔板中,每孔至少1 mL,1 h 后吸出染液,PBS再洗涤3次,每次10 min;后用苏木素染核5 s,最后用PBS洗涤3次。在显微镜下拍片并保存。
2.6 细胞免疫荧光 使用4%多聚甲醛(30 min)固定细胞,PBS清洗3次;使用0.1%Trition X-100(每孔300~500 μL)处理24 孔板中的细胞15~30 min,PBS清洗 3 次,每次 5 min;使用 300~500 μL 的 10% 胎牛血清封闭1 h 后孵育对应的Ⅰ抗(4℃过夜),PBS 清洗3 次,每次5 min;接着Ⅱ抗孵育(常温),PBS 清洗3 次,每次 5 min;使用 1 mg/L 的 DAPI 染核 30 min,PBS 清洗3 次,每次5 min;最后使用抗荧光淬灭剂进行封片,在荧光显微镜下拍摄并保存。
2.7 细胞内及内质网膜组分中FC 的测定 (1)提取细胞内内质网:细胞悬浮后1 000×g离心10 min,丢弃上清液;加入500 μL 试剂A 后放于冰上10 min,将匀浆在 1 000×g和 11 000×g(4℃)下分别离心5 min 和10 min,收集上清液;后于30 000×g(4℃)条件下离心 45 min,收集沉淀;加入 400 μL 的试剂 B 在30 000×g(4℃)下再次离心45 min,收集的沉淀即为内质网样品。(2)检测FC:在培养细胞的培养瓶和制备的内质网膜组分中分别加入150 和100 μL 的裂解混合液,2 000×g离心5 min 后收集30 μL 上清液,余下裂解液使用BCA 法进行蛋白定量;将5 nmol/L 胆固醇标准品以无水乙醇稀释后设置浓度梯度;96 孔板中每孔加入190 μL R1+R2 工作液(R1∶R2=4∶1),后每孔分别加入10 μL标准品、空白对照溶液或待测样品(37℃,20 min);使用酶标仪测量每孔吸光度(A),绘出标准曲线,根据标准曲线测出胆固醇浓度,再用蛋白浓度进行校正。
2.8 RT-qPCR 实验 收集各组细胞,按照Trizol 试剂盒说明书提取总RNA,去除其中混杂的DNA 及DNase,逆转录合成 cDNA,合成第 1 链 cDNA 采用20 μL 体系,反应程序为:42℃ 15 min,95℃ 3 min。50 μL 两步法 PCR 程序为:95℃ 15 min;95℃ 10 s,56℃ 20 s,72℃ 25 s,40 个循环。以 β-actin 为内参照,用2-ΔΔCt法计算SREBP2 mRNA的相对表达量。
3 统计学处理
采用GraphPad Prism 6.0 软件进行制图和统计分析。结果均以均数±标准差(mean±SD)表示。两组间比较采用t检验,多组间比较采用单因素方差分析及LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 ox-LDL 处理不同时间对SREBP2和PLIN2蛋白水平的影响
Western blot 实验结果显示,24 h 内,ox-LDL 呈时间依赖性增加PLIN2 和SREBP2 表达水平(P<0.05),但 24 h 后 SREBP2 蛋白水平开始降低,见图1;同时24 h后出现细胞死亡、伪足增多现象,见图2。因此,本研究选择ox-LDL孵育细胞时间为24 h。
2 PLIN2对SREBP2和HMGCR 表达、脂质蓄积及FC含量的影响
Western blot 及 RT-qPCR 实验结果显示,与PLIN2-Con 组相比,HA-PLIN2 组 PLIN2 和 SREBP2的mRNA 和蛋白水平及HMGCR 的蛋白水平显著上升(P<0.05);与 PLIN2-Con+ox-LDL 组相比,HAPLIN2+ox-LDL 组 PLIN2 和 SREBP2 的 mRNA 和蛋白水平及HMGCR 的蛋白水平显著增加(P<0.05),图3A 及图4A、B。与siRNA-Con 组相比,siRNA-PLIN2组PLIN2和SREBP2 的mRNA 和蛋白水平及HMGCR的蛋白水平显著降低(P<0.05);与siRNA-Con+ox-LDL 组相比,敲减PLIN2可显著逆转 ox-LDL 诱导的SREBP2 mRNA和蛋白水平及HMGCR蛋白水平的升高(P<0.05),见图3B及图4C、D。

Figure 1.Western blot was used to determine the protein levels of PLIN2 and SREBP2 in RAW264.7 macrophages exposed to ox-LDL for different time(0,6,12,24 and 48 h).Mean±SD. n=3.*P<0.05 vs 0 h.图1 ox-LDL处理不同时间对PLIN2和SREBP2蛋白表达的影响

Figure 2.Micrograph of RAW264.7 macrophages cultured with ox-LDL for different time(A:0 h;B:24 h;C:48 h).The death of the cells increased after ox-LDL treatment for 24 h.The scale bar=100 μm.图2 ox-LDL处理不同时间后细胞的形态
油红O 染色结果显示,HA-PLIN2+ox-LDL 组较ox-LDL 组脂质蓄积增加,而 siRNA-PLIN2+ox-LDL 组较ox-LDL组脂质蓄积减少,见图5。
FC检测结果显示,与siRNA-PLIN2+ox-LDL组相比,HA-PLIN2+ox-LDL组细胞内及内质网上的FC含量均显著增加(P<0.05),见图6。
3 PLIN2 对 GRP78 蛋白水平及 SREBP2 核移位 的影响
Western blot结果显示,HA-PLIN2组细胞内GRP78表达较siRNA-PLIN2组显著增加(P<0.05),见图7。
免疫荧光结果显示,与control 组相比,siRNAPLIN2组绿色荧光主要分布于细胞质,在核内很少表达,而HA-PLIN2组细胞核内出现强荧光,见图8。
4 ERS抑制剂4-PBA对GRP78、SREBP2和HMGCR表达的影响
Western blot 实验结果显示,4-PBA 组 GRP78、SREBP2 和HMGCR 蛋白水平较control 组显著降低(P<0.05);与 ox-LDL 组 相比 ,4-PBA+ox-LDL 组GRP78、SREBP2 和HMGCR 蛋白水平显著降低(P<0.05),见图9。
RT-qPCR 实验结果显示,4-PBA 组 SREBP2 的mRNA 水平较control 组降低(P<0.05);与 ox-LDL 组相比,4-PBA+ox-LDL 组SREBP2 mRNA 水平显著降低(P<0.05),见图10。
讨 论
随着人民生活的日益提高,AS源性心血管疾病的发病率逐年增加,严重威胁着人们身心健康。但AS发病机制复杂,其中脂质代谢异常是导致AS发生发展的主要因素之一[9]。相关研究表明,PLIN2能够增加巨噬细胞内甘油三酯和胆固醇酯含量,抑制胆固醇流出,促进胆固醇蓄积及泡沫细胞形成[7,10]。同时也有报道证实,在AS 斑块区域,PLIN2 表达显著增加[11],提示PLIN2 可能通过促进泡沫细胞形成进而影响AS 发生发展。但是PLIN2 调节脂质蓄积的具体机制仍不明确。本研究表明,PLIN2 能够通过ERS 调控 SREBP2 表达和活性,促进 HMGCR 表达和胆固醇合成,进而诱导巨噬细胞脂质蓄积。
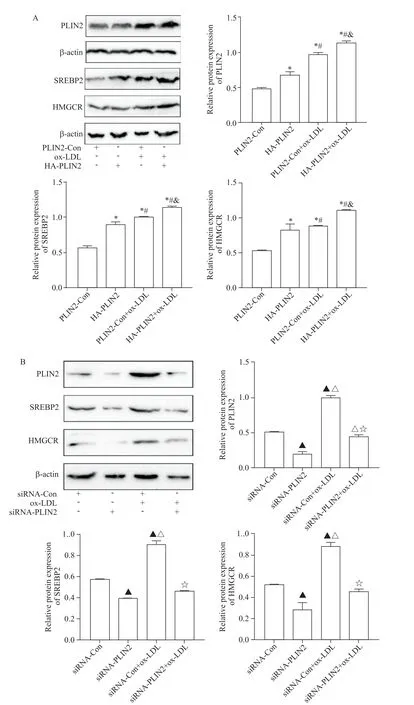
Figure 3.Effects of PLIN2 on the protein levels of SREBP2 and HMGCR.A:the RAW264.7 macrophages were transfected with pQCXIP or pQCXIP-HA-PLIN2 for 24 h and then treated with or without ox-LDL for 24 h;B:the RAW264.7 macrophages were transfected with pSuper-scramble siRNA or pSuper-retro-PLIN2 siRNA for 24 h and then treated with or without ox-LDL for 24 h.Mean±SD. n=3.*P<0.05 vs PLIN2-Con group;#P<0.05 vs HA-PLIN2 group;&P<0.05 vs ox-LDL group;▲P<0.05 vs siRNA-Con group;△P<0.05 vs siRNA-PLIN2 group;☆P<0.05 vs siRNA-Con+ox-LDL group.图3 PLIN2对SREBP2和HMGCR蛋白表达的影响
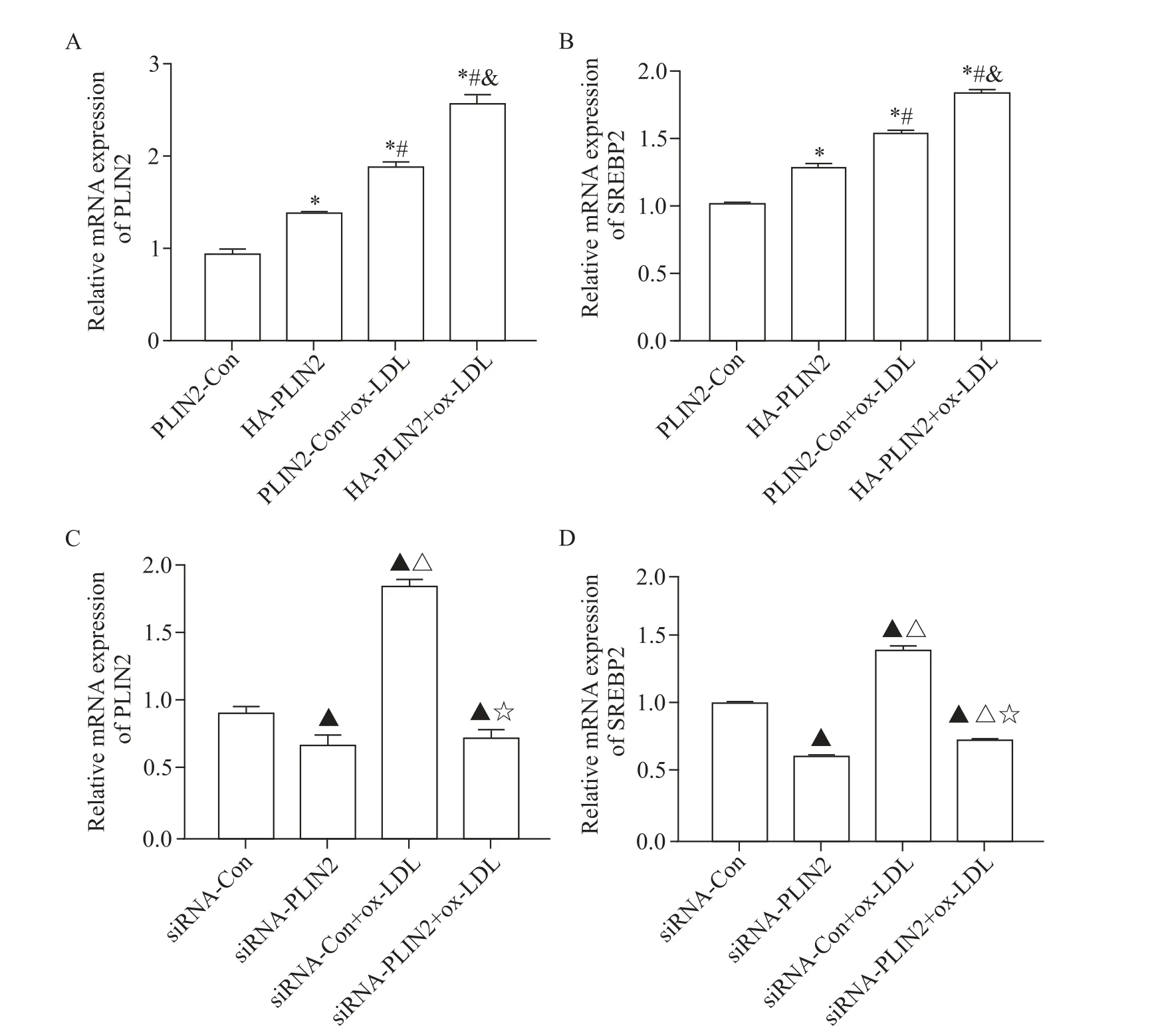
Figure 4.Effects of PLIN2 on the mRNA expression of SREBP2.A,B:the mRNA expression of PLIN2 and SREBP2 in RAW264.7 macrophages transfected with pQCXIP or pQCXIP-HA-PLIN2 for 24 h and then treated with or without ox-LDL for 24 h;C,D:the mRNA expression of PLIN2 and SREBP2 in RAW264.7 macrophages transfected with pSuper-scramble siRNA or pSuper-retro-PLIN2 siRNA for 24 h and then treated with or without ox-LDL for 24 h.Mean±SD. n=3.*P<0.05 vs PLIN2-Con group;#P<0.05 vs HA-PLIN2 group;&P<0.05 vs ox-LDL group;▲P<0.05 vs siRNA-Con group;△P<0.05 vs siRNAPLIN2 group;☆P<0.05 vs siRNA-Con+ox-LDL group.图4 PLIN2对SREBP2 mRNA表达的影响
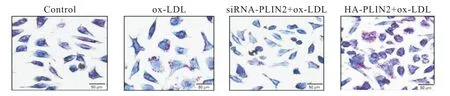
Figure 5.Lipid droplets in RAW264.7 macrophages detected by oil red O staining.The scale bar=50 μm.图5 油红O染色观察PLIN2对脂滴变化的影响
既往研究表明,细胞内胆固醇丰富时,SREBPs锚定于内质网;但细胞胆固醇水平较低时,SREBPs被site-1 及site-2 蛋白酶切割并释放,转移至细胞核与LDL 受体或HMGCR 合成酶的基因操纵子结合并促进其表达[5,12]。其中,SREBP2 位于内质网中作为膜结合蛋白,可通过蛋白酶水解后释放N 端结构域进入细胞核,与固醇反应元件结合,激活SREBP2 靶基因HMGCR的转录,进而促进细胞内胆固醇合成。Vergnes 等[13]发 现,在 小鼠 胚胎 中 敲除SREBP2,HMGCR 表达水平显著降低,胆固醇的生物合成减少。新近研究报道,在小鼠中敲除PLIN2能够降低SREBP2 表达,抑制其活性,减少脂质蓄积[6],提示PLIN2 与SREBP2 存在相互作用,但其具体机制尚不明确。本研究显示,在RAW246.7 细胞中过表达PLIN2,能够促进并激活 SREBP2,增加SREBP2 核移位,上调HMGCR 表达,提高细胞内及内质网上FC水平,导致细胞脂质蓄积;降低PLIN2 水平则出现相反的结果。这说明PLIN2 可通过激活SREBP2 增加HMGCR 的表达,促进细胞内胆固醇合成进而引起细胞脂质蓄积。

Figure 6.Effects of PLIN2 on intracellular free cholesterol content(A)and free cholesterol content in endoplasmic reticulum(B).Mean±SD. n=3.*P<0.05 vs siRNA-PLIN2+Ox-LDL group.图6 PLIN2对细胞内及内质网上游离胆固醇含量的影响
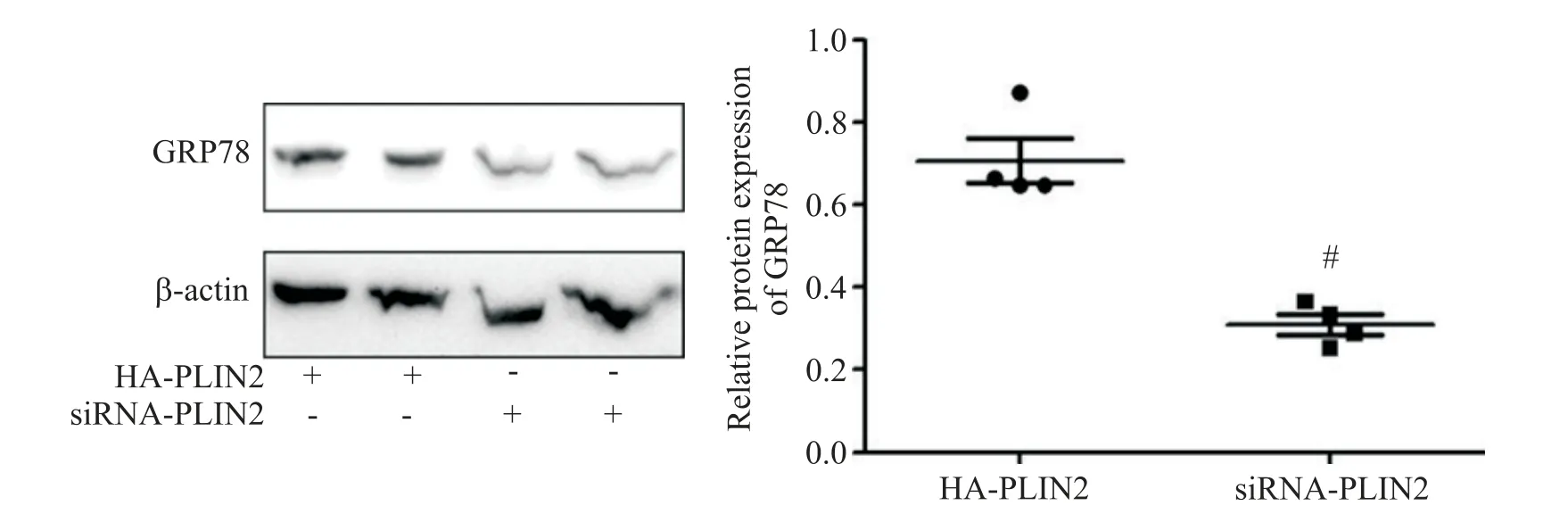
Figure 7.Effects of PLIN2 on the protein level of GRP78 detected by Western blot.Mean±SD. n=3.#P<0.05 vs HA-PLIN2 group.图7 PLIN2对GRP78蛋白水平的影响

Figure 8.Effects of PLIN2 on the nuclear translocation of SREBP2 detected by immunofluorescence staining.PLIN2 was visualized by FITC-conjugated Affinipure(green),and nuclei were stained with DAPI(blue).The scale bar=50 μm.图8 PLIN2对SREBP2核转位的影响
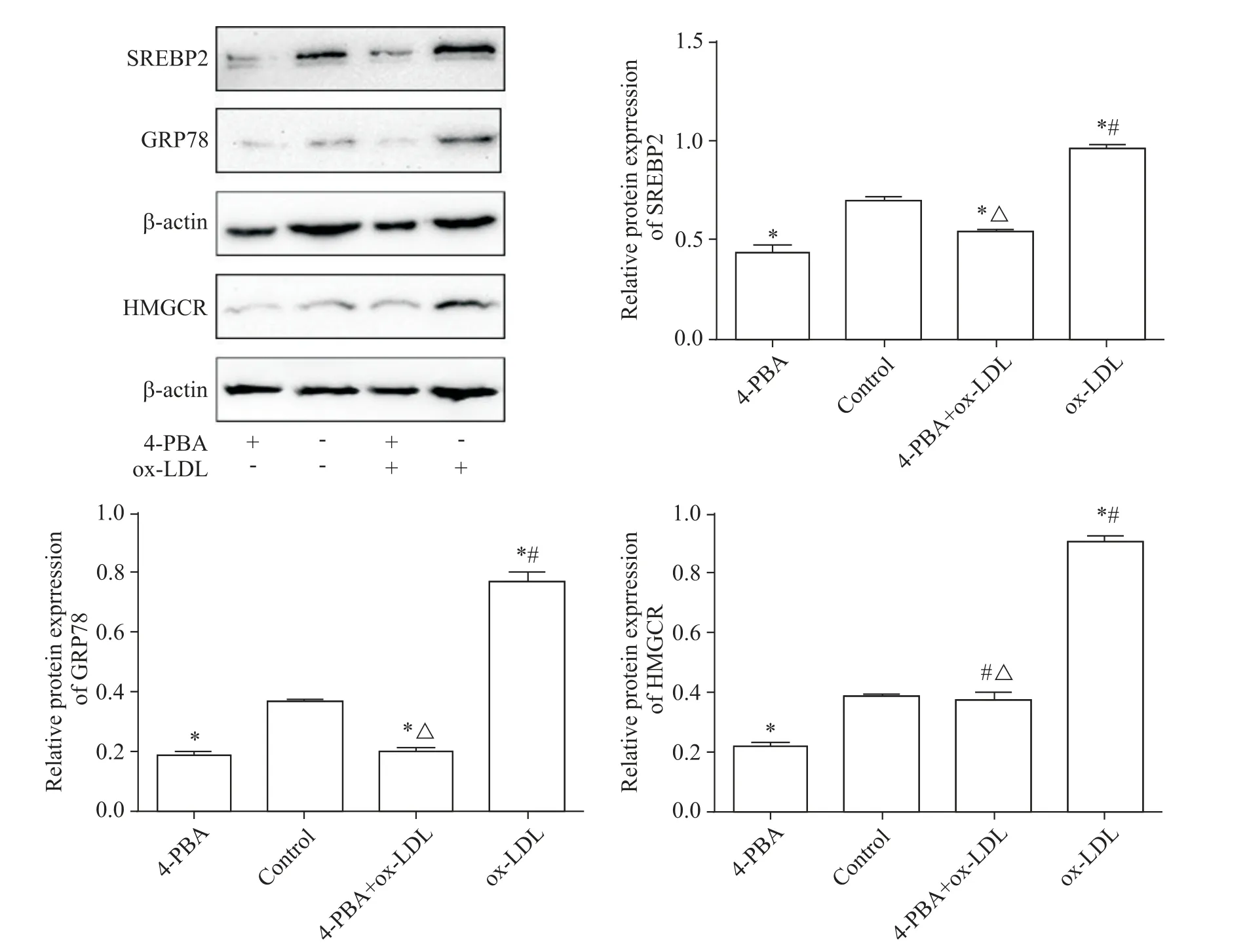
Figure 9.Effects of 4-PBA on the protein levels of GRP78,SREBP2 and HMGCR in each group detected by Western blot.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs 4-PBA group;△P<0.05 vs ox-LDL group.图9 4-PBA对GRP78、SREBP2和HMGCR蛋白水平的影响

Figure 10.Effects of 4-PBA on the mRNA expression of SREBP2 in each group detected by RT-qPCR.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs 4-PBA group;△P<0.05 vs ox-LDL group.图10 4-PBA处理后对SREBP2 mRNA表达的影响
内质网是调节胆固醇含量的重要细胞器[14],通过感知细胞内胆固醇含量而调节胞内胆固醇水平[15]。ERS 发生能够促进胆固醇负荷,增加脂质蓄积和泡沫细胞形成,说明ERS 与AS 发生发展有密切联系[16-17]。GRP78作为内质网伴侣蛋白,在调节ERS的动态平衡中发挥关键作用,是ERS的标志[18]。ERS发生时,ERS 相关蛋白 GRP78 与 SREBP 裂解激活蛋白(SREBP cleavage-activating protein,SCAP)-SREBP复合物分离,激活SREBP2,促进其发挥生物活性[19]。此外,Chen 等[20]观察到 PLIN2 在胰腺 β 细胞中可参与ERS 调节。由此我们猜想,PLIN2 可能通过ERS调控SREBP2 从而影响RAW264.7 巨噬细胞脂质蓄积。本研究表明,过表达PLIN2 能促进GRP78 表达,说明过表达PLIN2 能够引起ERS 的发生。ERS 特异性抑制剂 4-PBA 降低 SREBP2 及 HMGCR 表达,进一步表明PLIN2可通过ERS 影响SREBP2活性,从而调控RAW264.7细胞内脂质蓄积。
综上所述,PLIN2可促进RAW264.7细胞脂质蓄积,其机制是其诱导ERS的发生,激活SREBP2,从而促进脂质蓄积。但鉴于本工作是以RAW264.7 巨噬细胞为研究对象进行的体外细胞实验,与临床疾病的发生发展有一定的区别,因此在AS 发展中PLIN2 对SREBP2的具体作用机制仍有待进一步研究。

