苗期重金属胁迫下蓖麻生长、生理和重金属积累效应
吕冬梅 朱广龙 王 玥 施 雨 卢发光 任 桢 刘昱茜 顾立峰 卢海潼 Irshad Ahmad 焦秀荣 孟天瑶 周桂生,*
苗期重金属胁迫下蓖麻生长、生理和重金属积累效应
吕冬梅1,2,**朱广龙1,**,*王 玥1,**施 雨1卢发光1任 桢1刘昱茜1顾立峰1卢海潼1Irshad Ahmad1焦秀荣1孟天瑶1周桂生1,*
1扬州大学教育部农业与农产品安全国际合作联合实验室 / 江苏省粮食作物现代产业技术协同创新中心, 江苏扬州 225009;2加拿大麦吉尔大学植物科学系, 加拿大蒙特利尔 H9X3V9
农业面源和重金属污染日益加剧, 严重威胁农业生态环境与人类健康。探究作物对重金属的累积效应及生理机制对重金属污染的治理意义重大。本文以淄蓖5号为材料, 研究重金属处理下(Cu、Zn、Cd, 处理浓度分别为0、30、60、120 mg L-1)蓖麻幼苗对各重金属的积累效应及相关生理机制, 为重金属污染土壤的修复与防治奠定基础。重金属处理显著影响蓖麻植株的生长、生理及对重金属的积累。随着重金属浓度的增加, 株高先增后降, 在60 mg L-1时达最大值; 根长、鲜重、干重显著降低。叶片中SOD活性先降后增, 在10 DAS (播种后天数) 120 mg L-1Cu和Zn处理下活性最高, 分别增加了45.5%和31.8%; POD活性在10 DAS先降后增, 而在25 DAS和45 DAS显著增加, 且POD活性随生长进程的推进增加显著。可溶性蛋白含量仅在120 mg L-1Cu处理下显著增加, 分别增加了18.8%、66.7%和83.3%。MDA含量随着处理浓度的增加显著增加, 随生育进程的推进而显著降低, 且Cd处理下的MDA含量显著高于Cu和Zn处理。蓖麻植株对Cu、Zn、Cd的积累量随处理浓度的增加而递增, 在120 mg L-1浓度下积累量最大, 其中对Zn的积累量最高, Cd次之, 各器官对重金属的积累量表现为根>茎>叶。表明蓖麻对重金属具有一定的耐受性, 蓖麻植株主要通过提高抗氧化酶活性缓解重金属胁迫; 蓖麻对不同重金属的积累具有器官特异性; 种植蓖麻可作为修复Cu、Zn、Cd等重金属污染土壤的有效途径之一。
蓖麻; 重金属胁迫; 生长特性; 重金属积累; 生理机制
近些年, 因农业化肥的不当施用、化工废弃物与生活废水的排放等因素导致的全球农业面源和土壤重金属污染日益加剧[1]。地表水作为农业生产灌溉的主要水源, 富含植物所需的多种养分, 同时也是各种重金属的储存库, 是农田重金属污染的重要污染源与迁移载体[2]。土壤中的重金属对作物的出苗和立苗会造成一定程度的影响, 且随食物链的迁移, 其对生态环境和人类健康也会造成潜在或直接的危害[3-4]。因人口的激增, 我国所面临的能源短缺和环境污染等问题日益严重。发展生物质能源、修复土壤重金属污染是缓解我国能源短缺、改善生态环境和提高农业生产的重要途径[5]。
蓖麻(L.)属大戟科蓖麻属植物,分布广、适应性强, 主要在我国东北、西北、华北等地区种植。蓖麻种子含油量高达50%左右, 且蓖麻籽油理化性质稳定, 巴西、印度等国已将蓖麻籽作为工业原料生产生物柴油并商业化[6]。大量研究显示, 蓖麻对多种重金属具有一定的耐受性, 其耐受能力因重金属的类型和污染程度而异。Huang等[7]研究发现, 蓖麻对Cu积累能力较高, 其根系分泌的酒石酸、柠檬酸等有助于增强植株对Cu胁迫的耐受性。当土壤中Cd浓度低于40 mg kg-1时, 可促进蓖麻植株的生长; 当Cd浓度超过200 mg kg-1时, 蓖麻生长受到抑制但仍未致死, 表明蓖麻对高浓度Cd污染具有一定的耐受性[8]。重金属在植物体内的积累程度因植物和重金属的种类而异。就同一作物而言, 不同重金属在各器官的积累浓度也不同[9]。易心钰等[10]研究发现, 不同金属离子在蓖麻体内的积累浓度不同, 表现为Zn > Cu > Cd。陆晓怡等[11]的研究也表明, 蓖麻对Zn污染土壤的修复效果较好。
重金属是一种逆境胁迫因子, 重金属胁迫下诱导产生的活性氧(reactive oxygen species, ROS)会破坏细胞生长与分裂过程, 紊乱各种代谢活动, 进而影响植株生长甚至致死[12]。高等植物对重金属胁迫的第一防御系统由各种抗氧化剂(主要为抗氧化酶)构成, 以分解或中和产生的活性氧[13]。超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶 (peroxidase, POD)是植物体重要的抗氧化保护酶, 其活性的强弱反映了植物组织对超氧化物、过氧化物和有害离子的清除能力, 体现植物对逆境胁迫的抗性[14]。此外, 植物体内产生的可溶性蛋白等渗透调节物质也可缓解重金属胁迫。上述研究主要集中于蓖麻对不同重金属积效应方面, 关于蓖麻植株不同器官对各重金属积累效应及相关生理机制方面的研究罕见报道。本研究设置Cu、Zn、Cd 3种重金属处理, 研究不同重金属胁迫对蓖麻幼苗生长的影响, 探究蓖麻不同器官对重金属积累的差异及相关生理机制, 以期为重金属污染土壤中蓖麻的种植和土壤修复提供理论依据和参考。
1 材料与方法
1.1 试验设计
试验于2016年在扬州大学教育部农业与农产品安全国际合作联合实验室进行。试验材料为淄蓖5号, 种子由山东省淄博市农科院提供。试验选用内径15.0 cm、下径12.0 cm、高为7.5 cm盆底无孔的育苗专用塑料盆进行盆栽实验。采用单因素随机区组试验设计, 以重金属Cu、Zn、Cd为处理因子, 每个处理因子设置0 (对照)、30、60和120 mg L-14个浓度梯度, 每个处理3个重复, 每个重复种植5盆。播种基质为细沙, 经纯水洗净后高温消毒干燥, 每盆装细沙400 g, 与90 mL各浓度重金属溶液充分混匀后播种, 对照组加入超纯水与细沙混合。
播种前将蓖麻种子用75℃温水浸泡15 min, 每盆播种10粒, 然后覆盖细沙约2.0 cm厚。播完后, 将塑料盆置于培养箱中发芽出苗, 培养条件为: 温度20℃, 湿度为60%~70%, 光照时长16 h, 光照强度500 μmol m-2s-1。在蓖麻幼苗生长期间, 每隔7 d加入Hoagland[15]营养液50 mL, 以保证蓖麻幼苗生长所需的营养物质摄入。
1.2 参数测定及方法
1.2.1 株高、根长、鲜重和干重 播种后第10天和第25天, 每个处理每个重复取5株幼苗, 称量鲜重后分为根和茎叶两部分, 测定株高及根长。再将样品放入烘箱以105℃杀青30 min, 然后80℃烘干至恒重, 分别称取根和茎叶的干重, 并计算整株干重。
1.2.2 SOD、POD、MDA及可溶性蛋白 播种后第10、25和45天分别摘取蓖麻植株最上部叶片, 液氮冷冻后贮藏于-80℃超低温冰箱, 测定超氧化物歧化酶(SOD)和过氧化物酶(POD)活性, 以及可溶性蛋白和丙二醛(MDA)含量。
采用氯化硝基四氮唑蓝光还原法[15]测定SOD和POD活性, 采用硫代巴比妥酸比色法[16]测定MDA含量, 采用考马斯亮蓝法[16]测定可溶性蛋白含量。
1.2.3 重金属元素吸收积累量 播种后第10、25和45天, 每个处理每个重复随机取5株幼苗, 测定重金属元素的积累量。第10天和第25天因幼苗较小用植株整体测定, 第45天将植株分为根、茎、叶分别测定。采用原子吸收光谱法[17-18]测Cu2+、Zn2+和Cd2+含量。
1.3 数据分析
采用Statistix 9统计分析数据, 最小显著差异法(LSD0.05)进行多重比较, SigmaPlot 10.0绘图。
2 结果与分析
2.1 重金属对蓖麻幼苗株高、根长、鲜重和干重的影响
重金属处理显著影响蓖麻的株高。在Cu和Zn处理下, 随处理浓度的增加, 蓖麻10 DAS和25 DAS的株高先增后降, 在处理浓度为60 mg L-1时达最大值(图1)。与对照相比, 30、60和120 mg L-1浓度Cu处理下, 10 DAS和25 DAS株高分别增加了12.5%、46.3%、-5.2%和8.0%、20.0%、7.0%, Zn处理下株高增加了9.8%、9.8%、-2.5%和2.0%、20.0%、-12.0%。而在Cd处理下, 随处理浓度的增加, 蓖麻10 DAS的株高在处理浓度为30 mg L-1时株高最大, 与对照相比增加了7.3%; 而在25 DAS, 株高随处理浓度的增加而降低, 与对照相比分别下降了5.0%、11.9%和7.9% (图1)。
根长对3种重金属胁迫的反应各异。Cu处理下, 10 DAS根长随处理浓度增加略微下降但不显著, 25 DAS根长先增后降, 与对照相比, 在60 mg L-1和120 mg L-1处理浓度下分别降低了14.2%和14.8%。Zn处理下, 10 DAS根长先降后增, 与对照相比, 10 DAS根长在30 mg L-1处理下降低了6.5%, 而在60和120 mg L-1处理下分别增加了14.5%和9.7%; 而25 DAS根长逐渐降低, 与对照相比分别下降了9.3%、0.6%和12.3%。Cd处理下, 10 DAS根长呈增加的趋势, 与对照相比分别增加了22.6%、6.5%和9.7%; 相反的, 25 DAS根长逐渐下降, 分别降低了14.8%、13.6%和18.5% (图2)。
10 DAS: 播种后第10天; 25 DAS: 播种后第25天。柱上同一时期不同大、小写字母表示处理间在0.05水平上差异显著。
10 DAS: 10 days after seeding; 25 DAS: 25 days after seeding.Values followed by different capital and small letters above the bar at same growth periods are significantly different among treatments at the 0.05 probability level.
3种重金属处理下, 蓖麻10 DAS的植株鲜重和干重显著降低, 25 DAS的鲜重和干重仅在Cd处理下减小, 而Cu和Zn处理下无显著规律(表1)。与对照相比, 10 DAS Cu处理下蓖麻鲜重和干重分别下降了12.6%、36.9%、21.0%和30.0%、13.3%、20.0%; Zn处理下鲜重和干重分别降低了24.8%、5.1%、39.7%和13.3%、3.3%、33.3%; Cd处理下分别降低了12.1%、51.4%、19.6%和26.7%、53.3%、13.3%。25 DAS Cd处理下鲜重和干重分别降低了40.2%、30.9%、21.2%和11.5%、8.2%、6.6% (表1)。
2.2 蓖麻幼苗对重金属元素的吸收与积累
蓖麻植株对Cu、Zn、Cd 3种重金属元素的积累量随处理浓度的增加而递增, 除25 DAS的Cu外, 均在120 mg L-1浓度下积累量最高, 其中对Zn的吸收量最高, Cd次之。与对照相比, 10 DAS各浓度处理下, Cu、Zn、Cd的积累量分别增加了22.2%、133.3%、288.9%, 59.5%、86.5%、345.9%和1125.0%、1025.0%、1225.0%; 而25 DAS的积累量分别增加了725.0%、575.0%、425.0%, 150.0%、681.8%、754.5%和1320.0%、1360.0%、3240.0% (图3)。
10 DAS: 播种后第10天; 25 DAS: 播种后第25天。柱上同一时期不同大、小写字母表示处理间在0.05水平上差异显著。
10 DAS: 10 days after seeding; 25 DAS: 25 days after seeding.Values followed by different capital and small letters above the bar at same growth periods are significantly different among treatments at the 0.05 probability level.
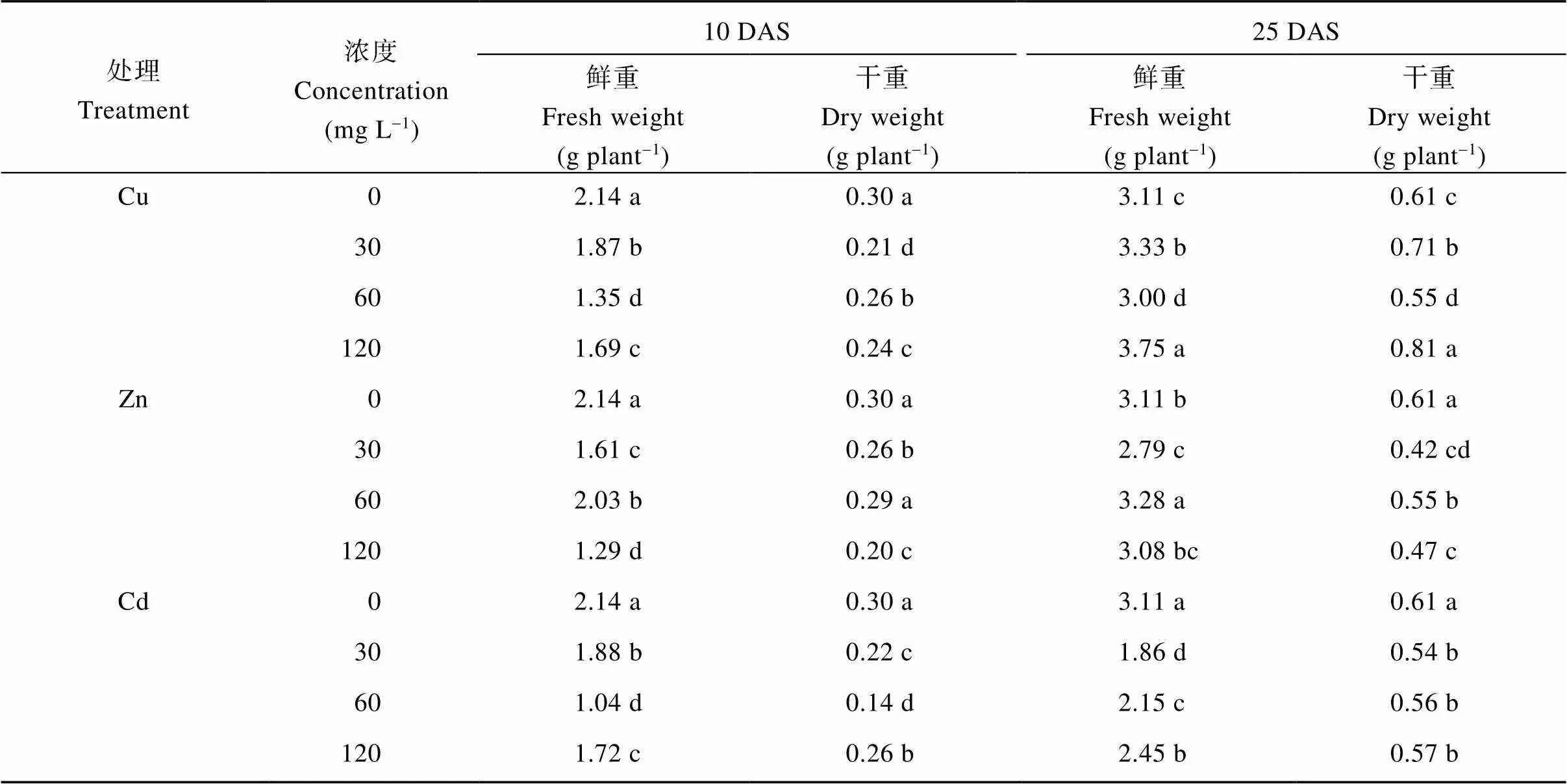
表1 重金属处理下蓖麻幼苗植株的鲜重和干重变化
DAS: 播种后天数。表中同一列数据后不同小写字母表示在0.05水平上差异显著。
DAS: days after seeding. Values followed by different small letters are significantly different at the 0.05 probability level.
Cu、Zn、Cd 3种重金属元素在蓖麻植株各部位的分布相差较大, 总体表现为根 > 茎 > 叶, 且根茎叶中Zn的积累量显著高于Cu和Cd (图4)。随处理浓度的增加, 各重金属元素的积累量显著增加, 与对照相比, 各浓度处理下根系中Cu分别增加了4.5、7.2和7.0倍, Zn增加了0.7、5.1和6.1倍, Cd增加了6.9、8.0、10.3倍, 增幅最大; 而茎秆中Zn和Cd增幅较大, 分别增加了0.67、1.33、1.93倍和7.5、12.5、19.0倍; 叶片中Zn的积累量是Cu和Cd的3~6倍, 与对照相比各浓度下Zn分别增加了10.0%、50.0%和121.0% (图4)。
2.3 不同重金属及浓度对蓖麻幼苗抗氧化酶活性的影响
3种重金属处理下, 叶片中SOD的活性总体呈先降后增的趋势, 10 DAS和45 DAS的SOD活性显著高于25 DAS (图5)。Cu和Zn处理下, 10 DAS 120 mg L-1浓度处理下叶片SOD活性最高, 分别比对照高出45.5%和31.8%; 而25 DAS叶片SOD活性呈先升后将的趋势, 在30 mg L-1处理下SOD活性最高, 分别比对照增加了11.4%和17.1%。Cd处理下, 10 DAS的SOD活性随处理浓度的增加而依次显著降低, 与对照相比分别下降了18.2%、31.8%和65.5%; 而45 DAS, 30 mg L-1处理下SOD活性显著降低, 与对照相比下降了21.3%, 在60 mg L-1和120 mg L-1处理下SOD活性显著升高, 分别增加了18.8%和12.5% (图5)。
10 DAS: 播种后第10天; 25 DAS: 播种后第25天。柱上同一时期不同小写字母表示在0.05水平上差异显著。
10 DAS: 10 days after seeding; 25 DAS: 25 days after seeding.Values followed by different small letters above the bar at same growth periods are significantly different at the 0.05 probability level.
柱上同一时期不同小写字母表示在0.05水平上差异显著。
Values followed by different small letters above the bar at same growth periods are significantly different at the 0.05 probability level.
柱上同一时期不同小写字母表示在0.05水平上差异显著。DAS: 播种后天数。
Values followed by different small letters above the bar at same growth periods are significantly different at the 0.05 probability level. DAS: days after seeding.
3种重金属处理下, 叶片中POD的活性在10 DAS先降后增、在25 DAS和45 DAS显著增加, 且随生长时期的推进活性显著增加(表2)。Cu和Zn处理下POD活性的变化趋势相似, 在10 DAS 120 mg L-1处理下活性最高, 分别比对照高出11.7%和60.9%; 在25 DAS和45 DAS, POD活性随处理浓度递增逐渐增加, 且均在120 mg L-1处理下活性最高, 比对照增加了56.5%和208.3% (Cu处理), 85.7%和168.5% (Zn处理)。Cd处理下, 10 DAS POD活性随处理浓度先降后升, 在30 mg L-1和60 mg L-1处理下活性低于对照, 分别降低了44.4%和20.4%, 而在120 mg L-1处理下活性显著增加, 高于对照40.2%; 而在25 DAS和45 DAS, 各处理浓度下POD活性均高于对照, 且在60 mg L-1处理下活性最高, 此浓度下比对照分别增加了54.1%和142.3% (表2)。
2.4 不同重金属对蓖麻幼苗可溶性蛋白及丙二醛含量的影响
在各生长阶段, Cu处理下可溶性蛋白含量仅在120 mg L-1显著增加, 与对照相比分别增加18.8%、66.7%和83.3%。Zn处理下, 可溶性蛋白含量仅在10 DAS 60 mg L-1和120 mg L-1浓度下显著增加, 分别增加了7.1%和3.6%, 而在25 DAS无显著变化、45 DAS显著降低。Cd处理下, 可溶性蛋白含量在10 DAS和25 DAS无显著变化, 而在45 DAS 120 mg L-1浓度下显著增加, 比对照增加了14.2% (图6)。
3种重金属处理下, MDA含量随处理浓度的增大显著增加、随生育进程的推进而显著降低, 且Cd处理下的MDA含量显著高于Cu和Zn处理(表3)。Cu处理下, 各处理浓度的MDA与对照相比, 在10 DAS分别增加了1.96、2.50和2.84倍, 25 DAS增加了1.66、2.66和3.38倍, 而在45 DAS增加了1.57、2.33和3.15倍。Zn溶液处理下的各生长阶段的MDA含量分别增加了2.24、3.12、3.90倍, 1.72、2.78、3.69倍和1.29、2.14、3.06倍。Cd处理下MDA的增幅最大, 尤其在120 mg L-1处理浓度下在10 DAS、25 DAS和45 DAS分别比对照增加了6.35、5.23和4.02倍(表3)。
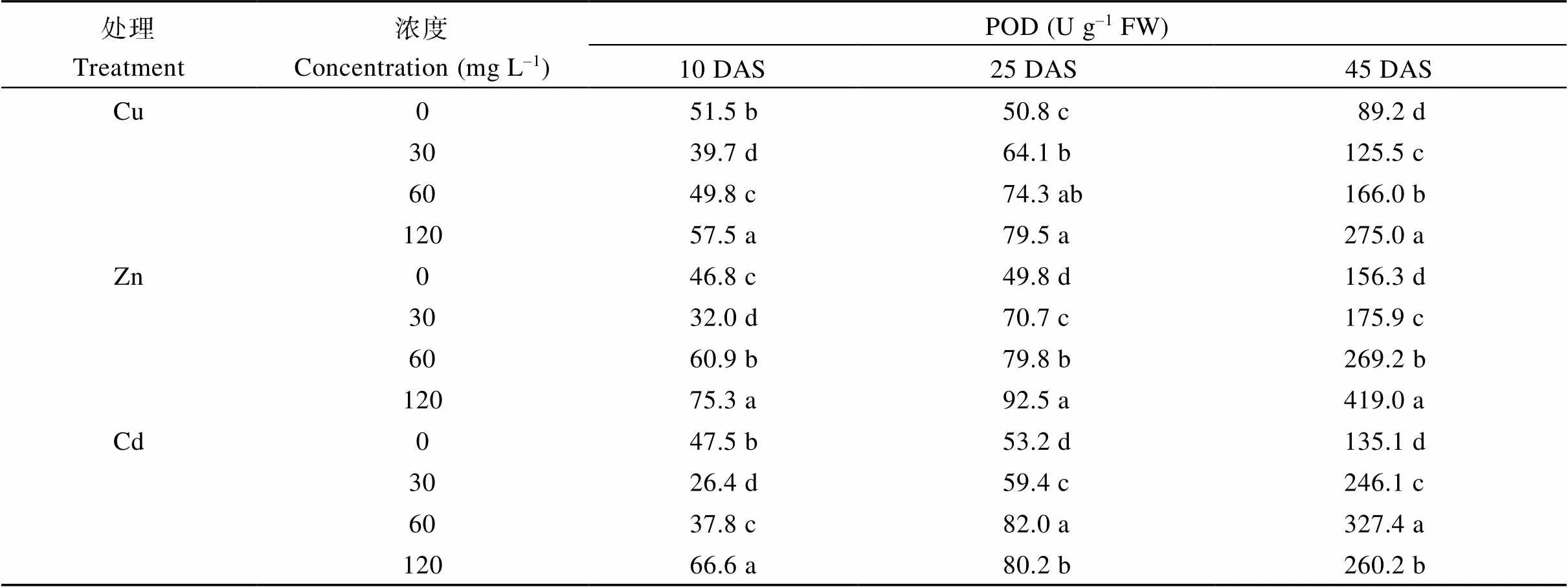
表2 重金属处理下不同时期蓖麻植株叶片的POD活性的变化
DAS: 播种后天数。表中同一列同一金属处理下各浓度后不同小写字母表示在0.05水平上差异显著。
DAS: days after seeding. Values followed by different small letters are significantly different at the 0.05 probability level.
柱上同一时期不同小写字母表示在0.05水平上差异显著。DAS: 播种后天数。
Values followed by different small letters above the bar at same growth periods are significantly different at the 0.05 probability level. DAS: days after seeding.
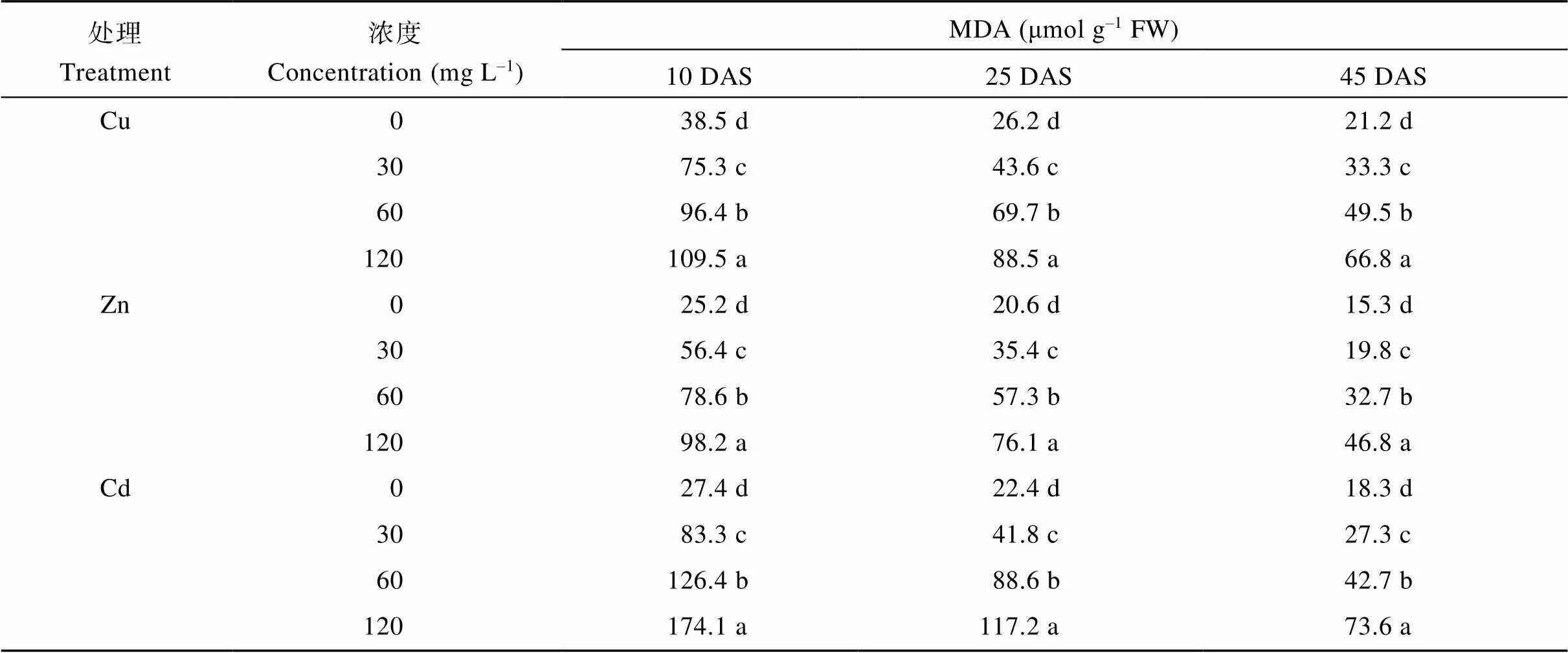
表3 不同重金属处理下各时期蓖麻叶片的丙二醛含量
表中各时期同一种金属处理下各浓度后不同小写字母表示在0.05水平上差异显著。DAS: 播种后天数。
Values followed by different small letters are significantly different at the 0.05 probability level. DAS: days after seeding.
3 讨论
3.1 重金属处理对蓖麻幼苗生长的影响
重金属污染已成为威胁农业生产与农产品安全的重要环境因素, 重金属对作物的毒理作用主要表现为抑制吸水萌发、生根、幼苗生长和促进坏死[19]。本研究表明, 重金属胁迫显著影响蓖麻生长, 植株的根长、鲜重、干重显著降低, 这与宋清梅等[20]、姚俊修等[21]的研究结果一致。这说明重金属胁迫抑制了植物光合产物的合成与积累, 这种抑制作用一方面可能来自于对重金属吸收富集毒性的直接作用,如降解光合色素、抑制细胞分裂等, 重金属胁迫会通过降低植物叶片的气孔导度和胞间二氧化碳浓度从而降低净光合速率[22]; 另一方面也可来自于对微量元素、水分获取能力抑制的间接作用[23]。此外, 重金属对蓖麻株高的影响表现为低浓度促进、高浓度抑制的现象, 姚俊修等[21]和宋洁等[24]的研究也发现,低浓度的Pb和Cd对植物的生长和光合作用具有促进作用, 而高浓度重金属处理时表现为抑制现象。其可能的原因是低浓度的重金属胁迫可促进植株叶绿素的合成, 提高细胞内酶的活性, 进而提高光合速率、增加光合产物的积累以促进植物生长; Cu和Zn是植物生长所必需的微量元素, 适当的浓度可促进幼苗根的生长; Cd虽然不是植物生长所必需的元素, 但Cd对一些植物生长存在剂量效应, 低浓度Cd可以提高或加速某些生理生化反应, 从而促进根的生长[25-26]。当重金属浓度过高时, 叶绿体蛋白质巯基上的Fe、Mg等离子被重金属所替代, 降低叶绿素酶活性, 阻断叶绿素的合成, 导致光合速率下降, 致使植物生长受抑或死亡[21]。重金属对根生长的影响主要通过抑制有丝分裂过程实现, 重金属浓度过高或根部积累的重金属含量积累至一定水平时, 有丝分裂过程减缓, 表现为根系生长缓慢或停止生长[27]。
3.2 蓖麻幼苗对重金属处理的生理响应
重金属等逆境胁迫下植物生长抑制的另一原因是植物体内产生大量的活性氧(ROS), 引发膜脂过氧化反应和脱酰化, 直接破坏核酸和蛋白质等代谢活动所致[15]。MDA是脂质过氧化的产物, 其含量是反映细胞膜损坏程度的重要指标。本试验研究发现, MDA含量随处理浓度的增加显著增加、随生育进程的推进而显著降低, 且Cd处理下的MDA含量显著高于Cu和Zn处理。这表明蓖麻植株随重金属处理浓度的增大细胞膜损伤逐渐加剧, 且Cd对植株的毒害程度显著高于Cu和Zn处理, 随植株的生长抗逆性增强。植物通过抗氧化酶系统和非酶系统来降低或清除ROS的毒害[15]。本研究中发现, 抗氧化酶系统中SOD活性总体先降后增, 在10 DAS 120 mg L-1Cu和Zn处理下SOD活性最高; POD活性在10 DAS先降后增、在25 DAS和45 DAS显著增加, 且随生长时期的推进POD活性增加显著。这说明蓖麻植株通过增加保护酶活性来降低重金属胁迫的危害, 在植物的不同生长阶段SOD和POD在清除ROS中发挥的作用不同。SOD可将(O2-)歧化成H2O2和O2, H2O2再通过CAT和POD的作用被分解为无毒害的H2O和O2, 从而使植株免受伤害[28]。可溶性蛋白含量仅在120 mg L-1Cu处理下显著增加, 表明蓖麻仅在高浓度Cu污染条件下强化非酶系统的渗透调节功能缓解重金属的损伤[29], 同时也反映出重金属环境中蓖麻主要通过抗氧化酶系统来缓解逆境胁迫。
3.3 蓖麻幼苗对重金属的吸收和积累
2016年中央一号文件提出“藏粮于地、藏粮于技”的科技战略, 其中提高耕地质量和土壤健康是藏粮于地的基础, 因此重金属污染土壤的修复意义重大。利用重金属超富集植物清理移除土壤中的重金属污染物是一种生态环保、高效易行的土壤修复方法[30]。本研究发现, 蓖麻植株对Cu、Zn、Cd的积累量随处理浓度的增加而递增, 其中对Zn的积累量最高, Cd次之, 这与夏雪姣等[18]的研究结果一致。植物根系的细胞壁、细胞膜和细胞器对Zn、Cd具有识别能力, 能通过沉淀、络合、区域化等作用, 将其固定于根内, 继而抑制其向地上部分转运, 这也是缓解植物的光合作用及新陈代谢毒害的策略[17]。随着重金属在植株中的不断迁移, 根、茎、叶所积累的重金属含量也随之递减, 即蓖麻幼苗各部位对重金属的积累能力表现为根>茎>叶。这一发现与莫争等[31]对水稻的研究发现类似, 即重金属在水稻植株不同部位的积累分布呈根>主茎>穗>籽粒>叶, 但与小麦[32]和大豆[33]各部位的重金属积累能力则有所不同, 这一差异的产生可能是由于品种类型、遗传背景及重金属间的互作效应[34]。与此同时, 本研究还发现, 蓖麻不同部位对不同重金属的积累能力有所差异, 整体表现为: 根和茎对重金属的吸收和积累量呈Zn > Cd > Cu; 叶片对重金属的吸收和积累能力则表现为Zn > Cu > Cd, 这表明幼苗期的蓖麻对Zn的吸收和积累能力显著强于对Cu和Cd的吸收和积累能力。此外, Zn是植物生长必需的微量元素, 因此蓖麻对Zn的吸收量高于其他两种重金属元素, 这也是蓖麻维持正常生长和代谢所需。由此可见, 种植蓖麻可作为修复重金属污染土壤的有效途径之一, 收割蓖麻的不同部位可清除特定的重金属污染物。
4 结论
重金属胁迫显著抑制蓖麻的生长, 蓖麻对重金属具有一定的耐受性, 主要通过提高抗氧化酶活性缓解重金属胁迫。蓖麻植株对Cu、Zn、Cd的积累量随处理浓度的增加而递增, 其中对Zn的积累量最高, Cd次之。蓖麻对不同重金属的积累具有器官特异性, 对重金属的积累量表现为根 > 茎 > 叶。种植蓖麻可作为修复Cu、Zn、Cd等重金属污染土壤的有效途径之一。
[1] 樊霆, 叶文玲, 陈海燕, 鲁洪娟, 张颖慧, 李定心, 唐子阳, 马友华. 农田土壤重金属污染状况及修复技术研究. 生态环境学报, 2013, 22: 1727–1736. Fan T, Ye W L, Chen H Y, Lu H J, Zhang Y H, Li D X, Tang Z Y, Ma Y H. Study on heavy metal pollution and rehabilitation techniques in farmland soil., 2013, 22: 1727–1736 (in Chinese with English abstract).
[2] Smith V H, Schindler D W. Eutrophication science: where do we go from here?, 2009, 24: 201–207.
[3] 马敏, 龚惠红, 邓泓. 重金属对8种园林植物种子萌发及幼苗生长的影响. 中国农学通报, 2012, 28(22): 206–211. Ma M, Gong H H, Deng H. Effects of heavy metals on seed germination and seedling growth of 8 garden plants., 2012, 28(22): 206–211 (in Chinese with English abstract).
[4] 王利宝, 朱宁华, 鄂建华. Pb、Zn等重金属对樟树、栾树幼苗生长的影响. 中南林业科技大学学报, 2010, 30(2): 44–47. Wang L B, Zhu N H, E J H. Effects of Pb, Zn and other heavy metals on the growth of camphor and Luan seedlings., 2010, 30(2): 44–47 (in Chinese with English abstract).
[5] 邱丽俊, 刘爱忠. 我国优势油脂类生物柴油植物蓖麻的种质资源发掘和生物柴油利用. 生命科学, 2014, 26: 503–508. Qiu L J, Liu A Z. Germplasm resources exploitation and biodiesel utilization of, a dominant oil biodiesel plant in China., 2014, 26: 503–508 (in Chinese with English abstract).
[6] Scholz V, Silva J N D. Prospects and risks of the use of castor oil as a fuel., 2008, 32: 95–100.
[7] Huang G, Guo G, Yao S, Zhang N, Hu H. Organic acids, amino acids compositions in the root exudates and Cu-accumulation in castor (L.) under Cu stress., 2016, 18: 33–40.
[8] Niu Z X, Sun L N, Sun T H. Response of root and aerial biomass to phytoextraction of Cd and Pb by sunflower, castor bean, alfalfa and mustard., 2009, 3: 255.
[9] Kabir M, Iqbal M Z, Shafiq M, Farooqi Z R. Effects of lead on seedling growth ofL., 2010, 56: 194–199.
[10] 易心钰, 蒋丽娟, 易诗明, 陈景震, 刘强. 铅锌矿渣对蓖麻生长、重金属累积及其对矿质元素吸收的影响. 中南林业科技大学学报, 2017, 37(3): 116–122. Yi X Y, Jiang L J, Yi S M, Chen J Z, Liu Q. Effects of lead-zinc slag on growth, accumulation of heavy metals and absorption of mineral elements of castor bean., 2017, 37(3): 116–122 (in Chinese with English abstract).
[11] 陆晓怡, 何池全. 蓖麻对重金属Cd的耐性与吸收积累研究. 农业环境科学学报, 2005, 24: 674–677. Lu X Y, He C Q. Studies on the tolerance, uptake and accumulation of heavy metal Cd by castor bean., 2005, 24: 674–677 (in Chinese with English abstract).
[12] Lu X Y, He C Q. Tolerance, uptake and accumulation of cadmium byL., 2005, 24: 674–677.
[13] Begonia G B, Davis C D, Begonia M F T, Gray C N. Growth responses of Indian mustard [, (L.) Czern.] and its phytoextraction of lead from a contaminated soil., 1998, 61: 38–43.
[14] 邹京南, 于奇, 金喜军, 王明瑶, 秦彬, 任春元, 王孟雪, 张玉先. 外源褪黑素对干旱胁迫下大豆鼓粒期生理和产量的影响. 作物学报, 2020, 46: 745–758. Zou J N, Yu Q, Jin X J, Wang M Y, Qin B, Ren C Y, Wang M X, Zhang Y X. Effects of exogenous melatonin on physiology and yield of soybean during seed filling stage under drought stress., 2020, 46: 745–758 (in Chinese with English abstract).
[15] 朱广龙, 宋成钰, 于林林, 陈许兵, 智文芳, 刘家玮, 焦秀荣, 周桂生. 外源生长调节物质对甜高粱种子萌发过程中盐分胁迫的缓解效应及其生理机制. 作物学报, 2018, 44: 1713–1724. Zhu G L, Song C Y, Yu L L, Chen X B, Zhi W F, Liu J W, Jiao X R, Zhou G S. Alleviation effects of exogenous growth regulators on seed germination of sweet sorghum under salt stress and its physiological basis., 2018, 44: 1713–1724 (in Chinese with English abstract).
[16] 张海燕, 汪宝卿, 冯向阳, 李广亮, 解备涛, 董顺旭, 段文学, 张立明. 不同时期干旱胁迫对甘薯生长和渗透调节能力的影响. 作物学报, 2020, 46: 1760–1770. Zhang H Y, Wang B Q, Feng X Y, Li G L, Xie B T, Dong S X, Duan W X, Zhang L M. Effects of drought treatments at different growth stages on growth and the activity of osmotic adjustment in sweet potato [(L.) Lam.]., 2020, 46: 1760–1770 (in Chinese with English abstract).
[17] 毛雪飞, 杨洁. 锌镉胁迫下 4 种农田杂草生理生化特性及对重金属的累积特征. 西南林业大学学报(自然科学), 2019, 39(6): 9–18. Mao X F, Yang J. Physiological and biochemical characteristics of 4 farmland weeds under Zn and Cd stress and accumulation characteristics of heavy metals.(Nat Sci), 2019, 39(6): 9–18 (in Chinese with English abstract).
[18] 夏雪姣. 镉、铅胁迫对小麦形态发育和生理代谢的影响及富集特性研究. 西北农林科技大学硕士学位论文, 陕西杨凌, 2018. Xia X J. Effects of Cadmium, Lead Stress on Morphological Development and Physiological Metabolism and Research on Their Accumulation in Wheat. MS Thesis of Northwest A & F University, Yangling, Shaanxi, China, 2018 (in Chinese with English abstract).
[19] Hossain M A, Piyatida P, Da Silva J A T, Fujita M. Molecular mechanism of heavy metal toxicity and tolerance in plants: central role of glutathione in detoxification of reactive oxygen species and methylglyoxal and in heavy metal chelation., 2012, 2012: 872–875.
[20] 宋清梅, 蔡信德, 吴颖欣, 吴嘉慧, 陈显斌, 吴文成. 香根草对污染土壤水溶态重金属组分胁迫响应研究. 农业环境科学学报, 2019, 38: 2715–2722. Song Q M, Cai X D, Wu Y X, Wu J H, Chen X B, Wu W C. Response ofto the stress of water-soluble components of heavy metals in contaminated soil., 2019, 38: 2715–2722 (in Chinese with English abstract).
[21] 姚俊修, 乔艳辉, 杨庆山, 仲伟国, 李庆华, 董玉峰, 李善文, 吴德军. 重金属镉胁迫对黑杨派无性系光合生理及生长的影响. 西北林学院学报, 2020, 35(2): 40–46. Yao J X, Qiao Y H, Yang Q S, Zhong W G, Li Q H, Dong Y F, Li S W, Wu D J. Effects of cadmium stress on the growth and photosynthesis of aigeiros clones., 2020, 35(2): 40–46 (in Chinese with English abstract).
[22] 明华, 曹莹, 胡春胜, 张玉铭, 程一松. 铅胁迫对玉米光合特性及产量的影响. 玉米科学, 2008, 16(1): 74–78. Ming H, Cao Y, Hu C S, Zhang Y M, Cheng Y S. Effect of lead stress on the photosynthetic characteristics and yield of maize., 2008, 16(1): 74–78 (in Chinese with English abstract).
[23] Aibibu N, Liu Y G, Zeng G M, Wang X, Chen B B, Song H X, Xu L. Cadmium accumulation in vetiveria zizanioides and its effects on growth, physiological and biochemical characters., 2010, 101 : 6297–6303.
[24] 宋洁, 郭华春, 李俊, 张光海, 思玲超. 铅胁迫对马铃薯幼苗生长形态及内源激素的影响. 西北农业学报, 2019, 28: 1830–1835. Song J, Guo H C, Li J, Zhang G H, Si L C. Effect of lead stress on growth morphology and endogenous hormone of potato seedlings., 2019, 28: 1830–1835 (in Chinese with English abstract).
[25] 汤文光, 肖小平, 张海林, 黄桂林, 唐海明, 李超, 刘胜利, 汪柯. 轮耕对双季稻田耕层土壤养分库容及Cd含量的影响. 作物学报, 2018, 44: 105–114.Tang W G, Xiao X P, Zhang H L, Huang G L, Tang H M, Li C, Liu S L, Wang K. Effects of rotational tillage on nutrient storage capacity and Cd content in tilth soil of double-cropping rice region., 2018, 44: 105–114 (in Chinese with English abstract).
[26] Islam K R. Response of rice seedlings to copper toxicity and acidity., 2006, 29: 943–957.
[27] Nyitrai P, Bóka K, Gáspár L, Sárvári É, Lenti K, Keresztes Á. Characterization of the stimulating effect of low-dose stressors in maize and bean seedlings., 2003, 160: 1175–1183.
[28] Gong J, Zhao A, Zhang L, Zhang X. A comparative study on anti-oxidative ability of several desert plants under drought stress., 2004, 24: 1570–1577.
[29] Cervilla L M, Blasco B, Ríos J J, Romero L, Ruiz J M. Oxidative stress and antioxidants in tomato () plants subjected to boron toxicity., 2007, 100: 747–756.
[30] 赵会君, 梁昕昕, 魏玉清. 不同浓度的Cu、Mn、Zn胁迫对商陆叶片光合系统参数及抗氧化酶系统的影响. 北方园艺, 2020, (3): 120–127. Zhao H J, Liang X X, Wei Y Q. Effect of different concentrations of Cu, Zn, and Mn on the photosynthetic and antioxidative system of phytolaccca americana., 2020, (3): 120–127 (in Chinese with English abstract).
[31] 莫争, 王春霞, 陈琴, 王海, 薛传金, 王子健. 重金属Cu, Pb, Zn, Cr, Cd在水稻植株中的富集和分布. 环境化学, 2002, 21(2): 110–116. Mo Z, Wang C X, Chen Q, Wang H, Xue C J, Wang Z J. Enrichment and distribution of heavy metals Cu, Pb, Zn, Cr, Cd in rice plants., 2002, 21(2): 110–116 (in Chinese with English abstract).
[32] 施亚星, 吴绍华, 周生路, 王春辉, 陈浩. 土壤-作物系统中重金属元素吸收、迁移和积累过程模拟. 环境科学, 2016, 37: 3996–4003. Shi Y X, Wu S H, Zhou S L, Wang C H, Chen H. Simulation of the absorption, migration and accumulation process of heavy metal elements in soil-crop system., 2016, 37: 3996–4003 (in Chinese with English abstract).
[33] 李淑芹, 田仲鹤, 金宏鑫, 于淼, 徐景钢. 施用城市污泥堆肥对土壤和大豆器官重金属积累的影响. 农业环境科学学报, 2014, 33: 352–357. Li S Q, Tian Z H, Jin H X, Yu M, Xu J G. Effects of municipal sludge composting on heavy metal accumulation in soil and soybean organs., 2014, 33: 352–357 (in Chinese with English abstract).
[34] 林小兵, 周利军, 王惠明, 刘晖, 武琳, 俞莹, 胡敏, 何波, 周青辉, 黄欠如. 不同水稻品种对重金属的积累特性. 环境科学, 2018, 11: 5198–5206. Lin X B, Zhou L J, Wang H M, Liu H, Wu L, Yu Y, Hu M, He B, Zhou Q H, Huang Q R. Accumulation characteristics of heavy metals in different rice varieties., 2018, 11: 5198–5206 (in Chinese with English abstract).
Growth, physiological, and heavy metal accumulation traits at seedling stage under heavy metal stress in castor (L.)
LYU Dong-Mei1,2,**, ZHU Guang-Long1,**,*, WANG Yue1,**, SHI Yu1, LU Fa-Guang1, REN Zhen1, LIU Yu-Qian1, GU Li-Feng1, LU Hai-Tong1, Irshad Ahmad1, JIAO Xiu-Rong1, MENG Tian-Yao1, and ZHOU Gui-Sheng1,*
1Joint International Research Laboratory of Agriculture and Agri-Product Safety, the Ministry of Education, Yangzhou University / Co-Innovation Center for Modern Production Technology in Grain Crops of Jiangsu Province, Yangzhou 225009, Jiangsu, China;2Plant Science Department, MacDonald Campus, McGill University, Montreal H9X3V9, Canada
Agricultural ecology environment and human health are seriously threated by aggravating agricultural non-point source and heavy metals pollution. It is of great significance to explore the cumulative effect of crops on heavy metal pollution and its physiological mechanism. A castor (L.) variety Zibi 5 was used to study the accumulation effect of heavy metals and associated physiological mechanism under heavy metals treatments (Cu, Zn and Cd at 0, 30, 60, and 120 mg L-1concentrations). The results showed that seedling growth, physiological traits and heavy metals accumulation significantly affected by heavy metal treatments. Plant height was increased to the maximum with 60 mg L-1and then decreased. However, root length, fresh weight and dry weight were all decreased under heavy metal treatments. In general, SOD activity was decreased at low treatment concentration but increased at high treatment concentration, the highest activity was showed at 120 mg L-1under Cu and Zn treatments at 10 DAS (days after sowing), which were 45.5% and 31.8% higher than that under CK, respectively. POD activity was first decreased and then increased on 10 DAS, but significantly increased in both 25 DAS and 45 DAS, as well as prominently increased with prolonged the growth periods. Soluble protein was only significantly increased under 120 mg L-1Cu treatment, and increased by 18.8%, 66.7%, and 83.3% at each growth stage, respectively. MDA content was significantly increased with the increase of treatment concentration and significantly decreased with prolonged the growth periods, and MDA content was significant higher under Cd treatment than that under Cu and Zn treatments. The accumulation contents of Cu, Zn, and Cd in castor plant were gradually increased with the increase of treatment concentration, and the maximum accumulation was at 120 mg L-1concentration. Among of them, the accumulation of treatment concentration increased, and the maximum accumulation showed at 120 mg L-1concentration. Among them, the accumulation of Zn was the highest, followed by Cd. The accumulation content of heavy metals in each organ was shown as root > stem > leaf. This study suggested that castor has a certain tolerance to heavy metals, which was increased the antioxidase activity to alleviate heavy metals stress. The castor has organ specificity in heavy metals accumulation. It is an effective approach to plant castor to repair soil pollution by heavy metals such as Cu, Zn, and Cd.
castor; heavy metal stress; growth trait; heavy metal accumulation; physiological mechanism
10.3724/SP.J.1006.2021.04146
本研究由国家重点研发计划项目(2018YFE0108100, 2018YFD0800201), 扬州大学科技创新培育基金(2019CXJ198), 江苏省林业科技创新与推广项目(LYKJ[2019]47)和扬州市绿扬金凤人才计划(2018)项目资助。
This study was supported by the National Key Research and Development Program of China (2018YFE0108100, 2018YFD0800201), the Science and Technology Innovation Cultivating Fund of Yangzhou University (2019CXJ198), the Innovation and Promotion of Forestry Science and Technology Program of Jiangsu Province (LYKJ[2019]47), and the Talent Project of ‘LyuYangJinFeng’ of Yangzhou Government (2018).
周桂生, E-mail: gszhou@yzu.edu.cn; 朱广龙, E-mail: zhuguang2007@163.com
**同等贡献(Contributed equally to this work)
吕冬梅, E-mail: dongmei.lyu@mail.mcgill.ca; 朱广龙, E-mail: zhuguang2007@163.com
2020-07-03;
2020-10-14;
2020-11-18.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20201117.1842.002.html

