MiRNAs在甲状腺癌中的研究进展
查卫娜 综述 刘阁玲,杨晓琳 审校
华北理工大学附属唐山市工人医院内分泌一科,河北 唐山 063000
在近20年中,甲状腺癌作为内分泌系统中最常见的恶性肿瘤,其发病率逐年上升。根据官方统计,从1990到2016年,全球甲状腺癌的发病率由1.6/10万增长至3.2/10万,甲状腺癌的发病率较前增长了50%[1]。在甲状腺癌患者中,女性发病率要高于男性。2018年,SALAMANCA-FERNÁNDEZ等[2]收集了西班牙1985—2013年期间所有新诊断的1 265例甲状腺癌患者的资料,对其发病趋势进行了分析,结果显示女性发病率高达72.6%,发病率远高于男性患者。甲状腺癌患者经手术或放射治疗后大多预后尚可,但仍存在远期转移的可能。LEE等[3]收集了166例18岁及18岁以下儿童滤泡细胞源性分化型甲状腺癌患者的病历资料,这些患者都进行了不同的手术或放射治疗,并进行了追踪随访,根据随访调查发现在平均随访时间5年内,有69%的患者存活,无疾病迹象;而有6%的患者仍在影像学上检测到残余结构性疾病;而2%的患者死于脑转移。因此,近些年来人们致力于甲状腺癌致癌基因的研究,旨在为甲状腺癌患者早期诊断及临床治疗提供有力的保障。研究表明,miRNA在甲状腺癌中存在差异性表达,对甲状腺癌癌细胞的生长、增殖、分化、迁移等生物学进程有调控作用。本文就miRNA在不同组织病理类型的甲状腺癌中的研究进展进行综述。
1 MicroRNAs的概述
微小RNAs(MicroRNAs,miRNAs)是近些年发现的一种高等真核生物基因组编码的单链RNA分子,通过基因编码转录后形成由21~25个核苷酸组成的小编码RNA[4]。人类基因组由大量的miRNA基因组成,占所有预测人类基因的1%~5%[5],而哺乳动物的miRNA则可调控所有蛋白质编码基因的30%[6]。因为miRNAs能够特异性的与靶基因中mRNA的3’UTR区进行完全或不完全的互补配对,最终通过降解mRNA或者抑制蛋白质翻译而发挥调控作用[7]。miRNA的形成及作用机制具体过程见图1[8]。但是由于多个miRNA可以靶向作用于同一个mRNA,因此miRNA与mRNA表达之间没有线性相关性[9]。
随着人们对MiRNAs在肿瘤中作用机制不断深入的研究,发现miRNAs在多种肿瘤中存在差异性表达,并参与了癌细胞多种生物学进程的发展,为癌症的早期诊断及临床治疗提供了新的契机。现阶段,已有的研究已证实,在许多参与癌症发生发展的分子标志物中,miRNAs既可作为抑癌基因发挥作用,也可作为原癌基因参与肿瘤的发生与发展,例如:俞海波[10]发现miR-539在胰腺癌组织中呈现表达下调,并且通过上调miR-539的表达,抑制了胰腺癌细胞的增殖、迁移、侵袭等生物学进程,延缓了癌症的发生与发展。此项研究提示了miR-539可能对于胰腺癌的早期诊断、临床治疗及预后有指导作用,有望成为胰腺癌新型的分子标志物;ZHENG等[11]通过上调非小细胞肺癌癌组织中miR-4651的表达,靶向调控BRD4,从而对非小细胞肺癌的细胞增殖、生长和迁移等过程产生抑制作用,为非小细胞肺癌的诊断、治疗带来了新的可能;BOUBAKER等[12]研究了Has-mir-143及Has-let-7c在膀胱癌中的表达情况,发现Has-mir-143在膀胱癌中表达下调,Has-let-7c则在膀胱癌中呈现出与前者相反的表达情况,并且通过相关实验提出了Has-mir-143有望作为膀胱癌侵袭能力的新型分子指标。在甲状腺癌中,miRNAs也存在着差异性表达,为甲状腺癌的早期诊断及临床靶向药物治疗提供了潜在的可能。
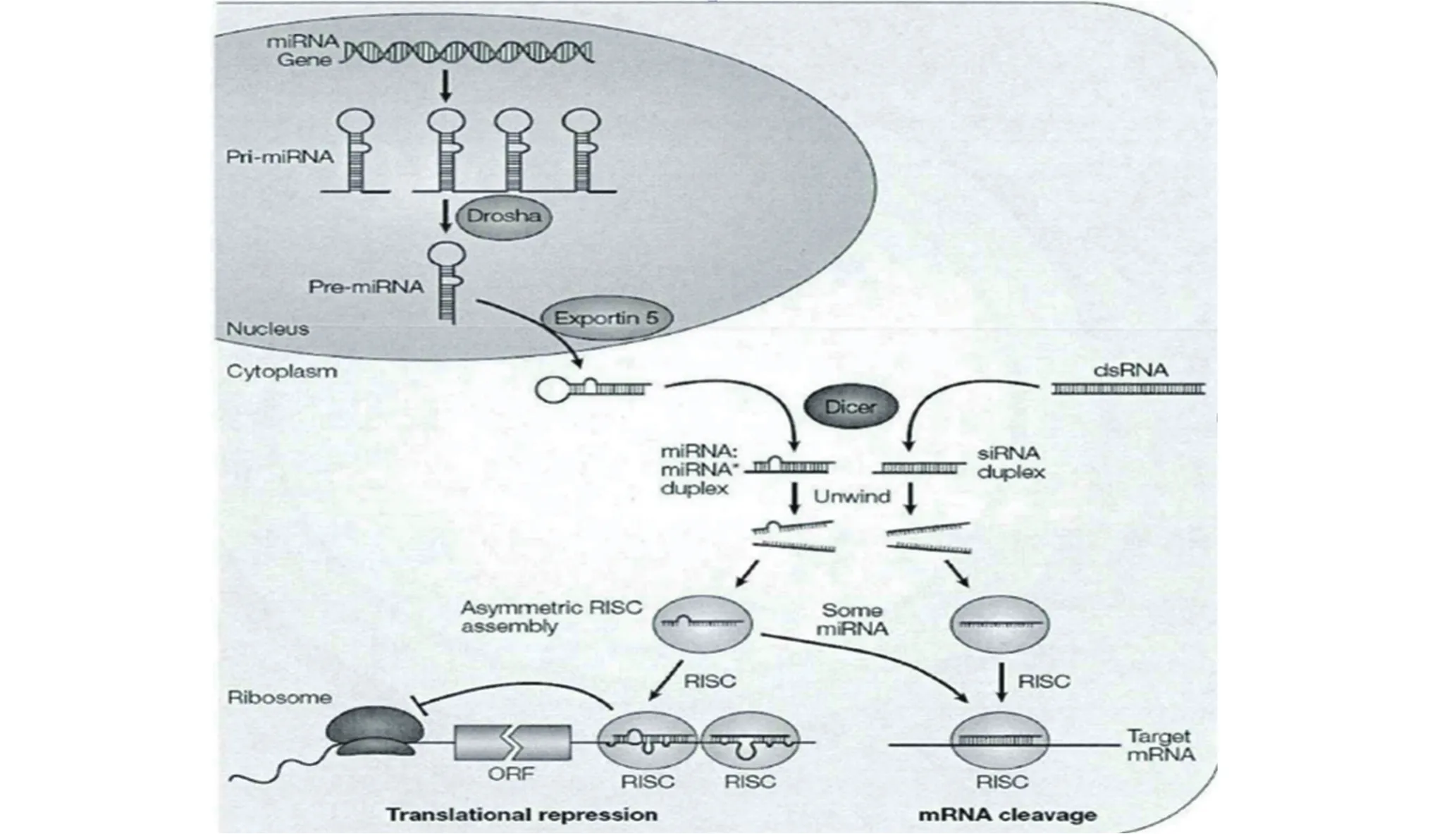
图1 miRNA的形成过程及作用机制
2 MicroRNAs与甲状腺癌
2.1 MicroRNAs与PTC 甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺癌中最常见的一种类型,约占甲状腺癌所有病理组织类型的88%[13],以女性患者多见。尽管PTC被认为是一种预后良好的疾病,但仍存在着远期预后不佳的风险,例如:外侧淋巴结转移、大量甲状腺外扩张、远处转移[14]。研究发现,miRNAs在PTC中存在异常表达,见表1。

表1 miRNA在甲状腺乳头状癌中的表达情况
MiR-221作为miR-222成簇分布的miRNAs,在多种肿瘤中出现异常表达。LI等[19]研究了miR-221在甲状腺乳头状癌癌组织及邻近正常甲状腺乳头状组织中的表达情况,并结合临床病理特征进行分析,发现miRNA-221在甲状腺乳头状癌中表达上调,并且miR-221与甲状腺乳头状癌的TNM分期和淋巴结转移有关,为甲状腺乳头状癌的早期诊断及临床病理分期提供了新的思路。此外miR-221可以通过调节上皮-间充质转换(EMT)相关蛋白表达,促进PTC-K1细胞的增殖、迁移和侵袭活性。与此同时,LI等[19]发现miR-221对RECK有负向调节作用,明确了miR-221的直接靶点为RECK,为甲状腺乳头状癌的临床治疗提供了新的靶点。
在甲状腺乳头状癌中,BRAF基因突变是最常见的突变类型。BRAF基因作为RAF家族中的一员,根据BRAF基因突变的性质,使RAS-RAF-MEK-MAP激酶信号通路的活性发生改变,从而导致潜在细胞通路的多样性[20],进而调控癌细胞增殖、分化等生物进程。根据研究发现,miRNA与BRAF V600E突变之间存在着一定联系,参与了甲状腺乳头状癌癌细胞的增殖、分化、侵袭等多种生物学进程。一项研究发现,携带BRAF突变的甲状腺乳头状癌患者的miR-146b表达水平高于BRAF野生型患者[21]。BRAF-miRNA调控的发现为了解甲状腺乳头状癌的细胞生物学开辟了新的视角。YAN等[22]对miR-150-5p在甲状腺乳头状癌癌细胞的调控机制进行了研究,发现过表达的miR-150-5p促进了B-CPAP和TPC-1细胞的增殖,抑制了细胞凋亡,加速了EMT过程,提出了miR-150-5p可能是甲状腺细胞恶性转化过程中的关键调控因子。在此基础上,YAN等[22]发现BRAF V600E突变促进了miR-150-5p的过表达,而TERT突变则进一步增强了BRAF V600E突变对B-CPAP和TPC-1细胞中miR-150-5p表达的促进作用,进一步提示了BRAF V600突变的存在与PTC患者的癌症相关死亡率的增加显着相关。miRNA的差异性表达为PTC的研究提供理论依据,BRAF V600E的状态对PTC的预后和治疗也提供了新的思路。
2.2 MiRcroNAs与FTC 甲状腺滤泡样癌(follicular thyroid carcinoma,FTC)是分化型甲状腺癌的一种,属于中度恶性肿瘤,与甲状腺乳头状癌相比,甲状腺滤泡样癌较少经淋巴转移。它有向血管侵犯的趋势,可通过血液转移到骨组织、肺组织、肝组织和中枢神经系统中。在甲状腺滤泡状癌中miRNAs的研究相对较少,目前已知miRNA的差异性表达情况见表2。

表2 miRNA在甲状腺滤泡样癌中的表达情况
MA等[25]在探讨ST8STIA4对甲状腺滤泡状癌的调控机制中发现,在甲状腺滤泡状癌组织中miR-146a/b存在差异性表达,通过实时定量PCR技术检测miR-146a/b的表达情况,发现miR-146a/b在甲状腺滤泡状癌组织中表达显著上调。MA等[25]发现通过下调miR-146a/b的表达量,甲状腺滤泡状癌细胞的增殖、迁移等多种生物学进程均受到了抑制,负向调控了甲状腺滤泡状癌的发生发展。为了进一步研究甲状腺滤泡状癌的发生通路,MA等[25]还通过相关实验证实了ST8STIA4的下游通路PI3K-Akt-mTOR通路及miR-146a/b相关性,发现miR-146a/b可通过负向调控ST8STIA4使得PI3K-Akt-mTOR通路激活,最终影响了甲状腺滤泡状癌细胞的增殖、迁移及侵袭等生物学进程。
微浸润性甲状腺滤泡癌(MI-FTC)具有限制性包膜及血管浸润的特征的特征,它具有良好的远期预后。但是,由于严重的远处转移(即转移性MI-FTC),某些MI-FTC病例预后较差。TOMOO等[26]发现,在微浸润性甲状腺滤泡癌中,miR-221/222簇,miR-10b和miR-92a的miRNA表达明显上调,并且miR-10b有可能成为评估MI-FTC在初始手术阶段转移潜力的潜在预后因素。这些研究使人们对甲状腺滤泡样癌的分子机制提供了新的思路,并对甲状腺滤泡样癌的临床诊断及临床治疗提供了新的分子标志物及潜在靶点。
2.3 MiRcroNAs与MTC 来源于甲状腺滤泡旁细胞的甲状腺髓样癌(medullary thyroid carcinoma,MTC)是恶性程度较高的一种甲状腺癌,其发病率占全部甲状腺癌的5%~8%[27]。在治疗方面,由于其对放射线和化学疗法不敏感,目前手术被认为是甲状腺髓样癌主要的治疗方法。并且由于甲状腺髓样癌恶性程度高,术后5~10年的生存率较低[28]。目前针对甲状腺髓样癌分子发病机制的研究尚少,有研究表明,miRNA在甲状腺髓样癌中存在异常表达,见表3。

表3 miRNA在甲状腺髓样癌中的表达情况
研究发现,miR-376c-3p在甲状腺髓样癌中表达下调[31]。白宁[32]发现miR-376-3p参与了甲状腺髓样癌癌细胞的增殖、迁移以及侵袭过程,并且发现miR-376-3p可通过调节下游靶基因HBEGF,参与甲状腺髓样癌的发生发展。ROMEO等[33]发现miR-375在甲状腺髓样癌患者的血浆及组织标本中的表达显著高于健康受试者及MTC缓解期的患者,并提出miR-375有望成为甲状腺髓样癌预后不良的一个指标。YE等[34]根据之前的研究发现miR-149在不同的肿瘤类型中对肿瘤起到抑制或促进的作用,他们分析了miR-149-5p在甲状腺髓样癌中的表达情况,发现miR-149-5p在MTC中表达下调,并发现上调miR-149-5p的表达水平,可以直接靶向抑制GIT1,从而使甲状腺髓样癌细胞的增殖和侵袭等生物学行为得到抑制。
编码受体酪氨酸激酶RET的基因是在三十多年前首次发现的,此后激活RET重排和突变被确定为是致癌作用的驱动因子[35]。研究证明,RET突变参与了甲状腺髓样癌的发生发展,且相较于散发型MTC,遗传性MTC的RET突变发生率更高[36]。而在甲状腺髓样癌细胞中,miRNA也呈现出了差异性表达。在此基础上,DUAN等[37]推测RET基因可能受到miRNA的调控而影响癌细胞的增殖、分化等生物学进程。在实验中,DUAN等[37]发现了miR-129-5p可与RET的mRNA 3'UTR相结合,使甲状腺髓样癌中的RET表达受到抑制,从而参与了甲状腺髓样癌的发生发展,提示了RET是miRNA-129-5p的直接靶基因。ELISABETTA等[38]在探讨miR-224在散发型甲状腺髓样癌中的表达及突变关系的研究中发现,在miR-224表达下调的甲状腺髓样癌患者中,他们的总体生存期并不长,而且他们发现miR-224的表达与RAS突变呈现正相关,可作为散发型甲状腺髓样癌患者一个独立的预后指标。由于甲状腺髓样癌恶性程度高,预后往往不如人意。这些研究发现,有助于更加深刻的了解甲状腺髓样癌的分子发病机制,为甲状腺髓样癌的临床靶向治疗提供新的思路,给患者带来新的希望。
2.4 MiRcroNAs与ATC 未分化型甲状腺癌又称为间变性癌或肉瘤性癌(anaplastic thyroid cancer,ATC),由于其恶性程度高,在对间变性甲状腺癌的治疗当中,手术、放化疗及药物治疗等多种治疗手段的效果均不理想,目前尚没有一种效果显著的治疗方案。因此,亟待通过寻找有效的分子靶向药物来解决目前的疾病现状。研究表明,miRNA在间变性甲状腺癌中存在着差异性表达,见表4。

表4 miRNA在间变性甲状腺癌中的表达情况
研究表明,miRNAs参与了间变性甲状腺癌的发生发展。ZHANG等[42]发现miR-155在间变性甲状腺癌中表达上调,并分析了miR-155与间变性甲状腺癌组织的临床病理特征的相关性,数据显示,miR-155的过表达与间变性甲状腺癌的腺外浸润相关。此外,ZHANG等[42]通过双荧光霉素分析得出SOCS1为miR-155的直接靶点,并发现miR-155对SOCS1有负向调节的作用,进一步提示了miR-155的过表达可能参与了间变性甲状腺癌的发生发展,有望成为间变性甲状腺癌临床治疗的潜在靶点。LIU等[43]发现在间变性甲状腺癌中miR-144表达下调,并且发现miR-144的潜在靶点为TGF-α,且miR-144可负向调控TGF-α,参与了间变性甲状腺癌细胞的多种生物学进程。BI等[44]发现miR-599在间变性甲状腺癌中呈现高表达的状态,并且对KAT-18细胞增殖、迁移的生物进程起到了抑制的作用,从而诱导了该细胞的凋亡。并且BI等[44]还发现TIA1有可能是miR-599的直接靶点,miR-599通过对TIA1进行激活对间变性甲状腺癌的发生发展起到抑制作用。MARIA等[45]对miR-650在间变性甲状腺癌中的靶点进行相关性研究,发现miR-650的直接靶点为PPP2CA,并对二者进行了相关性评价,发现在间变性甲状腺癌中,miR-650对PPP2CA起到负向调控的作用,并且影响了间变性甲状腺癌的细胞活性,进一步说明,miR-650对于间变性甲状腺癌细胞的运动能力有调控作用。
3 MiRNAs在甲状腺癌中的临床应用
随着甲状腺癌发病率的不断上升,甲状腺癌的早期诊断方法也吸引了许多研究者的目光。在美国甲状腺协会(ATA)上,超声引导下细针穿刺(FNA)被推荐为甲状腺癌早期诊断中A级检查手段,而其微创、快捷、准确在临床应用中也得到了广泛的证实,并且相较于超声及螺旋CT而言,FNA的应用大大的提高了甲状腺癌诊断的准确性,减少了许多不必要的诊断性手术。当然FNA也具有一定的局限性,如对于结节的大小要求过高等。MiRNAs在甲状腺癌中的差异性表达为甲状腺癌的早期临床诊断提供了新的思路。NOUSHIN等[46]对miR-144、miR-34a在甲状腺髓样癌的表达情况进行了研究,他们检测了30例甲状腺髓样癌组织及30例正常甲状腺组织中的miR-34a及miR-144的表达情况,发现相较于正常甲状腺组织,二者在甲状腺髓样癌癌组织中呈现出同步性表达上调。并且两者ROC曲线分析表明,miR-34的最佳截止点为2.3,约登指数为0.69,灵敏度为0.89,特异性为0.8,计算得出的 AUC 为 0.95(95%CI=0.0~1.0)(P=0.001);miR-144的AUC值为0.95,最佳截止值为2.0,它的约登指数、灵敏度及特异性分别为0.73、0.93和0.8(95%CI=0.0~1.0)(P=0.001),提示二者在甲状腺髓样癌中早期临床诊断有指导意义。治疗方面,在间变性甲状腺癌靶向治疗中,顺铂作为广谱抗癌药物目前已应用在间变性甲状腺癌患者当中。LIU等[43]发现可以通过上调miR-144的表达,从而反向抑制TGF-α,增加间变性甲状腺癌患者对顺铂的敏感性,从而使应用顺铂的间变性甲状腺癌患者获得更好的治疗效果。
4 展望
甲状腺癌的发病率逐年上升,它分化程度一般,恶性程度低,大多数甲状腺癌患者可经手术或放化疗进行治疗。但它仍然存在一部分肿瘤患者经过手术治疗或放化疗治疗后出现预后状态不理想的情况,一定程度上会发生复发及癌细胞远处转移的可能。因此甲状腺癌的初期诊断及临床治疗愈来愈得到人们的关注。MiRNAs作为目前临床研究较多的分子标志物,在甲状腺癌的各组织分类中存在着异常表达的情况。根据大量研究表明,miRNAs参与了甲状腺癌细胞的增殖、迁移及侵袭等生物进程,这些研究结论都使得miRNAs有望成为各种不同病理组织类型的甲状腺癌早期诊断的标准及临床治疗的潜在靶点。但目前对于miRNAs在甲状腺癌中的发生机制的相关研究数量较少,许多疾病的发生机制尚不明确,仍需大量的实验给予理论支持。

