钛颗粒诱导骨溶解的不同动物模型形态学研究
张 晨 刘子歌 宋国瑞 李 燕 陈德胜 程萌旗
(1. 宁夏医科大学临床医学院,银川 750004;2. 宁夏医科大学基础医学院,银川 750004; 3. 宁夏医科大学总医院骨科,银川 750004; 4. 上海交通大学附属第六人民医院关节外科,上海 200011)
人工关节置换术是现阶段治疗终末期骨性关节炎的重要方法,它不仅能有效缓解关节疼痛,还能重建关节功能。随着中国老龄化人口正以比总人口增长更快的速度增加,中国人工关节置换术也呈递增趋势。仅2018年,国内共完成近70万人工关节置换术[1]。人工关节置换术后的假体无菌性松动是此类手术主要的并发症之一,松动失效的人工关节需要行翻修手术治疗,给患者带来巨大的痛苦和经济压力[2]。现阶段,假体无菌性松动的机制未知,而研究[3-4]显示假体磨损产生的磨损颗粒会诱导慢性炎性反应,促进假体周围骨吸收及假体无菌性松动。考虑到临床现状及医学伦理学限制,研究人员难以获得早期假体松动标本,因此,制作能够真实模拟假体松动周围病理生理环境的动物模型对研究其病理机制至关重要。本研究用钛颗粒诱导3种动物模型,模拟不同的假体松动病理生理环境。
1 材料与方法
1.1 实验动物与分组
选用在宁夏医科大学实验动物中心SPF级动物房饲养的近交系雌性BALB/c小鼠共55只,鼠龄8~10周,体质量(22.6±3.4) g,健康状况良好,实验动物许可证号:SCXK(京)2016-0008。小鼠适应性饲养1周后进行实验,5只/笼。将45只小鼠采用数字表法随机分为颅骨模型组(A组)、气囊模型组(B组)及气囊植骨模型组(C组),每组各15只,另外10只作为气囊植骨模型组颅骨骨片供体。本实验获得宁夏医科大学实验动物管理和使用委员会审批通过。
1.2 钛颗粒准备
钛颗粒购自美国Alfa Aesar公司(Ward Hill, MA),选用商品化纯钛颗粒,颗粒直径<20 μm。实验前钛颗粒进行去除内毒素测试和内毒素处理,内毒素检测试剂盒购自上海润成生物科技有限公司。去内毒素处理后钛颗粒浸泡于100%(体积分数)无水乙醇,之后将钛颗粒与无水乙醇混合液置于离心管离心出钛颗粒;去除漂浮在上层的无水乙醇,加入磷酸盐缓冲盐水(phosphate buffer saline, PBS)液洗涤3遍,最后加入无菌PBS液,将钛颗粒制成浓度为300 g/L的颗粒悬液。
1.3 试剂与仪器
苏木精-伊红(HE)染色、乙醇、PBS 液购自银川润研生物技术有限公司;光镜采用日本Olympus DP70电子显微镜系统进行拍摄,离心加速机购自Sal-feadent公司;真空烘箱、石蜡包埋机、石蜡切片购自日本Olympus公司;透射电子显微镜采用的是日本Hitachi Kyoto透射电子显微镜(型号Hitachi H-7650)下观察。
1.4 实验方法
1.4.1 动物模型的建立
(1)钛颗粒刺激颅骨骨溶解模型组(A组):用4%(质量分数)水合氯醛,按照0.11 mL/kg对小鼠进行腹腔麻醉,麻醉成功后对小鼠头部充分脱毛、碘伏消毒、铺无菌巾,沿小鼠颅顶矢状线(小鼠外耳道连线中点的垂线)将小鼠顶部皮肤切开1.0~1.5 cm,充分暴露小鼠颅顶1 cm2范围骨膜,用小镊子或小刀分离颅骨外膜,在外膜下注射0.3 mL钛颗粒悬液,并使其均匀分布于骨膜表面(图1A)。无菌线缝合伤口,术后常规给予青霉素抗炎2 d,预防感染。
(2)钛颗粒刺激气囊模型组(B组):第1天,4%(质量分数)水合氯醛腹腔注射麻醉后,小鼠背部剃毛备皮、消毒、无菌铺单,无菌注射器在背部正中注射2 mL 无菌空气,形成气囊。第2天,在同一部位向气囊中注射1 mL 无菌空气,第3、4、5、6天,连续向气囊中注射0.5 mL无菌空气,维持气囊中存气量。1周后小鼠背部注射部位无红肿、硬结、渗出及炎性水肿等反应,气囊建立。第8天在无菌操作下将0.3 mL钛颗粒悬液注射进小鼠背部气囊(图1B),术后常规给予青霉素抗炎2 d,预防感染。
(3)钛颗粒刺激气囊植骨模型组(C组):将颅骨供体的10只小鼠麻醉后脱颈处死,取出约0.5 cm2颅骨骨片,剔除周围多余软组织后从中一分为二。15只小鼠气囊建立成功后,4%(质量分数)水合氯醛腹腔注射麻醉,背部消毒、铺巾,将已形成的气囊切开,向内植入一块颅骨组织,并在颅骨周围注射0.3 mL钛颗粒悬液(图1C)。无菌线缝合伤口,术后常规给与青霉素2 d,预防感染。
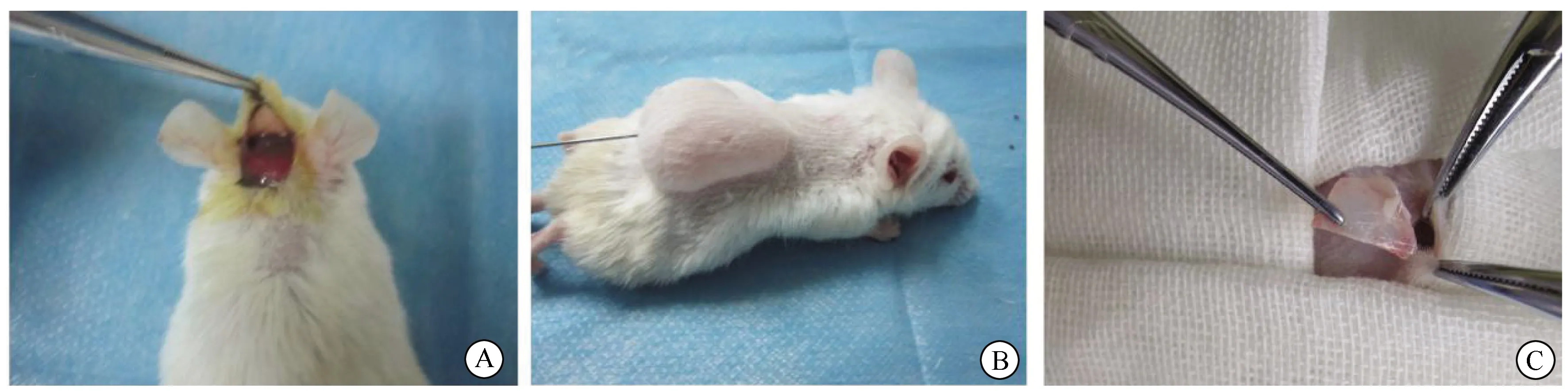
图1 3组钛颗粒诱导模型建模过程Fig.1 Modeling process of three groups of titanium particles induced modelA: Titanium particles stimulate skull osteolysis model; B: Titanium particles stimulate balloon model group;C: Titanium particles stimulate balloon model of bone graft.
1.4.2 标本采集及处理
建模完成14 d后,小鼠麻醉后脱颈处死,分别取出颅骨模型组的颅骨骨片、气囊模型组的囊壁组织及气囊植骨组的颅骨骨片和囊壁组织,分为两份。一份标本用PBS缓冲液体冲洗,浸泡固定于0.1 mol/L中性多聚甲醛24 h。A组与B组将骨片组织置于10%(体积分数)EDTA脱钙液2~3周,每隔4 d需要更换一次脱钙液,待针刺组织无明显阻力感时取出。骨片及囊壁组织采用不同乙醇梯度按顺序进行脱水处理,并且予二甲苯透明处理,浸泡于液体石蜡中,待石蜡凝固包埋后连续6 μm厚度切片,捞片到载玻片中,烤片后待用。一份标本保存在预冷的PBS缓冲液中,以供扫描电镜观察。
1.4.3 苏木精-伊红(HE)染色
将切片置于37 ℃恒温箱中过夜,后分别经过二甲苯Ⅰ、二甲苯Ⅱ各20 min,70%、80%、90%、95%(体积分数)乙醇各5 min,超纯水5 min脱蜡入水。随后苏木精染色2.5 min,超纯水冲洗干净,然后在1%(体积分数)盐酸乙醇中分化3 s后自来水冲洗干净,ddH2O中反蓝20 min,伊红染色3~5 s,风干后用中性树脂封固, 显微镜下观察。
1.4.4 透射电子显微镜
将PBS中的标本经0.9%(质量分数)氯化钠注射液(以下简称生理盐水)冲洗3遍后,置于4%(体积分数)戊二醛固定2 h,再用0.1 mmol/L二甲砷酸钠缓冲液冲洗3次,固定过夜,生理盐水冲洗3遍,2%(体积分数)锇酸固定2 h以上,依次用乙醇、叔丁醇逐级脱水,各15 min。后在4 ℃环境放置24 h以上,放入液氮冷冻,干燥后镀金,扫描电子显微镜下观察,每个标本截取5个不同视野,应用Image Pro Plus 6.0图像分析软件对图像中骨吸收面积进行统计计算。
1.5 统计学方法
2 结果
2.1 大体观察结果
A组可见颅骨表面有钛颗粒浸润,颅骨骨面不光整,部分骨面有侵蚀缺损。B组气囊组织中有钛颗粒浸润,色灰暗,气囊囊壁增厚,有炎性水肿,表面较光滑,质地脆,易剥离。C组可见植骨颅骨块与周围的气囊组织之间有单核细胞及淋巴细胞等浸润,有钛颗粒包裹,且炎性反应明显,并伴有新生血管增生(图2)。
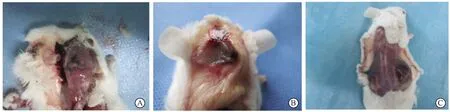
图2 三组钛颗粒诱导模型取材过程Fig.2 Material extraction process of three groups of titanium particles induction modelA: Titanium particles stimulate skull osteolysis model; B: Titanium particles stimulate balloon model group; C: Titanium particles stimulate balloon model of bone graft.
2.2 HE染色结果
A组可见颅骨表面钛颗粒周围有部分炎性反应,少许团簇状巨噬细胞及淋巴细胞等炎性细胞浸润,骨溶解较少,骨面欠平整(图3A)。在B组可见气囊囊壁厚,囊壁内有多种巨噬细胞、淋巴细胞等炎性细胞浸润,周围炎性反应显著,成纤维细胞少见,气囊壁组织可有钛颗粒聚集,并由巨噬细胞浸润包绕而结节样增生,夹杂着成纤维细胞和毛细血管组织(图3B)。C组可见钛颗粒周围有大量炎性细胞浸润及纤维结缔组织增生,引起颅骨骨片表面广泛骨溶解发生,骨面有塌陷(图3C)。
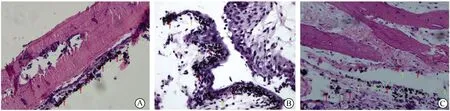
图3 三组钛颗粒诱导模型Fig.3 HE staining results of three groups of titanium particles induced modelA: Titanium particles stimulate skull osteolysis model(HE staining,20×). Red arrows are labeled titanium particles, green arrows are labeled inflammatory cells; B: Titanium particles stimulate balloon model group(HE staining,40×); C: Titanium particles stimulate balloon model of bone graft (HE staining,20×).
2.3 透射电子显微镜结果
A组可见破骨细胞胞质内见到钛颗粒,细胞周围基质可见胶原蛋白及骨样基质等,钛颗粒下有部分片状骨溶解,数量较少,大小不一。B组可见细胞胞质内有钛颗粒浸润,巨噬细胞变形,呈皱缩状,细胞核固缩、核碎裂及核仁消失,细胞内可见大量大小不等的空泡,周围的细胞外散在有基质组织,基质组织中含水量减少。C组小鼠颅骨骨面缺失,残缺的骨面下可见有大片骨溶解,骨片周围有增生的破骨细胞,在其周围散落着部分活跃的破骨细胞前体细胞,细胞外基质含有大量骨样基质,细胞胞质可见大小不等的团簇状钛颗粒及完整的高尔基体(图4)。用IPP软件分析图像,A组骨溶解面积为(190.67±26.33)nm2,C组骨溶解面积为(228.67±30.06)nm2,两组比较,差异有统计学意义(t=3.217,P<0.05)。
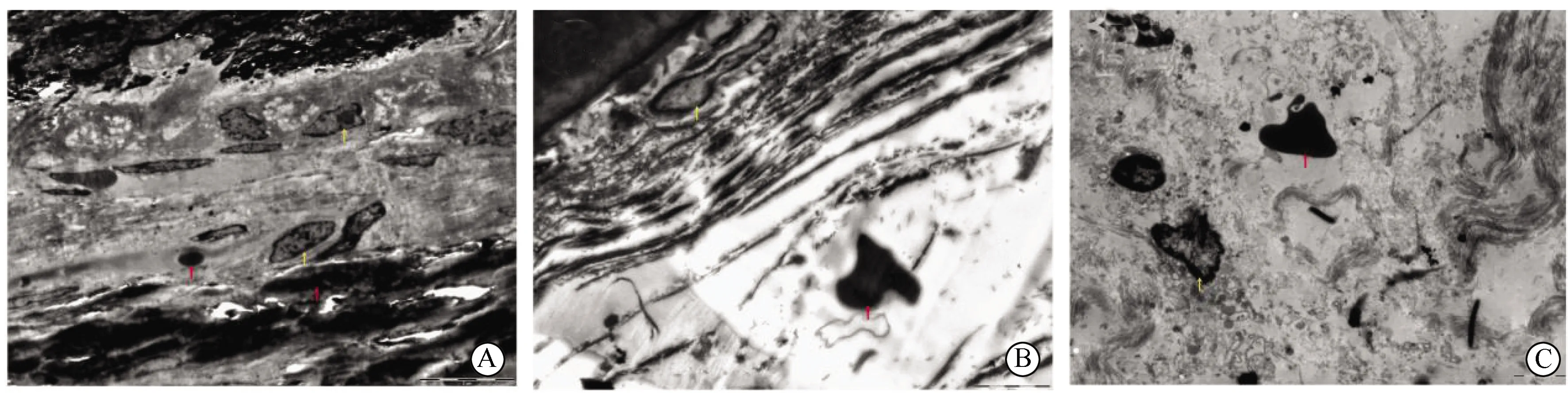
图4 3组钛颗粒诱导模型扫描电子显微镜结果(5 000×)Fig.4 Scanning electron microscope results of three groups of titanium particles induced modelA: Titanium particles stimulate skull osteolysis model; B: Titanium particles stimulate balloon mode group; C: Titanium particles stimulate balloon model of bone graft. Red arrows are labeled titanium particles, yellow arrows are labeled osteolysis areas.
3 讨论
随着人工假体置换术发展,假体的材料有很多,最常见的是以钛为原料的金属类假体,不但耐磨耐腐蚀,而且容易与人的自体骨相适应,但长期的磨损造成的磨损颗粒是导致人工假体松动的重要原因之一[5]。磨损颗粒在人体内到底会引起什么样的病理生理变化,目前为止并没有一个确切的答案,由于人体标本取材困难,建立相应的动物模型成为研究此类问题的关键。1996年Allen等[6]就开始在大鼠体内植入特制人工假体建立了骨溶解动物模型,证实假体会与周围的骨组织发生炎性反应,出现了异形细胞。
近年来越来越多的实验[7-8]选用小鼠制作骨溶解动物模型,采用小鼠作为实验动物的优势在于能近似准确地模仿无菌性松动引起的人工假体周围骨溶解的病理反应过程,简便、快捷地对破骨细胞进行相应的检测;更易于研究无菌性松动中破骨细胞增生、成熟、分化;实验方法简单,操作步骤简化。更重要的是,研究[9]显示,小鼠模型的背部气囊组织中囊壁组织的细胞组成与人体内滑膜等软组织类似,为建立真实的人工关节术后模型提供了理论依据。本实验选用的纯钛颗粒作为磨损颗粒,主要由于纯钛颗粒在纯度和颗粒大小都能符合实验用条件[10]。此外,颗粒需要通过内毒素检测方可用于实验,纯钛颗粒在这方面的实验要求条件已经成熟。合金颗粒由多种金属材料构成,组成比较复杂,颗粒大小及纯度不容易掌控,对于内毒素的内毒素检测比较困难,单因素控制难以实现[11]。
钛颗粒刺激小鼠颅骨骨溶解的动物模型是将钛颗放置于颅骨骨膜缺损区,与骨膜紧密接触,出现的骨溶解病理环境,可以更好地模拟假体周围无菌性松动骨组织的病理改变,是一种急性溶骨性病理模型范畴,能快速简介建立的一种无菌性松动动物模型[12]。与气囊植骨组相比,骨溶解面积小,且在骨溶解区域外可见破骨细胞,细胞基质有散在的胶原蛋白和骨样基质,可能是由于有骨重建过程的参与,在钛颗粒刺激的炎性刺激下,骨髓间充质干细胞会向成骨细胞及软骨细胞分化[13]。钛颗粒刺激颅骨模型中,诱导的骨组织有神经、营养和血供支持,可以比较真实地还原磨损颗粒在体内关节腔诱导骨溶解的病理生理环境,可以反映出骨重建过程中成骨细胞的成骨作用与破骨细胞的溶骨反应的动态平衡[14]。而且此实验模型的构建可以有利于缩短实验周期。然而,其缺点为磨损颗粒在骨膜外,多引起皮下组织较强的炎性反应,而溶骨时间短,且在皮下组织缺乏关节内环境中相应的组织诸如滑膜组织及其相应的分泌功能[15]。
气囊模型是在实验动物皮下注射无菌空气,在实验动物背部形成稳定的气囊组织后,气囊内部的纤维结缔组织不断成熟,囊壁细胞和囊腔内部基本渗液的有效成分与人关节的滑膜组织相比,具有明显的相似性[16]。本实验通过构建小鼠气囊的动物模型基础上,选用钛颗粒作为磨损颗粒注入气囊内,直接刺激气囊囊腔出现无菌性炎性反应,用以模拟假体松动病理过程中磨损颗粒对关节周围软组织的直接刺激,这也是本实验创新之处。通过大体观察,模型组小鼠的气囊囊壁存在明显的炎性反应,并伴有新生血管增生,在组织病理学观察中,气囊囊壁在钛颗粒的直接刺激下,有巨噬细胞增生、变性及淋巴细胞浸润,炎性反应明显,部分囊壁细胞核固缩、裂解,细胞基质中含水量减少,此病理变化和人工关节无菌性松动的翻修手术中所取滑膜组织炎性反应病理过程具有明显的相似性,Park等[17]研究显示,膝关节假体周围的软组织弹性减弱、胶原纤维的炎性变是导致假体松动的重要因素之一。通过气囊模型与气囊植骨组的对比,可以观察到骨溶解的发生对囊壁的炎性反应的影响,以模拟人工关节置换术后骨溶解的发生对关节周围滑膜的影响[18]。
钛颗粒刺激气囊植骨模型组是在气囊建立的前提下,在气囊内植入骨片及钛颗粒悬液,以观察气囊内出现一系列溶骨病理改变,是一种慢性溶骨性病理模型[19],最大程度还原了关节内磨损颗粒对骨溶解及滑膜炎产生影响的病理生理环境。本组模型大体观察可见植入骨块与囊壁组织之间的炎性反应明显,周围组织红肿、渗出并伴有血管增生,组织病理学结果可见在颅骨骨块表面骨吸收现象明显,骨块周围有增生活跃的破骨细胞,超微结构下可观察到团状钛颗粒周围部分破骨细胞胞质内高尔基体丰富,这些改变与临床上人工关节翻修手术中的所取的关节滑膜标本组织的炎性表现类似[20],验证了气囊植骨模型中既能保留气囊囊壁对刺激颗粒的敏感性,又可以模拟人工关节术后晚期颗粒诱导的骨溶解反应的病理过程[21]。但此模型中的骨组织由于缺少血供、神经营养支持,不能将骨溶解中骨组织的自体修复体现出来,不能还原破骨细胞溶骨及成骨细胞修复的动态平衡[22],这一点在研究讨论时还需与颅骨诱导模型的骨溶解病理过程相结合。
综上所述,3种钛颗粒刺激下的小鼠骨溶解动物模型各有利弊,可以反映不同情况下假体周围骨溶解的病理变化,同时建立不同的动物模型可以各取所长,更有利于探讨人工关节无菌性松动不同阶段的病理进程。这3种动物模型中,气囊植骨模型组不仅能模拟出磨损颗粒刺激产生的界膜组织,也能模拟磨损颗粒诱导的骨溶解反应,在磨损颗粒诱导的骨溶解病理过程中模拟度更高。

