生产设备对苦参膜指纹图谱及指标成分的影响*
郑立肯,叶世芸,殷少文,王维
(1.贵州中医药大学药学院,贵阳 550002;2.贵阳市第三人民医院科教科,贵阳 550006)
苦参类生物碱(Matrine-typealkaloids)常由豆科槐属(Sophor)植物苦豆子(SophoraalopecuroidesL.)、苦参(Sophoraflavescens)、山豆根(EuchrestaJ.Benn)的干燥根、植株、果实经有机溶剂提取制得[1]。目前已提取得到苦参类生物碱中苦参碱、氧化苦参碱、槐果碱、槐定碱、氧化槐定碱和槐胺碱等,进行过较多的生物活性研究[2],其具有抗菌、抗炎、抗病毒及真菌作用,且对机体免疫功能具有双向调节作用[3-7]。苦参膜是原国家食品药品监督管理局于2009年批准以苦参总碱为原料的妇科膜剂,由药效物质群苦参总碱与水溶性辅料聚乙烯醇(polyvinyl alcohol,PVA)制成。功能主治抗菌消炎,常用于宫颈柱状上皮异位,赤白带下,滴虫性阴道炎及阴道真菌性感染等妇科疾病。苦参膜质柔软,体积小,使用时无异物感,制剂与正常阴道腔内弱酸性pH值相似,减少对女性阴道腔的刺激,抑菌同时不破坏阴道正常菌群,使患者在治疗过程中感受更舒适。苦参膜药效物质明确,作用可靠,因其膜类制剂可作为其他药物载体的优势,临床常将苦参膜与其他药物或与妇科手术联合治疗女性生殖道疾病,较单独用药有效率更高,1年内复发率显著降低[8-12]。
苦参膜生产需求日益增长,为扩大生产,对现有苦参膜生产工艺进行规模化,在不改变膜制备原理的前提下,对原手动设备进行自动化升级改造,筛选出一套高效节能生产中药膜剂的关键技术及设备,解决目前中药膜剂设备自动化、规模化的难题。将原料的搅拌配料改造设计为真空乳化配料,手动水浴成膜改造为连续涂布成膜,手动刀切分膜改造为贴合分条机分切,手工包装改造为四边封自动包装机包装。但这一过程是否会引起药品质量的变化尚未有研究,且目前质量标准只对苦参膜中氧化苦参碱和苦参碱进行含量测定,忽略药效物质槐果碱与槐定碱含量变化,不能全面反映苦参膜质量是否稳定。由于产品质量的稳定性、均一性是保证药品疗效稳定的前提,因此本实验建立可检测苦参膜中苦参总碱多成分含量的高效液相色谱(HPLC)法苦参膜指纹图谱方法,旨在为苦参膜的质量控制提供参考。
1 仪器与试药
1.1仪器 Agilent1260 高效液相色谱仪(美国Agilent公司);XS205电子天平(瑞士METTLER公司,感量:0.01 mg);JP2-160电子天平(日本CHYOBANCE公司,感量:0.1 mg);Welch Ultimate XB-NH2色谱柱(4.6 mm×250 mm,5 μm),上海Welch公司;YQ-1000A超声清洗仪(上海易净超声波仪器有限公司)。
1.2试剂与药品 氧化苦参碱对照品(批号:170428,C15H24N2O2含量≥98%),苦参碱对照品(批号:170512,C15H24N2O含量≥98%),槐果碱对照品(批号:161113,C15H22N2O含量≥98%),槐定碱对照品(批号:170425,含量≥98%),均购于北京世纪奥科生物技术有限公司;三氯甲烷(分析纯,上海试剂四赫维化工有限公司);乙腈(色谱纯)、无水乙醇(分析纯)、氨水(分析纯)、无水乙醇(分析纯),均购于天津市科密欧化学试剂有限公司;磷酸(分析纯,成都市科龙化工试剂厂);娃哈哈纯净水(娃哈哈饮料有限公司);30批生产工艺设备变更前后产苦参膜批号见表1,均由贵州得轩堂护康药业股份有限公司提供。
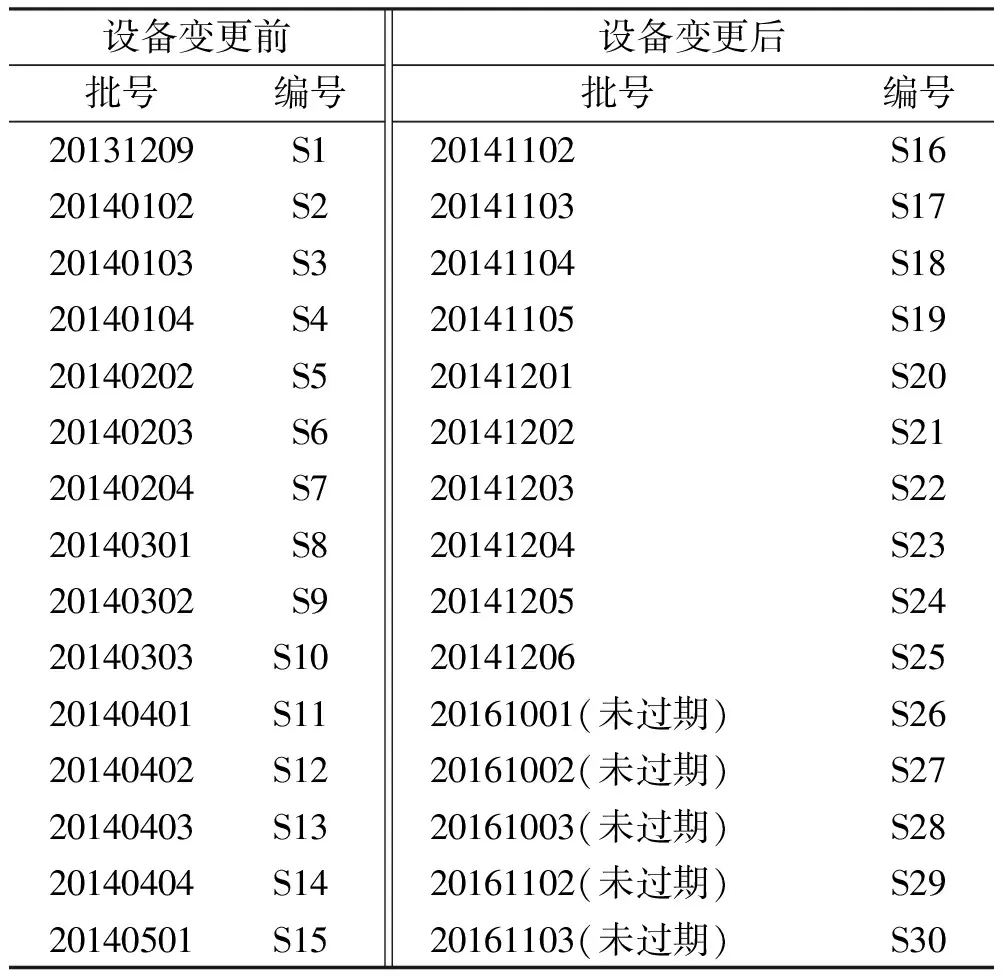
表1 生产工艺设备变更前后苦参膜批号
2 方法与结果
2.1色谱条件 色谱柱 Ultimate XB-NH2柱(4.6 mm×250 mm,5 μm),流动相为乙腈-无水乙醇-3%磷酸(85:7.5:7.5),柱温35 ℃,流速1 mL·min-1,检测波长220 nm,进样量10 μL,理论板数以氧化苦参碱计不得小于3000,4个成分与其他组分之间的分离度均>1.5。
2.2溶液的制备
2.2.1混合对照品溶液制备 取氧化苦参碱、苦参碱、槐定碱、槐果碱对照品适量,精密称定,用乙腈-无水乙醇(85:15)溶解定容。制得含氧化苦参碱3.98 mg·mL-1、苦参碱3.77 mg·mL-1、槐果碱3.61 mg·mL-1、槐定碱3.74 mg·mL-1的混合对照品溶液,摇匀,即得。可根据实验需求稀释至各不同浓度。
2.2.2供试品溶液制备 取同一批次苦参膜6片,剪碎并混合均匀。精密称定0.6 g,置具塞锥形瓶中,精密加入氨水0.5 mL与三氯甲烷25 mL,称定质量,超声提取40 min,放置至室温,三氯甲烷补足损失质量,摇匀,滤过,取续滤液,精密吸取5 mL,挥干溶剂,使用流动相溶解并移至25 mL量瓶中定容,摇匀,用孔径0.45 μm滤膜滤过,备用。
2.3精密度实验 取批号20161002苦参膜样品,按照“2.2.2”项下方法制备供试品溶液,按照“2.1”项色谱条件测定,连续进样 6次,以2号峰(苦参碱)与4号峰(氧化苦参碱)的保留时间和色谱峰面积为参照,计算各共有峰的相对保留时间和相对峰面积。各峰保留时间与峰面积RSD均<3.0%,表明该方法精密度良好。
2.4稳定性实验 取“2.3”项下同一供试品溶液,按照“2.1”项色谱条件,分别在 0,2,4,8,16,20,24 h 时测定,记录指纹图谱,以2号峰(苦参碱)与4号峰(氧化苦参碱)的保留时间和色谱峰面积为参照,计算各共有峰相对保留时间和相对峰面积。各峰保留时间与峰面积 RSD均<3.0%,表明苦参膜样品在24 h内稳定。
2.5重复性实验 取同一批次苦参膜样品6份,按照“2.2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件测定,以2号峰(苦参碱)与4号峰(氧化苦参碱)的保留时间和色谱峰面积为参照,计算各共有峰的相对保留时间和相对峰面积。各峰保留时间与峰面积 RSD均<3.0%,结果表明该方法重复性良好。
2.6指纹图谱的建立
2.6.130批生产设备变更前后苦参膜指纹图谱的建立及相似度评价 取30批生产设备变更前后苦参膜,分别按“2.2.2”项方法制备供试品溶液,按“2.1”项色谱条件测定,得到30批苦参膜指纹图谱(图1),将得到的数据导入《中药色谱指纹图谱相似度评价系统》2012 A版进行分析,以S2为参照指纹图谱,采用多点校正后进行自动匹配,生成对照指纹图谱,并对色谱峰进行指认。将30批苦参膜供试品色谱图与对照指纹图谱匹配,进行相似度评价,得到30批生产设备变更前后苦参膜指纹图谱相似度在0.851~0.996,结果见表2。
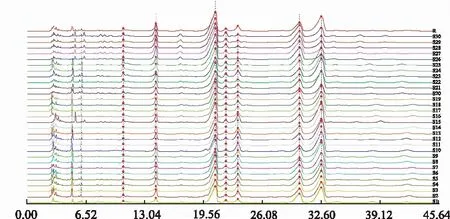
图1 30批苦参膜HPLC指纹图谱
2.6.230批苦参膜共有峰的标定及指认 30批生产设备变更前后苦参膜共标定8个共有峰,设S2(20140102)为参照图谱,采用多点校正后进行自动匹配,生成对照指纹图谱,并对色谱峰进行指认。其中3,4,7,8号峰分别与槐果碱,苦参碱,槐定碱,氧化苦参碱对照品保留时间一致,见图2。

表2 30批苦参膜相似度评价结果

A.混合对照品;B.对照指纹图谱;C.空白溶剂;3.槐果碱;4.苦参碱;7.槐定碱;8.氧化苦参碱。
2.730批生产设备变更前后苦参膜指纹图谱聚类分析 以10批样品21个共有峰的相对峰面积为原始数据,采用SPSS 22.0版软件,以系统聚类法结合欧氏距离(d)为测度进行分析,结果见图3。由图3可知,d=25时,30批样品可聚为2类,S26、S27、S28、S29、S30首先聚为一类,其余聚为一类;d=20时,后一类又可聚为2类,即S23、S24、S25聚为一类,其余聚为一类。
2.830批生产设备变更前后苦参膜指纹图谱主成分因子分析 采用SPSS 22.0版软件对30批生产设备变更前后苦参膜的8个共有峰(变量)峰面积原始数据进行标准化处理,以主成分的特征值及贡献率为依据,进行主成分因子分析,计算相关系数矩阵,主成分特征值、累积贡献率并计算主成分综合得分,对30批生产设备变更前后苦参膜品质进行评价。通过先验检验得KMO值=0.621>0.6,Bartlett的球形检验P<0.05,证明数据存在关联性,可进行因子分析。根据因子分析结果可得总方差解释表,对各变量进行因子提取和因子旋转的结果,结果见表3,碎石图见图4。
结合图4,苦参膜主成分分析中前2个主成分的特征值较大(均>1) 且连线较陡峭,累积方差贡献率82.125%(>60%),认定提取前2个主成分进行分析较为合适,前2个主成分累计方差贡献率为82.125%,前2个主成分可以反映整体指标82.125%的信息。其中提取主成分1的特征值为4.169,其贡献率为52.113%;提取主成分2的特征值为2.401,贡献率为30.012% 。
每个样本都是由数个变量属性特征构成,这些属性特征之间的关系,可以利用载荷图来对图像特征进行描述,载荷的绝对值越大,对于主成分的影响就越大,而这种影响可以通过载荷所代表的点到原点之间的距离来衡量,见图5。
进行正交旋转,得到30批生产设备变更前后苦参膜各指标在2个主成分中的旋转成分矩阵,见表4。第一主成分中的信息主要来自色谱峰3,4,6,7,8。其中3号峰为槐果碱,4号共有峰为苦参碱,7号共有峰为槐定碱,8号峰为氧化苦参碱,6号峰为未知峰。根据表4,5,以 Y1,Y2 代表2个主成分作为30批生产设备变更前后苦参膜成分所表达的信息,建立苦参膜品质的评价模型,得出如下成分的线性关系表达式分别为Y1=-0.147F1-0.019F2+0.251F3+0.184F4+0.026F5-0.207F6+0.2F7-0.230F8,Y2=0.397F1+0.379F2-0.147F3+0.117F4+0.307F5+0.017F6+0.067F7+0.084F8。表达式中各变量不是原始变量,而是标准化变量。
将上述所得表达式,与所对应的2个主成分的方差贡献率做内积,得到苦参膜质量综合评价函数的表达式为Y综合得分=(Y1×4.462 +Y2×2.108)÷82.125,根据以上表达式得到30批生产设备变更前后苦参膜得分值及排序,见表5。综合得分越高表明对苦参膜样品中有效成分的统计质量越好[13-14]。
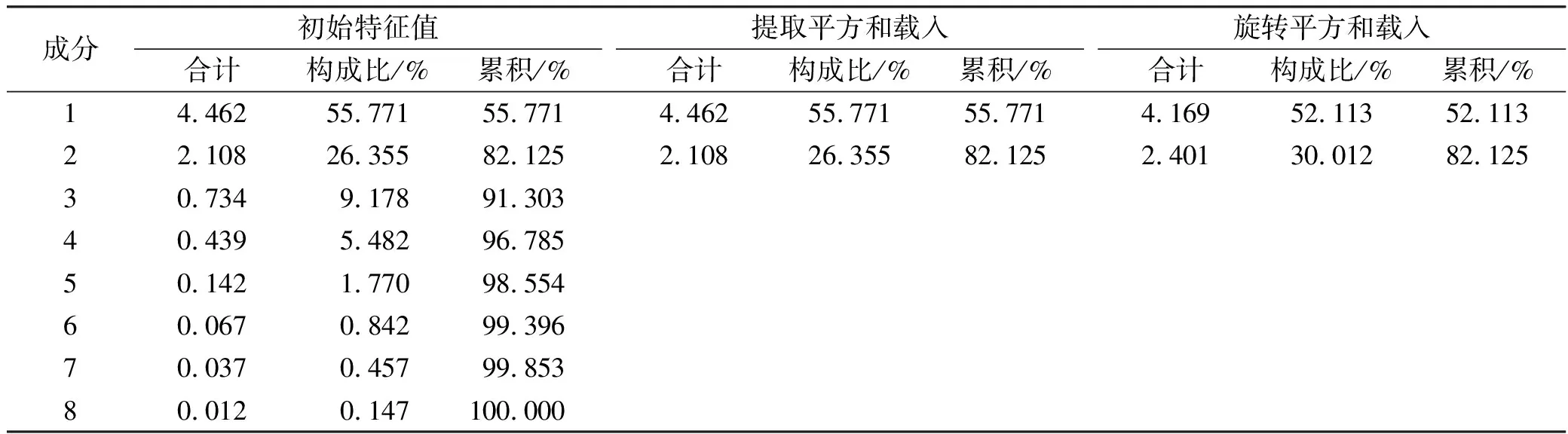
表3 两个主成分因子的特征值和方差贡献率
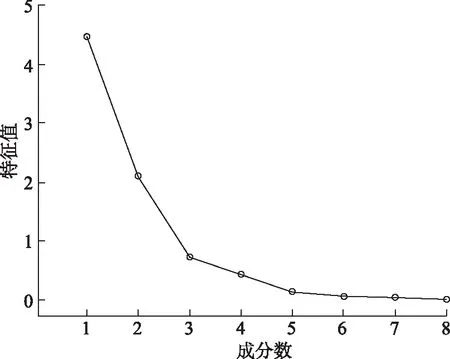
图4 主成分因子碎石图
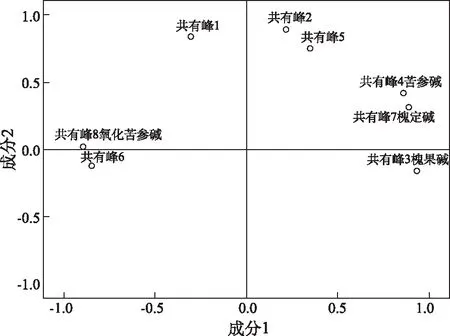
图5 共有峰指纹谱载荷

表4 旋转成分矩阵
结果30批生产设备变更前后苦参膜综合得分由高到低样品编号分别为S26、S27、S30、S28、S29、S24、S25、S22、S6、S19、S23、S5、S4、S16、S1、S2、S3、S18、S7、S21、S9、S17、S13、S20、S15、S12、S11、S14、S10、S8,其中排名前5的编号所属批次均为生产设备变更后未过期苦参膜,且综合排名前8名亦为生产日期较近批号苦参膜。而其余设备变更前后苦参膜综合排名未出现规律。
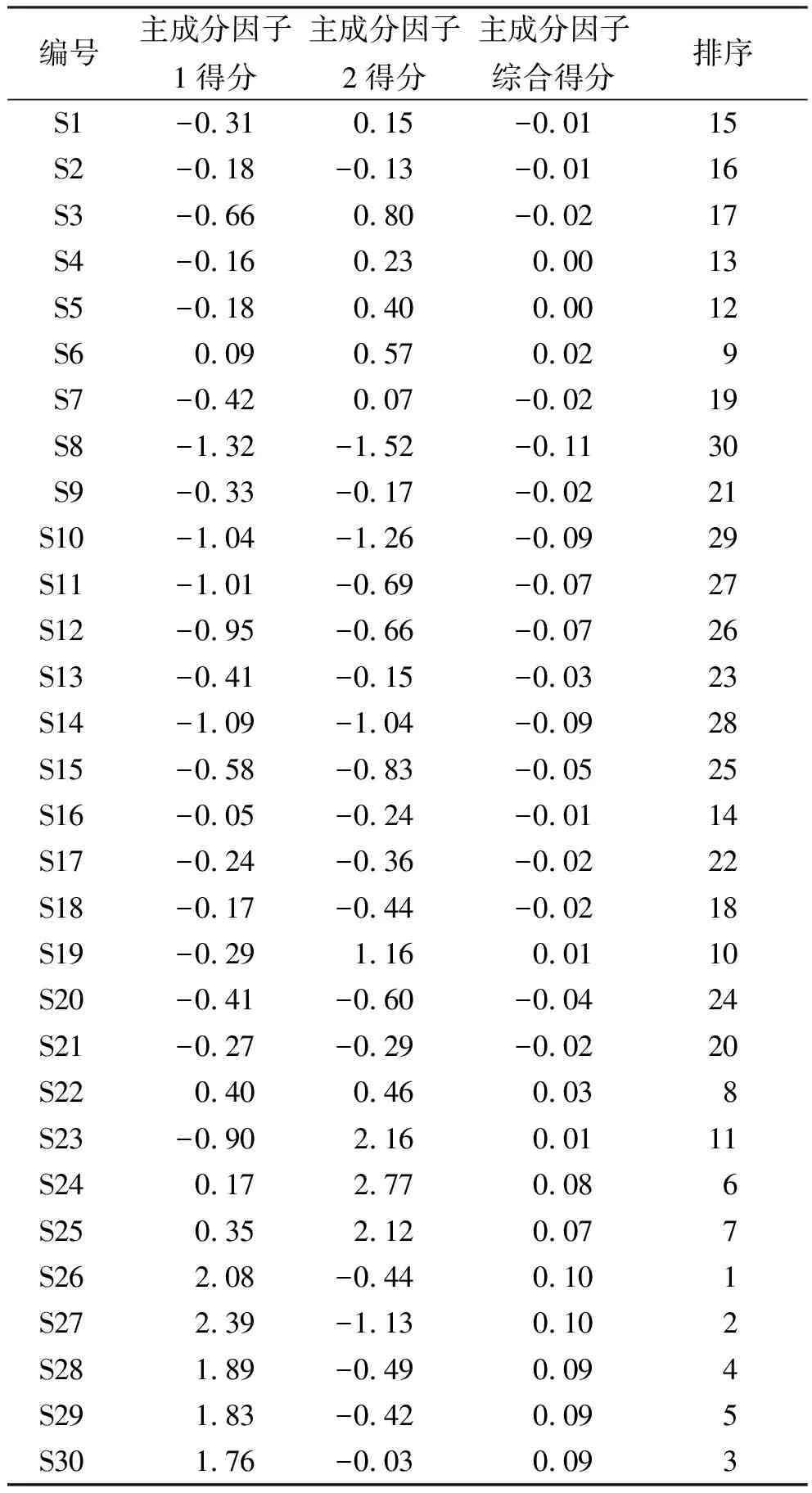
表5 30批样品主成分因子得分及排序
在2个主成分中,F1是特征值较大的,信息量较全面的指标,其累积方差贡献率达到55.711%,在主成分1中系数较大的为X3、X4、X6、X7、X8,表明峰3,4,6,7,8的量是影响30批苦参膜中苦参总碱量差异的主要成分,对照结果以表明其中3,4,7,8号峰分别为槐果碱、苦参碱、槐定碱与氧化苦参碱,6号峰为未知峰。欲探究以上5类成分是否为指标性成分,故量化5个峰峰面积,采用SPSS 22.0版进行系统聚类分析,采用组间联结法,利用欧式距离(d)作为样品的测度。聚类谱系图见图6。结果表明,d=25时,30批样品可聚为2类,S26、S27、S28、S29、S30等未过期批号苦参膜首先聚为一类,其余聚为一类;经主成分分析结果筛选出数据进行聚类分析与之前聚类结果基本一致,由此得出,通过多元统计分析可以初步筛选出苦参膜中苦参总碱差异的指标性成分[15]。
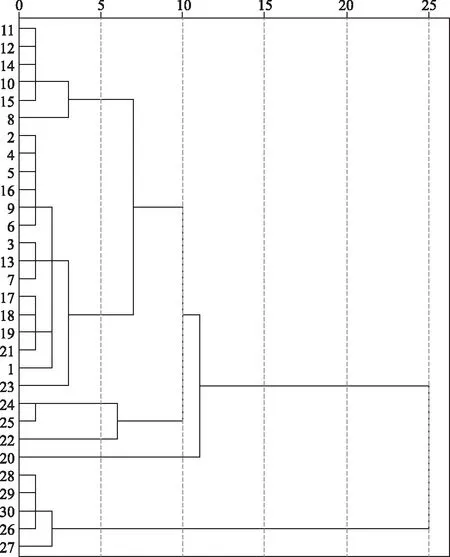
图6 30批生产设备变更前后苦参膜进行主成分分析后的聚类树状图
2.9苦参膜中4种指标成分含量测定
2.9.1线性关系考察 精密吸取混合对照品溶液,制成9个不同质量浓度的对照品溶液,按照“2.1”项色谱条件进行测定,并记录色谱峰面积。以峰面积为纵坐标(Y),对照品质量浓度为横坐标(X),绘制标准曲线,并进行线性回归,得标准曲线方程。4个成分的线性回归方程见表6。
2.9.2精密度实验 取批号20140703苦参膜样品,按照“2.2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件测定,连续进样 6次,记录峰面积。计算槐果碱、苦参碱、槐定碱和氧化苦参碱峰面积 RSD分别为0.89%,0.65%,0.5%,0.8%,表明仪器精密度良好。

表6 4种成分标准曲线
2.9.3稳定性实验 取批号20130710苦参膜样品,按照“2.1”项下色谱条件,分别在 0,2,4,8,16,20,24 h 时测定,记录峰面积。计算槐果碱、苦参碱、槐定碱和氧化苦参碱峰面积 RSD分别为0.95%,2.36%,1.18%,1.02%,表明供试品溶液在室温放置 24 h 内稳定性良好。
2.9.4重复性实验 取批号20141002苦参膜样品,按照“2.2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件测定,记录峰面积。计算槐果碱、苦参碱、槐定碱和氧化苦参碱峰面积 RSD分别为1.11%,2.88%,0.39%,0.33%,结果表明该方法重复性良好。
2.9.5加样回收率实验 取同一批次苦参膜9份,按照“2.2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件测定,测得氧化苦参碱、苦参碱、槐果碱、槐定碱的平均回收率为99.27%,99.26%,98.43%,101.24%,RSD为0.2%,0.9%,1.85%,2.2%,所以该测定方法可行。
2.9.6样品测定 分别取30批苦参膜,按照“2.2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件测定,计算样品中槐果碱、苦参碱、槐定碱和氧化苦参碱4个成分的量,结果见表7。
2.9.7两独立样本T检验 采用SPSS 22.0版软件对样品进行独立样本T检验分析。由T检验结果可得,生产工艺变更前后指标成分差异有统计学意义(P<0.05),槐果碱、苦参碱、氧化苦参碱含量均大于生产设备变更前。
3 讨论
槐果碱也称为13,14-脱二氢苦参碱,临床与实验证明其具有良好的抗炎、镇痛、抗肝纤维化、抗心律失常等作用[16],同时槐果碱可抑制氧化应激、炎症和诱导细胞凋亡等途径减轻机体损伤[17]。张剑美等[18]研究表明槐果碱抗炎机制与其抑制TLR4/MAPK、JAK2/STAT3信号通路活化密切相关,付聪敏等[19]发现槐果碱可明显抑制COX-2/PGE2信号通路,降低MDA、PGE2和COX-2 mRNA及蛋白的水平发挥抗炎、镇痛与抗氧化应激作用。活性成分槐定碱亦具有显著镇痛作用[20],且对各种急慢性炎症(包括免疫性和非免疫性炎症)均有抗炎作用,对体液免疫和细胞免疫都有抑制作用[21],二者均为目前研究较多的苦参类生物碱。本实验建立妇科膜剂苦参膜HPLC指纹图谱,等度洗脱操作简单,可同时测定4类指标性活性物质,为产品后期药效研究和临床扩大应用提供依据。过去苦参膜质量标准只对其中氧化苦参碱和苦参碱进行含量检测,不能全面反映苦参膜质量情况是否稳定,并忽略药效物质槐果碱与槐定碱含量变化。同时主成分因子分析结果表明影响产品综合得分的主要因子为3号峰槐果碱、4号峰苦参碱、7号峰槐定碱、8号峰氧化苦参碱与6号未知峰,通过二次聚类分析,结果与之前聚类结果相同,故可将上述5类物质可作为苦参膜质量检测新指标性物质,同之前苦参膜质量标准中仅对苦参碱及氧化苦参碱定量检测提高了标准,更全面保证产品质量。

表7 30批苦参膜含量测定结果

