自动瓣环运动定量技术评价蒽环类药物对乳腺癌患者右室收缩功能的影响
张利芳 郭 泰 张丽亚 刘改珍 芦 芳
蒽环类药物是目前临床治疗乳腺癌的主要化疗药物,然而其引起的心脏毒性是导致癌症患者死亡的主要原因[1]。目前临床在化疗过程中会常规评估蒽环类药物对患者左室功能的影响,而其对右室功能影响的研究较少。自动瓣环运动定量(automatic tracking of motion annular displacement,aTMAD)技术是基于斑点追踪技术发展的新技术,可快速评估右室整体功能,且不受右室形态结构及测量角度的影响。本研究应用aTMAD 技术评价蒽环类药物对乳腺癌患者化疗前后右室收缩功能的影响,旨在探讨其临床应用价值。
资料与方法
一、研究对象
选取 2018 年 10 月至 2019 年 12 月于我院乳腺外科行手术或穿刺活检首次诊断为乳腺癌的女性患者50 例,年龄28~69 岁,平均(52.78±10.08)岁。其中浸润性导管癌35 例,小叶原位癌13 例,黏液癌2 例。均行至少4个周期表柔比星+环磷酰胺方案治疗,21 d为一周期。排除标准:①左室射血分数(LVEF)<50%;②先天性心脏病、高血压病、糖尿病、缺血性心肌病、肺栓塞、阻塞性肺疾病等影响右室功能的疾病;③图像质量不清晰。本研究经我院医学伦理委员会批准,受检者均知情同意。
二、仪器与方法
1.超声检查:使用Philips EPIQ 7C 彩色多普勒超声诊断仪,S5-1 探头,频率 1~5 MHz;配备 QLAB 分析软件。分别于化疗前和化疗第2、4 周期后3 d 天内行超声心动图检查。受检者取左侧卧位,连接心电图,嘱平静呼吸,调节增益至最佳图像。先行二维超声心动图检查,双平面Simpson 法测量LVEF、右室面积变化率(RVFAC),M 型超声测量三尖瓣环收缩期位移(TAPSE)。存储连续4 个心动周期以右室为主的心尖四腔心切面动态图像,清晰显示心内膜及三尖瓣环。
2.图像分析:①将取样点分别放置于三尖瓣环右室游离壁侧、室间隔侧及心尖部,系统自动勾勒出感兴趣区,手动调整感兴趣区使其宽度与室壁厚度一致,获取右室各节段应变曲线及右室整体纵向应变(RVGLS)。②aTMAD 技术测量三尖瓣环位移(TAD)。将取样点分别放置于三尖瓣环右室游离壁侧、室间隔侧及右室心尖处,软件自动生成各取样点位移-时间曲线图,获得三尖瓣环右室游离壁收缩期峰值位移(T1)、三尖瓣环间隔收缩期峰值位移(T2)、三尖瓣环连线中点峰值位移(Tm)及Tm 与右室舒张期末期最大纵径比值(Tm%)。以上测值均测量3次以上取平均值。
3.重复性检验:分别随机选取15 个化疗前、化疗第2 周期后及化疗第4 周期后图像,2 周后由同一观察者及另一观察者分别对上述图像重新分析,计算观察者内及观察者间的组内相关系数(ICC)。
4.化疗方案:注射用盐酸表柔比星(浙江海正药业股份有限公司,国药准字:H19990280),每次100 mg/m2,间隔21 d 重复使用;注射用环磷酰胺(山西普德药业有限公司,国药准字:H14023686),每次1000 mg/m2,间隔21 d 重复使用。蒽环类药物的累积剂量按单位体表面积的累积量(100 mg/m2)进行周期递增计算。
三、统计学处理
结 果
一、化疗前后一般资料和二维超声心动图参数比较
乳腺癌患者化疗前后各周期的心率、收缩压、舒张压及体表面积比较,差异均无统计学意义,见表1。与化疗前比较,化疗第4 周期LVEF、RVFAC 及TAPSE均降低,差异均有统计学意义(均P<0.05),见表2。
表1 化疗前后各周期一般资料比较()
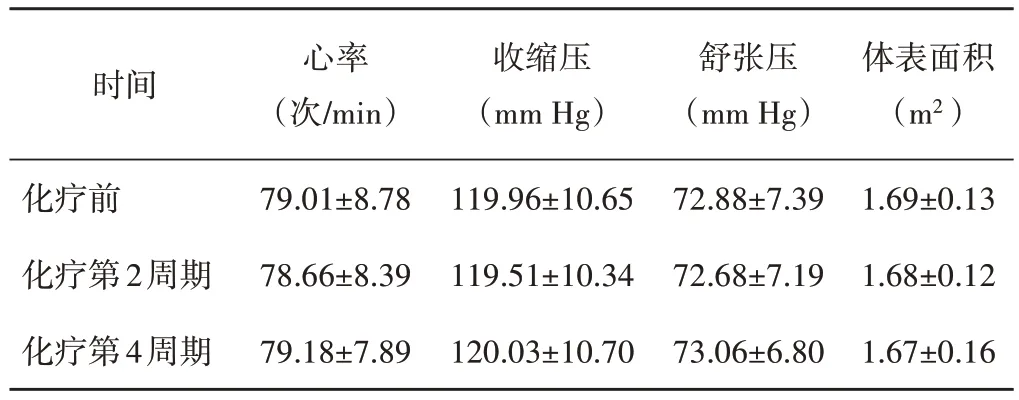
表1 化疗前后各周期一般资料比较()
1 mm Hg=0.133 kPa
化疗前化疗第2周期化疗第4周期体表面积(m2)1.69±0.13 1.68±0.12 1.67±0.16时间 心率(次/min)79.01±8.78 78.66±8.39 79.18±7.89收缩压(mm Hg)119.96±10.65 119.51±10.34 120.03±10.70舒张压(mm Hg)72.88±7.39 72.68±7.19 73.06±6.80
表2 化疗前后各周期二维超声心动图参数比较()
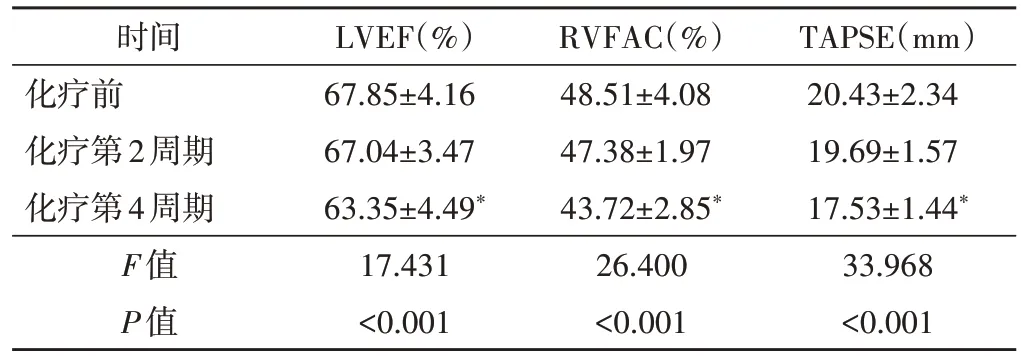
表2 化疗前后各周期二维超声心动图参数比较()
与化疗前比较,*P<0.05。LVEF:左室射血分数;RVFAC:右室面积变化率;TAPSE:三尖瓣环收缩期位移
TAPSE(mm)20.43±2.34 19.69±1.57 17.53±1.44*33.968<0.001时间化疗前化疗第2周期化疗第4周期F值P值LVEF(%)67.85±4.16 67.04±3.47 63.35±4.49*17.431<0.001 RVFAC(%)48.51±4.08 47.38±1.97 43.72±2.85*26.400<0.001
二、化疗前后RVGLS和aTMAD参数比较
化疗前后各周期RVGLS比较,差异有统计学意义(F=103.929,P<0.001),化疗第2、4周期后RVGLS均低于化疗前,差异均有统计学意义(均P<0.05)。化疗前后各周期T1、T2、Tm 及Tm%比较,差异均有统计学意义(F=109.624、50.449、93.409、173.744,均P<0.001),化疗第2、4周期后T1、T2、Tm 及 Tm%均较化疗前明显减低,差异均有统计学意义(均P<0.05)。见表3和图1,2。
三、aTMAD 参数与RVFAC、TAPSE 及 RVGLS 的相关性分析
化疗前后各周期Tm%与RVGLS 均呈强相关,与RVFAC、TAPSE 均呈弱相关;而T1、T2、Tm 与RVFAC、TAPSE、RVGLS均无明显相关性。见表4。
四、各超声参数与蒽环类药物累积剂量的相关性分析
RVGLS、T1、T2、Tm 及Tm%与药物累积剂量均呈显著负相关(r=-0.785、-0.852、-0.730、-0.765、-0.862,均P<0.05)。RVFAC、TAPSE 与药物累积剂量均呈弱相关(r=-0.502、-0.530,均P<0.05)。
五、各超声参数预测蒽环类药物心脏毒性的诊断效能
化疗第 4 周期后 TAPSE、RVFAC、RVGLS 及 Tm%预测蒽环类药物心脏毒性的曲线下面积分别为0.819、0.774、0.942、0.930。TAPSE 截断值为16.71%,敏感性为76.7%,特异性为85.7%;RVFAC 截断值为40.48%,敏感性为90.7%,特异性为57.1%;RVGLS 截断值为-18.35%,敏感性为90.7%,特异性为85.7%;Tm%截断值为15.15%,敏感性为95.3%,特异性为85.7。见图3。
表3 化疗前后各周期RVGLS和aTMAD参数比较()
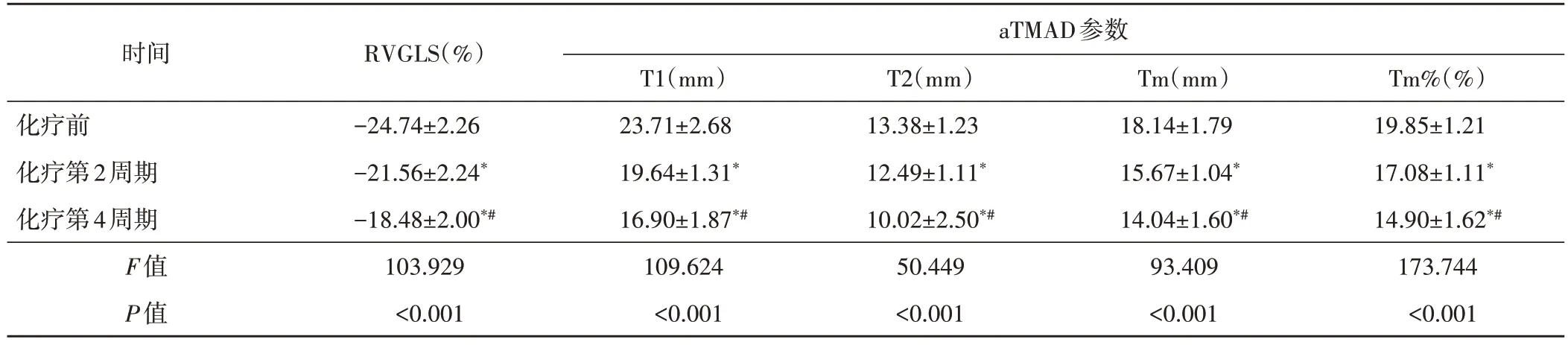
表3 化疗前后各周期RVGLS和aTMAD参数比较()
与化疗前比较,*P<0.05;与化疗第2周期比较,#P<0.05。RVGLS:右室整体纵向应变;aTMAD:自动瓣环运动定量;T1:三尖瓣环右室游离壁收缩期峰值位移;T2:三尖瓣环间隔收缩期峰值位移;Tm:三尖瓣环连线中点峰值位移;Tm%:三尖瓣环连线中点峰值位移与右室舒张末期最大纵径比值
时间RVGLS(%)aTMAD参数Tm%(%)19.85±1.21 17.08±1.11*14.90±1.62*#173.744<0.001化疗前化疗第2周期化疗第4周期F值P值-24.74±2.26-21.56±2.24*-18.48±2.00*#103.929<0.001 T1(mm)23.71±2.68 19.64±1.31*16.90±1.87*#109.624<0.001 T2(mm)13.38±1.23 12.49±1.11*10.02±2.50*#50.449<0.001 Tm(mm)18.14±1.79 15.67±1.04*14.04±1.60*#93.409<0.001
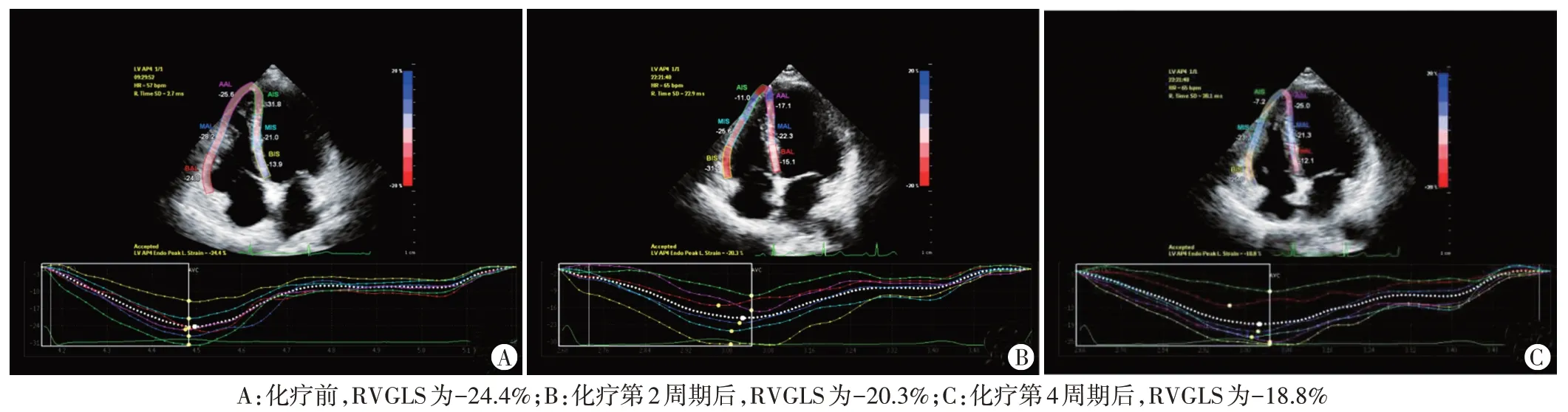
图1 化疗前后心尖四腔心切面RVGLS测量图

图2 化疗前后心尖四腔心切面三尖瓣环位移-时间曲线图
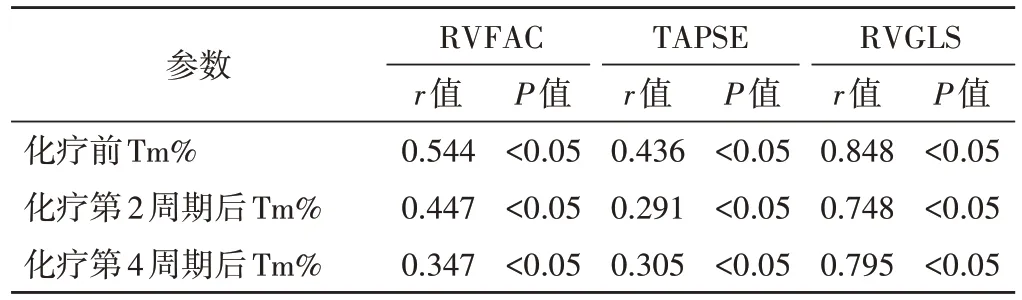
表4 化疗前后各周期Tm%与RVFAC、TAPSE及RVGLS的相关性
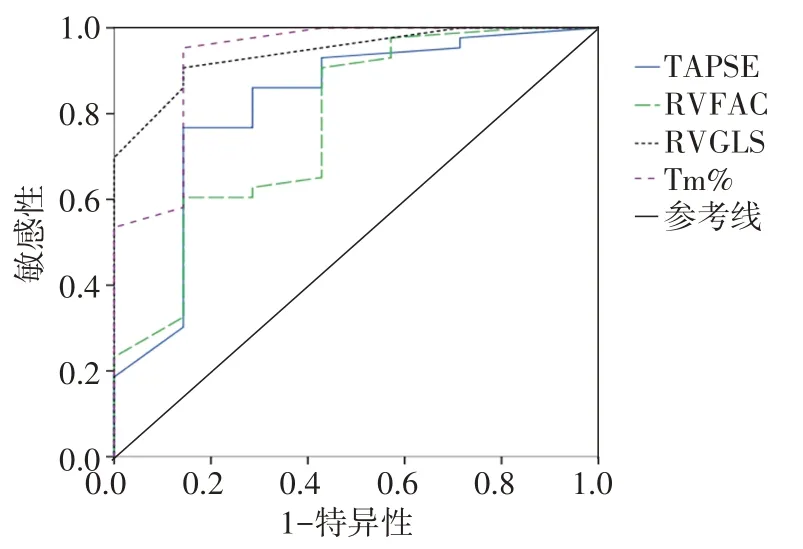
图3 TAPSE、RVFAC、RVGLS 及Tm%预测蒽环类药物心脏毒性的ROC曲线图
六、重复性检验
RVGLS 和Tm%在观察者内ICC值分别为0.891、0.937,观察者间ICC值分别为0.850、0.890。RVGLS在观察者内和观察者间的一致性界限分别为-2.89~3.51、-4.78~4.72;Tm%在观察者内和观察者间的一致性界限分别为-2.14~1.46、-3.28~3.05。
讨 论
化疗是乳腺癌综合治疗中的重要组成部分,可明显提高患者的治愈率,然而化疗药物所致的心血管并发症严重影响患者的生存质量和生存率。目前对于蒽环类药物致心脏毒性的机制尚不明确,有研究[2-4]表明自由基的形成和氧化应激作用可导致心肌细胞坏死,从而影响心肌收缩功能。既往研究[5-6]表明,蒽环类药物治疗期间对左、右心室的功能均有影响。本研究中常规超声心动图检查发现化疗第4周期后LVEF、RVFAC及TAPSE均较化疗前降低,差异均有统计学意义(均P<0.05),也表明化疗过程中患者左室和右室功能均已受损。由此可见,化疗后早期评估右室功能与左室同样重要。
本研究应用aTMAD 技术评价蒽环类药物对乳腺癌患者右室收缩功能的影响,该技术不受右室形态结构及测量角度的影响,操作简便、迅速。多项研究[7-9]结果表明,aTMAD 参数能够定量评价患者右室整体收缩功能。本研究结果也显示,化疗第2、4 周期后T1、Tm 及Tm%均较化疗前减低(均P<0.05),表明右室心肌收缩功能在化疗早期已降低;T2 由于受左室影响较大,代表左室收缩功能,在化疗第2、4 周期后亦减低,说明左室和右室收缩功能受损几乎同步。通过对各超声参数与药物累积剂量进行相关性分析后发现,RVGLS、T1、T2、Tm及Tm%与药物累积剂量均呈负相关(r=-0.785、-0.852、-0.730、-0.765、-0.862,均P<0.05),且相关程度高于常规二维超声参数RVFAC、TAPSE。说明随着化疗药物累积剂量的不断增加,患者右室收缩功能逐渐减低,且RVGLS 和aTMAD 参数在药物累积剂量达200 mg/m2时已发生减低,较常规超声(药物累积剂量达400 mg/m2)能更早期、有效地发现化疗药物对心肌功能的影响。与Kaisa 等[10]研究结果一致,表明低至中等剂量的蒽环类药物即可对右室的纵向收缩功能产生负面影响,aTMAD 技术是早期评估蒽环类药物心脏毒性的一种新的快速方法。
本研究相关性分析结果显示,T1、T2、Tm 与RVFAC、TAPSE、RVGLS 均无明显相关性;而化疗前后各周期Tm%与RVFAC、TAPSE、RVGLS均呈正相关(r=0.848、0.748、0.795,均P<0.05),其中Tm%与RVGLS 相关性最好。分析其原因可能为:Tm%属于标准化位移指标,排除了不同个体右室长径差异的影响,可以更准确地评估未出现明显临床症状患者的右室整体收缩功能。Ahmad 等[11]研究表明 aTMAD 参数中的 Tm%与心脏MRI 测得右室射血分数高度相关,且与传统M型超声相比可以更快速、简便地评价右室功能。本研究ROC曲线分析结果显示,RVGLS评价蒽环类药物心脏毒性的截断值为18.35%,敏感性为90.7%,特异性为85.7%,曲线下面积0.942;Tm%的截断值为15.15,敏感性为95.3%,特异性为85.7%,曲线下面积0.930。说明RVGLS 和Tm%在预测蒽环类药物心脏毒性方面均较敏感,诊断价值高。本研究对RVGLS 和Tm%进行重复性检验,结果显示RVGLS和Tm%观察者内的ICC分别 为 0.891、0.937,观 察者 间 的ICC分 别 为 0.850、0.890,二者的ICC均大于80%,说明RVGLS 和Tm%在观察者内及观察者间测量右室功能的变异率较低,测量结果可信度较高。再者aTMAD 技术在操作过程中对患者图像质量要求低,Tm%的测量过程较RVGLS简便,所需时间更短,可明显提高临床工作效率。
综上所述,应用aTMAD 技术可以早期、敏感地评估化疗患者右室收缩功能障碍,且简便易行、重复性好,是评估蒽环类药物化疗后右室收缩功能受损的新指标,值得临床推广。但本研究样本量较小,结果尚需大样本研究进一步证实;化疗药物对患者远期心脏功能的影响未进行追踪随访。

