61例血栓性血小板减少性紫癜患者的临床分析
石茂静, 高伟波,黄文凤,朱继红
(北京大学人民医院 1.创伤救治中心, 2.急诊科,北京 100044)
血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,TTP)是一种临床少见的、致命的血栓性微血管病(thrombotic microangiopathy,TMA),临床表现为血小板减少、微血管病性溶血性贫血(microangiopathic hemolytic anemia,MAHA), 以及神经系统损害、发热和肾损害等。TTP涉及多个系统,病情复杂且进展迅速,死亡率高,但如能及早诊断及治疗,能大大提高生存率。本文对北京大学人民医院收治的61例TTP患者病例资料进行回顾性分析,总结其临床特征,对诊断及预后进行分析,旨在提高临床诊治水平。
1 资料与方法
1.1 一般资料
收集2004年1月至2019年3月北京大学人民医院诊治的61例TTP患者的临床资料,所有患者均有完整的病例记录及转归。收集录入包括TTP相关的临床症状,比如血小板减少、MAHA、发热、神经系统症状或肾损害,以及实验室检查等。因北京大学人民医院未开展基因检测项目,且本研究人群最小患者为19岁,故认为该研究对象为获得性TTP患者。
1.2 方法
分析61例TTP患者的一般资料、临床表现和实验室结果,以及血管性血友病因子裂解酶(von Willebrand factor-cleaving protease,vWF-cp,又称ADAMTS13)等。根据离院时的结局分为存活组与死亡组,比较两组患者的临床特点、中性粒细胞-淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)和血浆置换(plasma exchange,PEX)等差异。
因并非所有医疗机构都能进行ADAMTS13检测,且结果也不能立即获得,Bendapudi等[1]设计出了一种评分系统(PLASMIC评分),用于预测ADAMTS13活性<10%的可能性,其评分系统包含下面几方面,每一项记作一分:①血小板计数<30×109/L;②溶血表现(网织红细胞计数>2.5%,检测不到结合珠蛋白,间接胆红素>20 mg/L);③无活动性肿瘤;④无器官移植或干细胞移植;⑤红细胞平均体积<9×10-14L(即90 fL);⑥国际标准化比值(international normalized ratio,INR)<1.5;⑦肌酐<176.8 μmol/L。关于预测ADAMTS13活性<10%,PLASMIC评分6~7分,其敏感性为91%,此方法优于临床判断;0~4分,提示ADAMTS13活性不可能<10%,其特异性为99%; 5分可能提示该患者为药物引起的TMA、弥散性血管内凝血、溶血尿毒综合征诊断可能性更大[1]。根据上述评分系统,计算所有患者的PLASMIC评分。将ADAMTS13检测作为金标准,计算PLASMIC评分预测ADAMTS13降低的敏感性。
1.3 统计学分析
使用SPSS 17.0进行统计分析。计数资料用频数、百分比表示,计数资料采用Pearson卡方检验。计量资料分组比较时,符合正态分布者采用均数±标准差表示,采用独立样本t检验;不符合者,用M(P25,P75)表示,采用Mann-WhitneyU检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料
61例患者中,男性22例(36.1%), 女性39例(63.9%), 平均年龄(48±17)岁,最小者19岁,最大者88岁。死亡组27例(44.3%),存活组34例(55.7%)。61例患者均为获得性TTP,其中特发性43例(70.5%),免疫相关疾病者13例(21.3%),异基因造血干细胞移植2例,妊娠、感染、肿瘤各1例;其中1例急性髓性白血病异基因造血干细胞移植的患者,由慢性广泛型移植物抗宿主病合并败血症诱发TTP以弥漫性肺泡出血起病。
2.2 临床表现
TTP典型临床表现有血小板减少、MAHA、神经精神症状,以及发热和肾损害,具备前三项者为三联征,全部出现为五联征。本组61例患者中,48例有五联征表现,9例仅有三联征表现,其余4例无神经精神症状。所有患者的平均体温(38.6±1.1) ℃。61例TTP患者中,血尿合并蛋白尿者44例,仅血尿者9例(72.1%), 8例无血尿和蛋白尿(表1)。

表1 61例TTP患者临床表现
2.3 实验室检查
61例患者血小板明显降低、重度贫血,肌酐及乳酸脱氢酶升高。溶血方面,39例患者检测结合珠蛋白均明显降低(<5.83 g/L者33例,其余6例范围在6.8~18.9 g/L,正常值36~195 g/L);39例患者检测血浆游离血红蛋白均明显升高(中位数360 mg/L,正常0~40 mg/L)。59例完善外周血涂片检查,破碎红细胞3%(2%,7%)。出凝血方面,凝血酶原时间、活化部分凝血活酶时间、纤维蛋白原正常,D-二聚体水平轻度升高。61例TTP患者中,59例完善Coombs’试验,其中阴性者52例(占85.2%),阳性(++)2例,阳性(+)5例。50例患者完善抗核抗体检查,阴性27例,阳性23例(其中滴度1 ∶40者7例,1 ∶80者5例,1 ∶320者4例,1 ∶640者 6例及1 ∶1 280者1例,表2)。
30例患者采用荧光共振能量转移法(fluorescence resonance energy transfer,FRET)检测ADAMTS13值在49.0(40.8,61.3) μg/L[正常值(666±135) μg/L], 10例患者采用海斯特表面增强激光解吸电离飞行时间质谱法(surface-enhanced laser desorption/ionization-time of flight-mass spectrometry,SELDI-TOF-MS)行ADAMTS13活性检测均<5%(正常值>50%),其余21例未检测ADAMTS13。
2.4 根据预后分组比较
与存活组相比,死亡组年龄更大、肌酐更高、PEX次数及置换量更少(P<0.05)。两组血红蛋白、乳酸脱氢酶及NLR差异无统计学意义(P>0.05)。41例PEX者中,28例存活(68.3%);20例未行PEX者中,6例存活(30%),二者差异有统计学意义(P<0.05)。61例患者均应用了糖皮质激素,其中使用大剂量糖皮质激素冲击治疗者36例(59%),未冲击治疗者25例(41%)。39例(63.9%)应用了免疫球蛋白,22例(36.1%)未使用。死亡组与存活组在人免疫球蛋白及糖皮质激素治疗两方面差异无统计学意义(P>0.05)。61例患者中,有5例难治性TTP患者在糖皮质激素联合PEX治疗不佳时使用利妥昔单抗,其中3例病情缓解,有效率为60%(表3)。

表2 61例TTP患者实验室检查结果
2.5 PLASMIC评分
61例TTP患者的PLASMIC评分中,7分44例,6分14例,5分2例,4分1例,见表4。对于40例已经检测ADAMTS13的患者,39例PLASMIC评分在6~7分;21例未检测的患者,PLASMIC评分6~7分者19例,5分和4分各1例,因此,PLASMIC评分6~7分预测ADAMTS13降低(绝对值或活性)的灵敏度为97.5%。
3 讨论
TTP为一种临床急危重症,分为遗传性与获得性两种。遗传性TTP多由于基因突变引起ADAMTS13缺失或活性下降;获得性TTP多由自身抗体抑制ADAMTS13活性或加速ADAMTS13的清除所致[2],本研究中所有患者均为获得性TTP。
3.1 临床特点
TTP出现经典“五联征”仅20%~40%,且多为病程晚期,多数患者(60%~80%)表现为“三联征”[2]。随着对TTP认识的提高,病情极少进展到五联征。及时有效治疗TTP,死亡率可从90%降低至10%[3]。本组患者出现“五联征”者 78.7%,总体病死率44.3%,均高于文献报道[2-3],考虑与多数患者经多家医院转诊而来,病情迁延、进展且多为病程晚期有关。
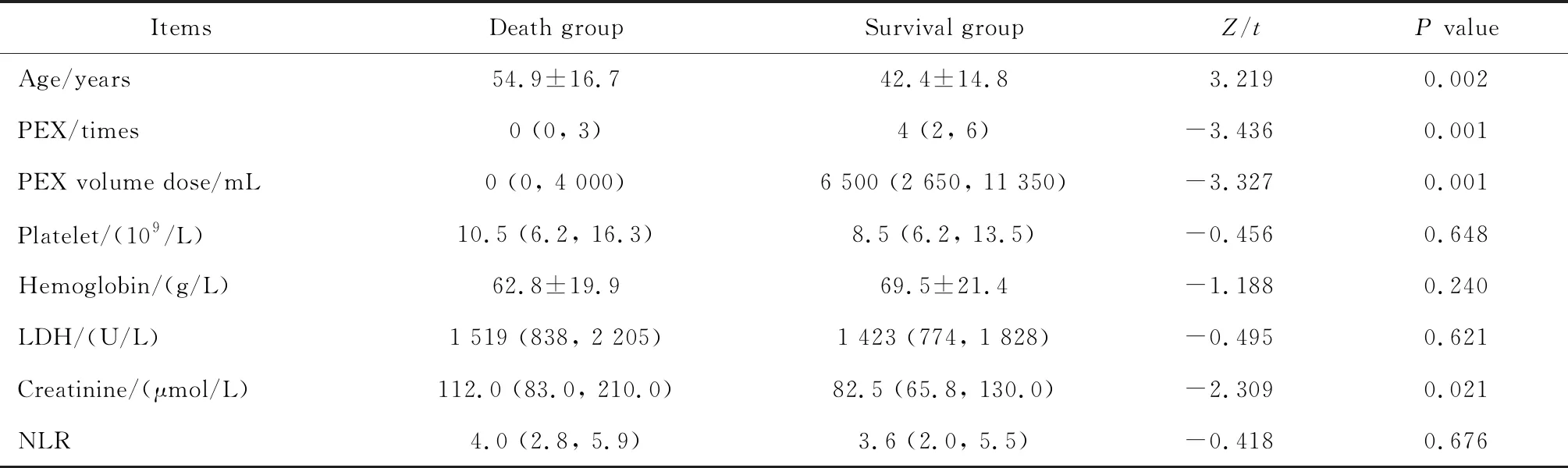
表3 死亡组与存活组的临床参数比较
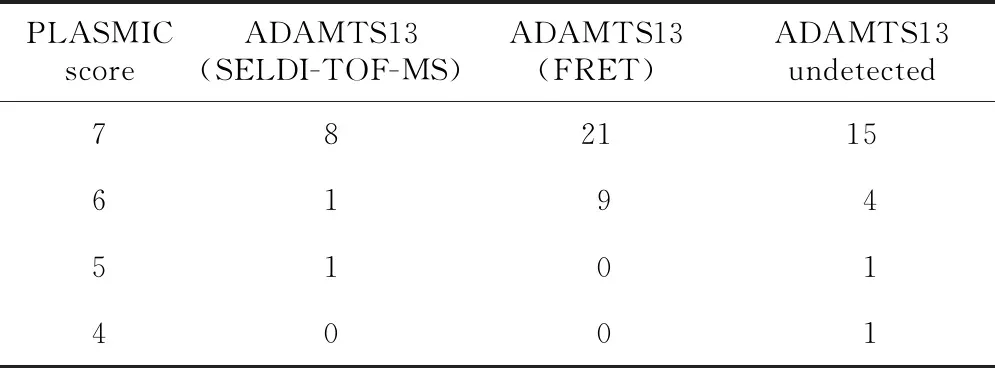
表4 61例TTP患者PLASMIC评分
TTP最常表现为严重的血小板减低,中位血小板计数10×109/L,其次为MAHA,中位血细胞比容21%,相当于血红蛋白70 g/L左右;外周血涂片找到破碎红细胞(>1%)[4]。本研究人群的上述指标在此范围内,且乳酸脱氢酶明显升高,考虑可能与红细胞破坏有关,但与预后无关。
3.2 发病机制
TTP的发生机制与严重的ADAMTS13活性降低密切相关。ADAMTS13是一种金属蛋白酶,功能上是血管性血友病因子(von willebrand factor,vWF)裂解酶。ADAMTS13活性缺乏时,超大vWF多聚体聚集是发病的重要原因。ADAMTS13检测是诊断TTP的特异性指标,急性期TTP患者血浆ADAMTS13活性一般<10%[5]。若ADAMTS13活性<10%且存在ADAMTS13抑制因子即可确诊为获得性TTP,但ADAMTS13活性>10%或未检测到抑制因子也不能排除获得性TTP的诊断。本研究共40例TTP患者检测ADAMTS13,其活性或绝对值均明显减少;其余21例采用PLASMIC评分,推测ADAMTS13活性降低的可能性,其灵敏性高达97.5%,有助于TTP的及早发现。据报道,PLASMIC评分阳性预测值为72%,阴性预测值为98%,灵敏度90%,特异度92%[4],因此,PLASMIC评分可快速准确地预测ADAMTS13活性,可尽早诊断和及早治疗TTP。
3.3 治疗
PEX是TTP治疗的首选[6],PEX的作用是提供外源性的ADAMTS13,移除ADAMTS13抗体,清除对ADAMTS13不敏感的患者体内大量的vWF多聚体[7]。一旦疑诊或确诊TTP,就应及时开始PEX治疗。在救治早期危重症TTP时,PEX的量应充足(推荐至少2 000 mL/次或40~60 mL/kg),频率应充分(每日1~2次)[2]。一旦TTP诊断明确,在疾病缓解之前,都不应放弃PEX治疗。如血浆紧缺,不足以进行PEX,可采取血浆输注,达到补充ADAMTS13目的,或者以白蛋白等胶体替代进行置换,达到清除抗体目的。应尽量避免突然终止PEX,建议在血小板恢复100×109/L,逐渐停止以免病情再次反复[8]。本组患者除外血浆缺乏情况,41例进行了PEX,死亡率为 31.7%,明显低于无PEX组(70%), 但仍高于文献报道[3],考虑与血浆紧缺、置换不充分,病程较晚、部分患者来不及血浆置换,以及合并肿瘤等并发症有关。对于其他原发性TMA综合征,PEX的可能益处还不太明确,也并不急于应用,因此需要评估PEX的利弊,包括发生率较高的并发症,如中心静脉导管相关性出血、感染、血栓形成以及血浆相关输血反应。
由于获得性TTP具有自身免疫病特征,糖皮质激素是较为常用的治疗手段,能够使患者迅速获得免疫抑制反应,因此建议可在PEX治疗的同时联合使用糖皮质激素治疗。有前瞻性研究表明,较大剂量[10 mg/(kg·d)]甲泼尼龙与标准剂量[1 mg/(kg·d)]相比,具有更好的疗效[9]。本组患者的糖皮质激素和免疫球蛋白治疗均与预后无关,可能与本组患者样本量太少有关。
利妥昔单抗为抗CD20单克隆抗体,在PEX治疗的基础上,其首先被用于重症的及难治性的TTP患者,可以提高疗效,减少PEX次数,有助于此类患者尽快缓解,减少复发[10]。在用于普通TTP患者时,利妥昔单抗可以明显缩短患者的住院时间,并且可以减少此类患者的复发倾向[11]。如有条件,应早期使用。本组研究中5例难治性TTP患者在糖皮质激素联合PEX治疗不佳时使用利妥昔单抗,有效率仅为60%,考虑与例数较少及应用时间较晚有关。
3.4 NLR与TTP预后
近年来,关于NLR研究逐渐增多,其作为全身性炎症的一个可用的生物标志物,与各种疾病不良预后的预测相关。高中性粒细胞的严重炎症可能导致休克和脓毒症甚至死亡[12]。中性粒细胞通过形成中性粒细胞胞外陷阱(neutrophil extracellular traps,NETs)在炎症和血栓形成中发挥重要作用[13]。在脑卒中、心肌梗死和TTP中,NETs升高[14]。NETs是中性粒细胞受到刺激活化后,释放到细胞外的一种网状结构,以脱氧核糖核酸为骨架,镶嵌组蛋白、中性粒细胞弹性蛋白酶等,是一种不同于坏死和凋亡的特殊类型的细胞死亡[15]。无效清除或过度形成NETs可引起病理学效应。由于其特殊的网状结构,NETs可以通过刺激血小板聚集和凝血酶的生成促进血栓形成[13]。急性TTP患者的中性粒细胞弹性蛋白酶水平升高,这与TTP患者的疾病活动相关[16]。这些观察结果表明,NETs在治疗TTP中发挥作用。
内皮损伤是导致TMA事件的中心因素,实验发现在TMA急性期分离的中性粒细胞释放了过量的活性氧、N源性氧化剂和蛋白酶,并在体外诱导人微血管内皮细胞系的损伤和抗血栓能力丢失[17]。除了ADAMTS13缺乏症外,各种有害刺激(炎症细胞因子、细菌毒素、磷酸二酯酶抑制剂)激活内皮细胞可能在TTP的发病机制中发挥重要作用[13]。
我们的资料发现,虽然患者死亡组NLR较存活组稍高,但差异无统计学意义 (P>0.05)。提示内皮损伤虽然是血栓形成的关键,但TTP血栓形成的主要机制还是ADAMTS13的活性缺乏或被抑制,本组患者数量较少,尚需进一步研究证实。
综上所述,由于TTP病情危急,血小板减少和MAHA是TTP的本质特征,一旦疑诊TTP,应尽早行PEX。在ADAMTS13检测无法获得时,PLASMIC评分由于其敏感性及特异性高,可以协助诊断TTP。NLR可以预测多种疾病的预后,但对TTP预后的指导意义需进一步研究。
本文为回顾性研究,且病例数较少,研究存在一定局限性,待继续收集病例后进一步研究。

