‘哈伯’南天竹组织培养和快速繁殖
张俊林 樊靖 胡玉春 杨浩 胡绍庆 沈柏春
摘要:为建立‘哈伯’南天竹组织培养和种苗繁育技术体系,以半木质化带芽茎段为外植体材料开展植株再生研究。通过观察对比试验法、L9(34)正交试验设计完全随机法、极差分析、显著性检验、LSD多重比较,探讨了‘哈伯’南天竹组培的最适培养基配方。试验结果表明:最佳诱导培养基为MS + 6-BA2.0 mg/L + IBA0.1 mg/L +蔗糖30 g/L,诱导萌动率71.77%,成活率85.51%;最佳增殖培养基为WPM +6-BA1.5 mg/L+ IBA 0.01 mg/L +蔗糖30 g/L,增殖系数6.3;最佳生根培养基为1/2 MS+ IBA 0.5 mg/L + NAA 1.0 mg/L+蔗糖20 g/L +AC 0.2 g/L,生根率97.63%;试管苗移入泥炭土:珍珠岩=3:2(V/V)混合基质中,移栽成活率96.67%。该试验建立了高效稳定的组培快繁技术体系,得到的组培苗后代能够稳定的保持母本优良性状,为工厂化育苗提供了技术支撑。
关键词:‘哈伯’南天竹;组织培养;种苗繁育;再生;增殖
中图分类号:S688.4文献标志码:A论文编号:cjas20200300087
Nandina domestica‘Harbour Dwarf’: Tissue Culture and Rapid Propagation
Zhang Junlin1, Fan Jing1, Hu Yuchun1, Yang Hao1, Hu Shaoqing2, Shen Bochun1
(1Hangzhou Landscaping Incorporated, Hangzhou 31000, Zhejiang, China;
2Building Engineering College, Zhejiang Sci-Tech University, Hangzhou 310018, Zhejiang, China)
Abstract: The aim of this study is to establish a system of tissue culture and seedling production for Nandina domestica‘Harbour Dwarf’. The stem segments of semi-lignified band buds were used as explants to conduct regeneration study. The comparative experiments, completely randomized orthogonal experiment design of L9(34), range analysis, significance test and LSD multiply comparative analysis were used to discuss the optimal culture medium. The results showed that the highest frequency of shoot induction (71.77%) and survival rate(85.51%) were achieved on MS + 6-BA 2.0 mg/L + IBA 0.1 mg/L + sucrose 30 g/L. The highest proliferation coefficient (6.3) was obtained on WPM +6-BA 1.5 mg/L + IBA 0.01 mg/L + sucrose 30 g/L. Microshoots exhibited best rooting response on 1/2 MS+ IBA 0.5 mg/L + NAA 1.0 mg/L + sucrose 20 g/L + AC 0.2 g/L by producing the highest frequency of root formation (97.63% ). Rooted plantlets were transferred to artificial mixture medium (peat: perlite=3:2.V/V) under the green house condition with the survival rate up to 96.67%. An efficient propagation system of Nandina domestica‘Harbour Dwarf’was established, and the plantlets could steadily inherit the character of parents. The present system provides technical support for large scale plant production.
Keywords: Nandina domestica‘Harbour Dwarf’; Tissue Culture; Seedling Production; Regeneration; Proliferation
0引言
南天竹(Nandina domestica)为小檗科南天竹属常绿灌木[1],是一种具有观赏、生态、药用等多种价值的树种[2],其叶、果、株型皆具极高的观赏价值,广泛用于园林绿化中[3-4]。南天竹原产中国华北、华中、华东及华南部分地区,日本亦有分布[5],经过自然演化及栽培驯化已形成多个栽培变种,常见的栽培变种有红果南天竹、玉果南天竹、五彩南天竹和藍果南天竹、狭叶南天竹、栗木南天竹和圆叶南天竹[6],茎干笔直,高约2 m,少分枝或无分枝。‘哈伯’南天竹(Nandina domestica‘Harbour Dwarf’)原产地为美国北卡罗莱纳州[7],生长缓慢,株高40~80 cm,枝叶浓密,株形紧凑,基部萌蘖性强;叶片对生,2~3回羽状复叶,偶有4回,小叶纺锤形,长4~8 cm,宽1~2 cm,先端钝尖,基部楔形,全缘,薄革质,属矮生类型南天竹新品种。
近年来,人们相继对南天竹属的不同品种展开了资源利用与开发[8- 9]、新优品种资源收集[10]、引种驯化[11-13]、播种育苗[14]、扦插繁育[15-17]、组培快繁等工作的研究,特别是‘火焰’南天竹(Nandina domestica‘fire power’)的相关研究报道较多。周南镚等[18]以‘火焰’南天竹茎段为外植体材料进行了组织培养和植株再生技术的研究;杜永芹等[19-20]在‘火焰’南天竹组织培养中通过筛选植物生长调节剂组合及使用浓度进行了研究了,取得了突破,提高了增殖系数;贾思振等[21-22]以‘火焰’南天竹组培苗叶片为外植体材料,建立了叶片不定芽再生技术体系且成功建立了遗传转化技术体系。
虽然有较多关于矮生型南天竹品种‘火焰’的组织培养技术研究报道,但鲜见‘哈伯’南天竹的组织培养报道。本研究以‘哈伯’南天竹半木质化茎段为材料进行组织培养技术研究,建立组培快繁技术体系,以期为工厂化育苗提供技术支持。
1材料与方法
1.1试验时间、地点
本研究试验于2016年3月—2017年12月在杭州市园林绿化股份有限公司组织培养技术实验室(临安)内进行。
1.2试验材料
试验材料为‘哈伯’南天竹(Nandina domestica‘Harbour Dwarf’)半木质化茎段,取自杭州市园林绿化股份有限公司苗木种质资源圃(临安)。
1.3试验方法
1.3.1外植体处理剪下当年生无病虫害的半木质化枝条作为外植体材料,带回实验室。将枝条剪成长度2~ 5 cm的小段,保留叶柄长度0.5~1.0 cm,備用。将剪好的茎段用软毛刷蘸取1%(V/V)的洗洁精溶液仔细刷除枝条污垢后,自来水冲洗60 min备用。将备用试材在超净工作台上用75%(V/V)酒精溶液浸泡45 s,无菌水冲洗3次,然后用1‰(m/V)升汞(HgCl2)溶液(添加几滴吐温-80)灭菌10 min,期间不断震动;最后用无菌水冲洗6次,在无菌培养皿中用无菌滤纸吸干茎段表面水分。然后用无菌手术刀将茎段两端各切去0.5~ 0.7 cm,两侧叶柄各切去0.2 cm,把处理好的材料切成1.0 cm左右的茎段,茎段形态学下端接种至诱导培养基上。
1.3.2诱导培养将处理好的茎段迅速接入含有0.1 mg/L吲哚丁酸(IBA)且添加6-苄氨基嘌呤(6-BA)(0、0.5、1.0、1.5、2.0、2.5和3.0 mg/L)的诱导培养基上进行培养,诱导培养基以MS[23]作为基本培养基,卡拉胶7 g/L,蔗糖30 g/L,pH 5.6~5.8。每处理接种30瓶,每瓶接种1个外植体,重复3次;不添加生长调节剂的培养基作为对照(CK)。培养条件(文中无特殊说明均同此):培养温度(25±2)℃,光照时间12 h/d,光照强度60μmol/(m2·s)。以萌生嫩茎长度大于1 cm计为成活(有效萌芽),小于1 cm计为萌动,培养60天后,统计分析不同处理对‘哈伯’南天竹外植体萌动率和成活率的影响。
萌动率=(萌动数/未污染数)×100%…………(1)
成活率=(成活数/萌动数)×100%……………(2)
1.3.3增殖培养将诱导培养的长度小于0.5 cm的嫩茎直接转接,大于0.5 cm的嫩茎(梢)切割成0.5~1.0 cm左右的茎段转接到增殖培养基配方中。设置基本培养基[WPM[24]、1/2 MS(大量元素减半)、MS]、6-BA(0.5、1.0和1.5 mg/L)、IBA(0.01、0.05和0.1 mg/L)和蔗糖(20、30和40 g/L)4因素3水平,采用L9(34)正交试验设计。每处理接种30瓶,每瓶接种5个嫩茎或茎段,重复3次。培养60天后,统计增殖倍数,并记录增殖情况。1.3.4生根培养选择生长健壮,高度大于1.5 cm的试管苗嫩茎进行生根培养,培养温度(24±2)℃,光照时间12 h/d,光照强度60μmol/(m2·s)。采用以下8种培养基进行生根诱导:(1)1/2 MS;(2)1/2 MS+ 0.3 mg/L NAA;(3)1/2 MS+0.3 mg/L IBA;(4)1/2 MS+0.3 mg/L IBA + 0.3 mg/L NAA;(5)1/2 MS + 0.5 mg/L IBA + 0.3 mg/L NAA;(6)1/2 MS+0.3 mg/L IBA+0.5 mg/L NAA;(7)1/2 MS+1.0 mg/L IBA+0.5 mg/L NAA;(8)1/2 MS+0.5 mg/L IBA+1.0 mg/L NAA;以上各培养基均添加2%蔗糖、7 g/L卡拉胶和0.2 g/L活性炭(AC)。每处理接种30瓶,每瓶接种10个嫩茎,重复3次。生根培养60天后,观察生根情况并统计生根率,有效生根为嫩茎生根条数3条以上,根长2 cm以上。
生根率=(有效生根株数/生根总株数)×100%(3) 1.3.5炼苗移栽诱导生根苗根长2 cm左右时即可进行炼苗移栽。移栽前,温室炼苗10天。用镊子将小苗从培养瓶中取出,用清水洗净根系,移栽到泥炭土:珍珠岩=3:2(V/V)混合基质的育苗床上,移栽完成后浇透定根水。移栽初期用塑料薄膜小拱棚保湿保温,湿度80%以上,温度保持在15~30℃之间,光照太强时适当遮阴。移栽小苗新根出现后每隔10天喷施1‰磷酸二氢钾溶液;塑料小拱棚两头开口慢慢放风,进行环境适应性锻炼,待小植株恢复健壮生长后就可移去塑料薄膜。移栽30天后统计成活率。
移栽成活率=(存活苗数/移栽苗数)×100%…(4)
1.4数据统计分析
采用Excel 2007和DPS 3.01专业版统计软件进行数据分析及处理。
2结果与分析
2.1外植体诱导
将灭菌外植体茎段接种到诱导培养基中,接种后15天,外植体茎段叶柄开始松动脱落;除空白(ck)处理外,25天后茎段开始萌动;45天后腋芽伸长形成新梢。有些外植体茎段虽然萌动,却不能抽生新稍,最终干枯死亡。
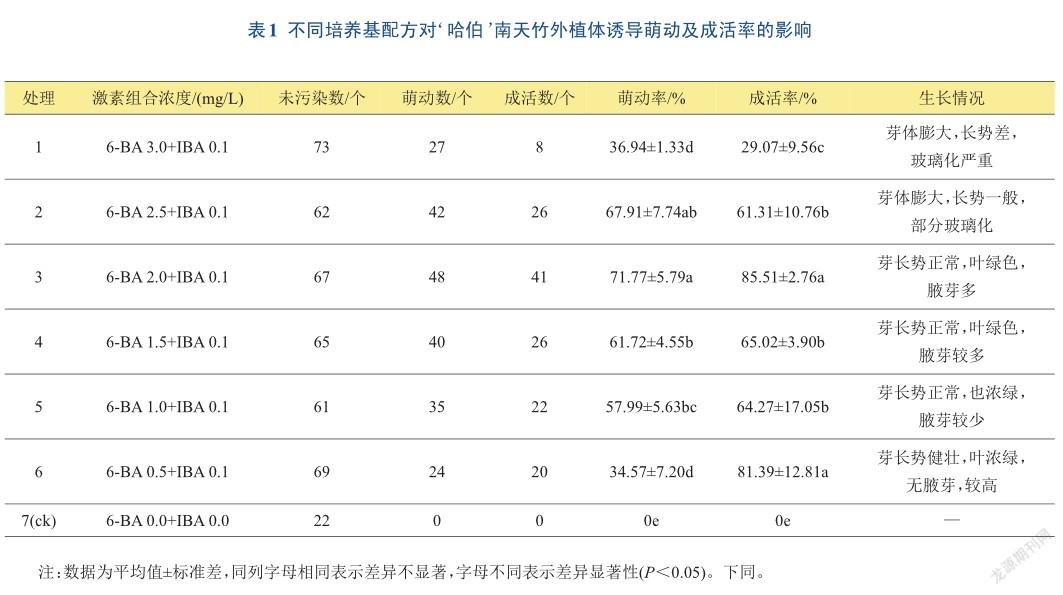
不同处理对外植体的萌动和成活有一定的影响,如表1所示。无生长调节剂的处理7(ck),无萌动和无成活;低浓度(0.5 mg/L)和高浓度(3.0 mg/L)的6-BA对外植体萌动不具有促进作用,萌动率较低;6-BA浓度为1.0~2.5 mg/L时,萌动率随6-BA浓度增加先升高然后降低,当6-BA浓度为2.0 mg/L时,萌动率最高为71.77%;成活率总体呈现出与萌动率相似的变化现象,高浓度的6-BA抑制外植体抽生嫩茎,且影响嫩茎的质量,出现严重的玻璃化。综上分析,适合‘哈伯’南天竹诱导培养的培养基为MS +2.0 mg/L 6-BA+ 0.1 mg/L IBA+蔗糖30 g/L(图1A)。
2.2增殖培养基筛选
L9(34)正交试验设计结果表明(表2),随着培养基中6-BA浓度的增高,‘哈伯’南天竹试管苗的增殖倍数增加,由于基本培养基的不同表现出不同的长势。处理3,即WPM+1.5 mg/L 6-BA +0.1 mg/L IBA+蔗糖40 g/L是最好的处理,增殖倍数最大为5.11,与其他处理具有极显著性差异,生长势表现良好。从极差分析结果可以看出,6-BA是影响‘哈伯’南天竹试管苗增殖倍数的主要因子(R=1.87),基本培养基对试管苗的增殖倍数影响也较大(R=0.88),IBA浓度的影响不大(R= 0.27),蔗糖用量的影响最小(R=0.12)。以不定芽增殖倍数为参考指标,综合考虑,优选出‘哈伯’南天竹试管苗的最佳增殖培养基配方为WPM+1.5 mg/L 6-BA+ 0.01 mg/L IBA +蔗糖30 g/L(图1B),在此优选增殖培养基上培养,增殖率可达6.3以上。
2.3生根培养基筛选
选择健康、茎段长度1.5 cm及以上的嫩茎接种于不同处理的生根诱导培养基上,其生根诱导效果表现不同的差异(表3)。植物生长调节剂对‘哈伯’南天竹组培苗生根诱导具有促进作用,不添加植物生长调节剂的处理1不生根,生根率随IBA和NAA浓度增加而提高。组培苗诱导生根根系品质受IBA、NAA浓度及比例影响;处理2和处理3生根率差异不显著,根系品质有较大差别,NAA诱导出的根系细长且柔软,IBA诱导出的根系短粗且脆;处理4和处理5及处理6和处理7均有类似现象,且随IBA浓度的增加,生根嫩茎愈伤变大;处理8生根率为97.63%,与其他处理有极显著差异,根细品质好。综合生根效果及根系品质优选,‘哈伯’南天竹最佳生根培养基为1/2 MS+0.5 mg/L IBA+1.0 mg/L NAA(图1C)。
2.4炼苗移栽
选择根系较好的健壮植株移栽到泥炭土:珍珠岩= 3:2(V/V)混合基质的育苗床上,经过30天的移栽管理,移栽成活率96.67%,幼苗根系及植株生长良好(图1D)。
3讨论
3.1组培繁育的必要性
Meyer[7]报道指出‘Harbour Dwarf’南天竹于1956年发现,是一个以苗圃主人(Harbour C. L.)姓氏命名的南天竹栽培品种。其作为矮生类型新品种于2013年引种至浙江杭州,经过6年连续的区域适应性栽培试验观察发现,具有耐阴、耐寒、耐瘠薄、耐高温,病虫害极少;秋季气温转凉,叶色转红(图1E),尤其是冬季,叶色变为鲜红(图1F)的特性。该品种能适应我国绝大部分地区的气候条件,秋冬变色效果尤以长江以北区域为最佳,是合适的园林景观地被及色块植物品种,亦可盆栽作为家庭园艺植物产品,具有广阔的商业开发应用前景。
南天竹常规繁育主要采用扦插、种子播种及分株繁殖,由于‘哈伯’南天竹植株低矮、年生长量不大、茎节短的特性,无法获得充足的扦插穗条用于扦插;偶有开花结实,果实自然脱落率极高,暂未收集到成熟果实。笔者所在的团队通过扦插繁育试验发现,‘哈伯’南天竹扦插比较容易生根,成活率较高,但受限于插条的数量,未能在短期内获得大量种苗。植物组織培养技术恰好能打破因插条数量不足而造成的扩繁困难的窘境,一旦建立起完善的组培快繁技术体系,可快速繁殖种苗。
3.2外植体材料预处理

合适的外植体材料是取得组织培养成功的前提条件。取材时节、取材部位以及取材母树的生长状态对组培成功与否具有直接的影响。在本研究中发现,大田盆栽母本外植体材料消毒非常困难,多次试验未能获得外植消毒成功,主要污染为真菌污染,从叶鞘内长出菌丝,其原因可能是母本材料自身特性造成的,自然条件下植株节间极短,呈现出叶鞘抱茎互生状,消毒剂不能彻底杀灭叶鞘内部的真菌,以及大田环境不干净的原因,从而导致消毒失败。2017年2月,笔者将大田盆栽转移至温室并进行平茬处理,半个月后植株茎基部陆续萌发新芽,为保证外植体取材的需求,保留2~3个新生嫩茎,其余萌芽全部抹除;为了加快生长速度以及增大茎段节间长度,间隔10天,喷施0.2 mg/L 6-BA和0.5 mg/L赤霉素混合液2次。4月中上旬新生枝条长度10~30cm,茎段直径0.2cm左右,节间长度0.5~4cm。剪取此半木质化茎段作为外植体材料,进行和大田材料一样的消毒处理,取得了消毒成功并建立了组培体系。所以,对于节间极短的繁育材料,可通过一定的技术处理使其快速生长,增加节间长度,从而降低外植体消毒难度。
3.3外植体诱导
影响植物细胞、组织和器官形态发生有诸多因素,其中植物生长调节剂的种类和浓度是主要因素[25],外植体的诱导萌芽主要受植物生长调节剂的影响。试验中以MS为基本培养基,添加2.0 mg/L6-BA和0.1 mg/L IBA,促进了腋芽的诱导,诱导率可达71.77%,且能激发外植体茎段2个腋芽同时萌发(图1A),提高了外植体诱导率。在‘哈伯’南天竹茎段腋芽诱导试验过程中发现6-BA诱导作用显著,既能促进腋芽萌发,也适合萌芽嫩茎的生长,低浓度时萌发率较低,但过高浓度则抑制腋芽的萌发,同时有玻璃化现象出现,这与马丽娜等[26]的报道相一致。生长素有助于缓解高浓度分裂素造成的玻璃化,这可能是诱导萌芽阶段吸收了外源生长素,改变了分裂素/生长素比例的缘故,关于分裂素/生长素比例对外植体诱导的影响还需进一步研究。

3.4增殖培养
不定芽的诱导和增殖是植物组织培养再生体系建立成功与否的关键,而解决幼芽的增殖数量和速率是再生体系中重要的一步[27]。试管苗的增殖率受到生长调节剂种类及配比的影响,提高分裂素用量,会增加丛生芽数量,同时试管苗高度会降低,过高浓度使用时,从芽分化困难,甚至造成玻璃化,使用合适浓度的生长调节剂既可保证增殖系数又能分化出一定高度的嫩茎用于生根培养,省去壮苗培养环节,节省时间成本提高工作效率。本研究结果显示,WPM +1.5 mg/L 6-BA+ 0.01 mg/L IBA是‘哈伯’南天竹较为适宜的增殖培养基,增殖系数6.3。确保可持续性生产以及降低潜在的种苗后代变异的风险,工厂化生产过程中应降低6-BA的使用浓度到1.0 mg/L,瓶苗增殖系数控制在3~4为宜。
3.5生根诱导
以往研究表明大多数木本植物组培快繁存在诱导生根困难的问题[28,29],这可能与培养基成分、激素种类、比例不同以及基因型有关[30],通常采取调整生长调节剂种类及比例做进一步优化,提高诱导生根率,都明理[31]指出外植体诱导及增殖阶段的培养条件影响试管苗本身激素水平和生长状态,进而影响诱导生根;也有研究表明[32],诱导生根率随着继代次数的增加而提高,本研究结果与其研究结论相类似。‘哈伯’南天竹在连续继代6次以后,生根诱导率明显提高,由以前(继代次数3~5次)的不足10%提高到50%左右;当继代次数达到10次后,生根诱导率可达95%以上且呈现稳定状态。推测可能的原因是随着继代次数的增多,增殖苗自身激素达到了利于生根的平衡状态,关于试管苗内源激素随继代次数动态变化如何影响诱导生根率需要进一步研究。
4结论
本研究中以‘哈伯’南天竹半木质化茎段为外植体材料建立了组织培养及快速繁殖技术体系,实现了大规模工厂化生产繁育。最佳诱导培养基为MS + 6-BA 2.0 mg/L + IBA 0.1 mg/L +蔗糖30 g/L;最佳增殖培养基为WPM +6-BA 1.5 mg/L + IBA 0.01 mg/L +蔗糖30 g/L;最佳生根培养基为1/2 MS+ IBA 0.5 mg/L + NAA 1.0 mg/L +蔗糖20 g/L + AC 0.2 g/L。截止发表论文之时,通过此组培快繁体系繁育种苗200余万株,盆栽和地栽种苗生长良好,没有发现生长不良以及变异种苗。
参考文献
[1]杨涛,鲁娜.西昌地区南天竹扦插育苗技术研究[J].现代农业科学, 2009(1):13-15.
[2]中国科学院植物研究所.中国高等植物图鉴(第二册)[M].北京:科学出版社,1979.
[3]王春,尹庆平,陈慧芳,等.南天竹扦插快繁技术[J].林业科技开发, 2012,26(4):126-128.
[4]任雪玲.美国‘白果’南天竹扦插技术及插穗生根类型研究[J].经济林研究,2019,37(3):188-192.
[5]唐丽,刘友全.南天竹种质资源及利用[J].湖南环境生物职业技术学院学报,2007,13(3):4-6.
[6]方彦.园林植物[M].北京:高等教育出版社,2005.
[7]Meyer F G. New and noteworthy woody plant cultivars[J].The Bulletin of the American Association of Botanic Gardens and Arboreta,1979,13:85-87.
[8]劉锦春.南天竹资源利用与开发研究[J].中国野生植物资源,2004, 23(6):22-23.
[9]唐丽,刘友全,钟秋平.南天竹开发利用价值评价体系的建立[J].中南林业科技大学学报,2007,27(6):97-103.
[10]王圣芹.冬天里的一把火—火焰南天竹[J].园林,2000(3):36.
[11]朱志祥,蒋伟,刘燕,等.野生南天竹的驯化栽培技术[J].江苏林业科技,2006,33(3):31-33.
[12]张庆瑞,路买林,任雪玲,等.彩叶新品种‘白果’南天竹引进与快繁技术[J].河南林业科技,2017,37(4):7-10.
[13]任雪玲,路买林.彩叶南天竹新品种引进及抗逆性研究[J].河南林业科技,2017,37(3):5-7.
[14]刘国华,陈莹,何云鹏,等.南天竹播种繁殖技术[J].园艺与种苗, 2018,38(8):18-19.
[15]王玉勤.火焰南天竹的扦插繁殖法[J].上海农业科技,2004(5):5-7.
[16]沈登锋,魏斌,洪春桃,等.不同生根促进剂对红叶南天竹扦插生根的影响[J].天津农业科学,2016,22(5):93-95.
[17]周峰,胡水华.南天竹夏插育苗技术[J].林业科技开发,2002,16(4): 58-59.
[18]周南镚,黄一青,王青华.火焰南天竹的组织培养[J].农业科技通讯,2002(11):17.
[19]杜永芹,倪林娟,王玉勤,等.耐寒彩叶树种火焰南天竹的快繁技术研究[J].上海农业学报,2004,20(4):1-4.
[20]杜永芹,倪林娟,王玉勤,等.观赏林木新品种火焰南天竹的引进与繁育技术研究[J].上海农业学报,2007,23(3):38-41.
[21]贾思振,王媛花,颜志明,等.火焰南天竹叶片不定芽再生研究[J].江苏农业科学,2016,44(2):73-75.
[22]贾思振,王媛花,王全智.火焰南天竹高效稳定遗传转化体系的建立[J].科技通报,2016,32(12):47-50.
[23]Murashige T, Skoog F.A revised medium for rapid growth and bioassays with tobacco tissue cultures[J].Physiol Plant, 1962,15(3): 473-497.
[24]Lloyd G, McCown B. Commercially feasible micropropagation of mountain laurel, Kalmia latifolia, by use of shoot tip culture[J].Proc Int Plant Prop Soc, 1980,30:420-427.
[25]Hajam M A, Hassan G I, Bhat T A, et al. Understanding plant growth regulators, their interplay: For nursery establishment in fruits[J]. Int J Chem Stud, 2017,5(5):905-910.
[26]马丽娜,何江,李冠.新塔花的组织培养与快速繁殖[J].植物生理學报,2018,54(8):1349-1355.
[27]韩创举,杨培华,樊军锋,等.楸树组培技术研究[J].西北林学院学报.2006,21(1):80-81.
[28]张瑞芝,王峰,李丹蕾,等.欧美杨再生体系的建立[J].中国农学通报,2017,33(4):48-53.
[29]王琼,郭小兵,郭玉寿.木本植物再生植株生根的研究进展[J].山西林业科技,2014,4(3):27-30.
[30]蔡文博,段虹,王军,等.4个鲜食葡萄品种组培快繁体系的建立[J].核农学报,2019,33(2):248-254
[31]都明理,徐娇,朱楚然,等.白木香的组织培养快速繁殖研究[J].中国农学通报2019,35(26):80-83.
[32]张俊林,余有祥,沈柏春,等.北美冬青‘奥斯特’的组织培养和快速繁殖[J].植物生理学报,2014,50(10):1541-1545.
[33]刘用生,李友用.植物组织培养中活性炭的使用[J].植物生理学通讯,1994,30(3):214-217.
[34]Shinde K A, Patel R M, Shah R R, et al. Proliferation, rooting and acclimatization of micropropagated grape cv. Thompson seedless[J]. Int J Plant Sci, 2010,5(1):98-101.

