酸性氯化铜蚀刻废液一步沉淀法制备碱式碳酸铜
汤政涛,刘后传,李丽敏,吕照辉,成 琳,于少明
(1. 合肥工业大学 化学与化工学院,安徽 合肥 230009;2. 泰兴冶炼厂有限公司,江苏 泰兴 225400)
印刷电路板(PCB)产量日益剧增[1-2]。在其蚀刻过程中会产生大量蚀刻废液,若不经处理直接排放不仅造成严重的环境污染,也会造成资源的巨大浪费[3]。酸性氯化铜蚀刻废液成分为盐酸、氯化铜等[4]。目前,对其处理方法主要包括两大类:一类是对蚀刻废液进行再生处理;另一类是以蚀刻废液为原料合成铜的化合物,如氧化亚铜[3]、氧化铜[5-6]、碱式氯化铜[7]、氢氧化铜等[8]。其中,碱式碳酸铜是一种复盐,有CuCO3·Cu(OH)2和2CuCO3·Cu(OH)2两种晶型[9],分解温度为220 ℃[10]。碱式碳酸铜在催化剂、防腐剂、烟火材料、抗菌材料、饲料添加剂等诸多领域得到广泛的应用[11]。目前,碱式碳酸铜常用的生产方法有氨法、硝酸铜法和硫酸铜法,国内外研究较多的是硫酸铜法[11],生产成本较高。以含铜废液制备碱式碳酸铜既可节约成本,又减少了蚀刻废液直接排放对环境造成的污染。东莞市广华化工有限公司[12]将20%的酸性氯化铜蚀刻废液加入碳酸钠溶液中,在较低温下反应1.5 h制备内晶,再将剩余的80%废液加入至内晶中,在75 ℃反应4~5 h,制备碱式碳酸铜。该法步骤繁琐、耗时太长,不利于工业化生产。郑帅飞[13]首先以含铜蚀刻废液制备氧化铜,再经碳氨溶液溶铜、蒸氨、沉铜等工序制备碱式碳酸铜。该法虽原料价格低廉,但蒸氨沉铜工序耗能较大,整个合成工艺需分3步进行,较为繁琐。
本工作以酸性氯化铜蚀刻废液为主要原料,采用Na2CO3一步沉淀法制备碱式碳酸铜。在助剂A存在下,反应体系pH只发生缓慢变化,解决了生成的沉淀分解变黑的问题。通过控制反应pH、反应时间、反应温度及助剂A的加入量,不仅有助于碱式碳酸铜沉淀的稳定形成,而且有效降低了杂质氯离子在碱式碳酸铜产品中的残留。
1 实验部分
1.1 试剂、材料和仪器
Na2CO3:化学纯;助剂A:分析纯,水溶液呈碱性。
酸性氯化铜蚀刻废液:由江苏泰兴冶炼厂有限公司提供,密度为1.29 g/mL,Cu2+质量浓度为128.1 g/L,H+浓度为1.74 mol/L,Cl-质量浓度为238.14 g/L。
D/MAX2500V 型 X 射线衍射(XRD)仪:日本理学电机公司;TG209 F3型热重分析(TG)仪:德国耐驰仪器制造有限公司;QUANTA200FEG 型扫描电子显微镜(SEM):美国 FEI 公司;DDS-307A型电导率仪:南京途威商贸有限公司。
1.2 实验方法
采用一步沉淀法制备碱式碳酸铜。移取25 mL酸性氯化铜蚀刻废液,加入100 mL蒸馏水进行稀释。再称取4.2 g固体Na2CO3与适量助剂A混合,加水配成阴离子浓度为1.2 mol/L的混合沉淀剂。以每秒2滴的滴加速率将稀释后的蚀刻废液加入到混合沉淀剂中。调节pH,在70 ℃下搅拌反应一段时间,趁热过滤。滤饼用蒸馏水洗涤至洗涤液电导率小于10 μS/cm,在105 ℃下干燥2.5 h。工艺流程见图1。
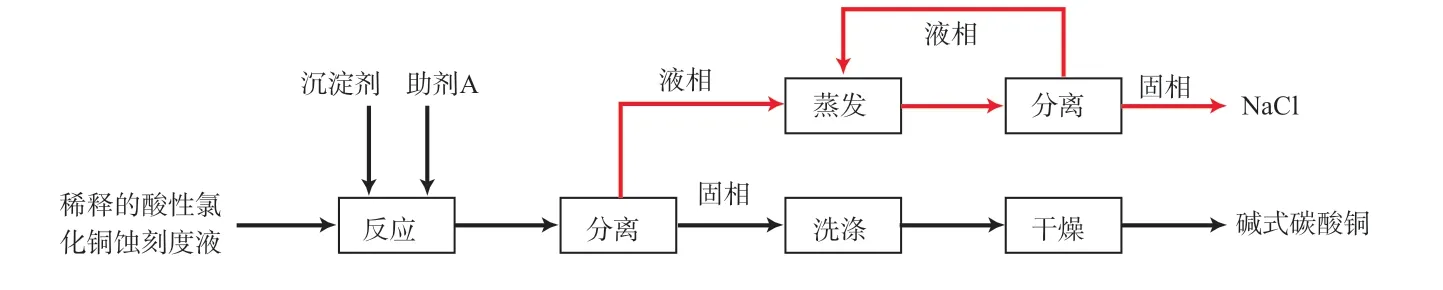
图 1 工艺流程
1.3 分析方法
参照HG/T 4825—2015《工业碱式碳酸铜》[14],采用间接碘量法测定产品铜含量,采用目视比浊法分析产品氯含量;采用XRD分析物相组成;采用TG分析产品热稳定性;采用SEM分析产品的形貌;采用电导率仪检测滤饼洗涤液的电导率。
2 结果与讨论
2.1 反应pH对产品制备效果的影响
反应pH对产品氯含量及铜含量的影响见图2。由图 2可见:产品w(Cl-)随pH的升高呈现先降低再升高的趋势;反应pH=7.0时,产品中w(Cu2+)较高(55.68%),w(Cl-)只有0.012%,低于HG/T 4825—2015《工业碱式碳酸铜》[14]的要求;反应pH<7.0时,w(Cl-)逐渐升高,反应pH=4.0时,w(Cl-)达到13.82%,w(Cu2+)也达到最高(58.65 % )。根据KIM等[5]的报道,碱式氯化铜(CuCl2·3Cu(OH)2)可以在pH<7条件下形成,据此推测反应pH<7.0条件下制备的产品为碱式氯化铜。因此,制备碱式碳酸铜的最佳反应pH为7.0。
样品A(pH=7.0)和样品B(pH=4.0)的XRD谱图见图3。由图3可见:样品A的衍射峰位置与碱式碳酸铜(Cu2(OH)2CO3)的JCPDS-41-1390标准卡片完全对应,无其他杂质峰,这表明在pH=7.0条件下制备的产品为碱式碳酸铜;相反地,样品B的衍射峰位置与碱式氯化铜(CuCl2·3Cu(OH)2)的JCPDS-25-0269标准卡片完全一致,无其他杂质峰,这表明pH=4.0条件下制备的产品确实为碱式氯化铜。
反应pH对反应后滤液颜色的影响见图4。由图4可见,反应pH=7.0时滤液呈无色,但随着pH减小或增大,反应后的滤液蓝色均逐渐加深。这是因为在pH<7.0时,溶液碱性较弱,Cu2+未被全部沉淀,部分以游离态形式存在于溶液中;在pH>7.0时,少部分碱式碳酸铜在过量的碳酸盐溶液中会溶解,生成铜的络合物[10],导致Cu2+回收率降低。化学分析结果表明,反应pH=7.0时Cu2+的回收率接近100%。pH<7.0或者pH>7.0都会导致Cu2+不能完全回收,该滤液若直接排放将会给环境带来危害。
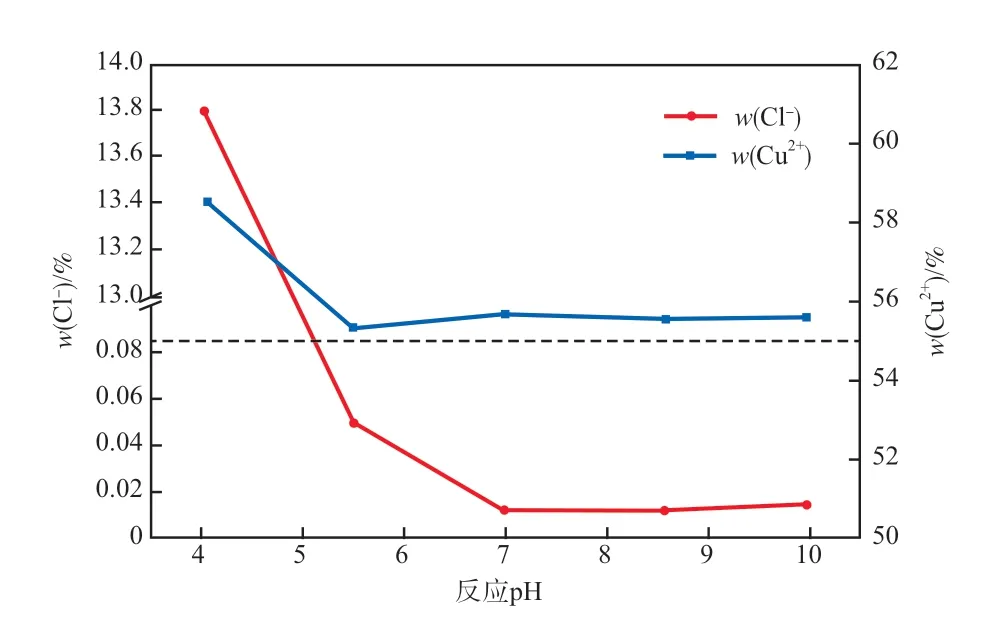
图2 反应pH对产品氯含量及铜含量的影响
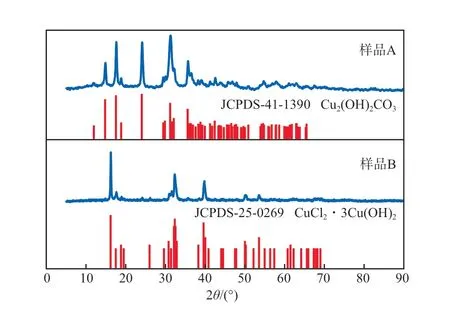
图3 样品A(pH=7.0)和样品B(pH=4.0)的XRD谱图

图4 反应pH对反应后滤液颜色的影响
2.2 混合沉淀剂n(Na2CO3)∶n(助剂A)对产品制备效果的影响
混合沉淀剂n(Na2CO3)∶n(助剂A)对产品制备效果的影响见表1。
由表1可见:混合沉淀剂n(Na2CO3)∶n(助剂A)对产品的颜色及沉淀出现的时间影响不大,但对产品中杂质氯离子的含量有一定影响,随着助剂A加入量增加,产品中杂质氯离子含量略有降低;当n(Na2CO3)∶n(助剂A)=1∶2时,反应后的最终pH恢复至中性,产品中w(Cl-)降到最低(0.013%)。这可能是因为随着沉淀剂中助剂A比例的增加,反应后溶液的pH随之降低,pH=7.0时,溶液黏度降至最低,产品中的杂质离子容易洗涤;反之,pH>7时,OH-浓度增大,溶液黏度较高,杂质氯离子难以洗涤。当单独以助剂A溶液作为沉淀剂时,初始pH在8左右,反应最终pH降低至4.5,所得产品的w(Cu2+)超过58.0%,w(Cl-)超过13.0%。根据2.1节分析可以推断,单独以助剂A为沉淀剂时所得产品为碱式氯化铜。
酸性氯化铜蚀刻废液H+浓度达1.74 mol/L,与碱溶液反应时,溶液的pH降低较快,不利于碱式碳酸铜的制备。从表1中数据可以发现,当沉淀剂单独为Na2CO3时,反应体系在1 min内变成黑色。这是因为Na2CO3溶液碱性很强(初始pH达到13以上),反应结束后OH-剩余过多,Cu2+与OH-反应生成的Cu(OH)2在70 ℃的碱性环境中很快分解为黑色CuO。在Na2CO3溶液中添加适量沉淀助剂A可解决上述问题,其作用机理为:助剂A具有弱碱性,与Na2CO3混合后可降低沉淀剂的初始pH。此外,加入A可使反应过程中的pH变化缓慢,保持反应过程中 pH 在饱和碱式碳酸铜溶液的pH范围内[15],有利于碱式碳酸铜沉淀的形成。随着n(Na2CO3)∶n(助剂A)值的减小,反应最终pH也随之降低。这是因为助剂A用量的增加会使混合沉淀剂碱性降低,从而导致反应结束时OH-剩余量随之减少,因此反应最终pH逐渐降低。因此,制备碱式碳酸铜的最佳沉淀剂配比n(NaOH)∶n(助剂A)为1∶2。

表1 混合沉淀剂n(Na2CO3)∶n(助剂A)对产品制备效果的影响
2.3 反应时间对产品制备效果的影响
反应时间对产品氯含量及铜含量的影响见图5。由图5可见,当反应时间小于2.0 h时产品铜含量随反应时间的延长呈现增长的趋势,反应时间为2.0 h时w(Cu2+)达到最高(55.62% );w(Cl-)随反应时间延长呈现先降低再升高的趋势,当反应时间为1.0 h时产品w(Cl-)最低(仅为0.013%);继续延长反应时间,氯离子含量明显快速升高,而产品铜含量呈现缓慢下降的趋势。这是因为制备的碱式碳酸铜表面较粗糙,易形成凹槽或间隙,且颗粒间有团聚现象,随着反应时间的延长,吸附在凹槽或颗粒间夹缝中的杂质离子增多,导致铜离子含量在产品中所占比例下降。综上,反应时间为1.0 h对产品制备最有利。
2.4 反应温度对产品制备效果的影响
反应温度对产品制备的影响见表2。

图5 反应时间对产品氯含量及铜含量的影响

表2 反应温度对产品制备效果的影响
由表2可见:当反应温度为40 ℃时产品呈淡蓝色,过滤时间很长,且w(Cu2+)很高,这是因为,温度较低时分子热运动较慢,制备产品中Cu(OH)2所占比例较高,Cu(OH)2颗粒小呈胶状,严重影响过滤速度;当反应温度为50~80 ℃时,随着反应温度升高,产品绿色逐渐加深,过滤时间逐渐缩短,对w(Cl-)与w(Cu2+)影响不大,这是因为,随着温度升高,分子热运动速率加快,容易形成大颗粒的沉淀,有效加快过滤速度;反应温度达90℃时,产品呈灰黑色,这是由于温度过高时碱式碳酸铜分解为黑色氧化铜。反应温度为70 ℃时所得产品颜色较正、过滤时间较短,w(Cl-)最低,因此,最佳反应温度为70 ℃。
2.5 产品表征及分析
2.5.1 XRD 分析
碱式碳酸铜产品的XRD谱图见图6。

图6 碱式碳酸铜产品的XRD谱图
由图6可见,产品在2θ为14.8°,17.6°,18.8°,24.1°,29.5°,29.9°,31.2°,31.6°,32.2°,35.6°,36.0°,38.9°,41.3°,42.4°,46.6°,47.9°,54.6°,57.9°,62.9°,63.1°,65.6°等处出现了衍射峰,分别对应(110),(020),(120),(200),(220),(230),(040),(20-1),(021),(21-1),(240),(13-1),(150),(041),(250),(160),(350),(360),(012),(550),(171),(280)晶面,与碱式碳酸铜的PDF标准卡片(JCPDS—41-1390)完全吻合,除碱式碳酸铜(Cu2(OH)2CO3)衍射峰外无其他杂质峰,这表明实验制得的产品为高纯度的Cu2(OH)2CO3。
2.5.2 热重分析
碱式碳酸铜产品的热重分析曲线见图7。由图7可见:产品在200 ℃前有微量失重,这是由于颗粒失去表面吸附水造成的;200~360 ℃之间为主要失重带,在此温度区间曲线迅速下降,在360 ℃后趋于平缓,在此过程中碱式碳酸铜发生分解反应,生成CuO、H2O和CO2,360 ℃左右基本分解完全,失重率达27.64%左右。EL-SHOBAKY等[16]通过研究碱式碳酸铜的热分解过程及失重百分比,明确了碱式碳酸铜热分解的机理,反应方程式见式(1)。
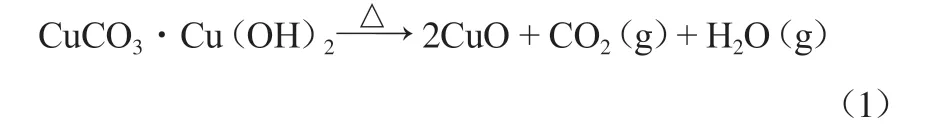
实验失重率(27.64%)与CuCO3·Cu(OH)2的理论失重率(28.04%)接近,由此判断该条件下制备的产品是由1分子CuCO3与1分子Cu(OH)2构成的碱式碳酸铜,其分子式为CuCO3·Cu(OH)2。

图7 碱式碳酸铜产品的热重分析曲线
2.5.3 SEM分析
碱式碳酸铜产品的SEM照片见图8。由图8可见:产品为小颗粒CuCO3·Cu(OH)2,形貌呈不规则球形,直径为1.8~5.4 μm,局部分散均匀;此外,许多小颗粒紧密团聚形成大颗粒,呈不规则的姜块状,粒径为48~75 μm。颗粒间团聚形成的间隙很容易夹杂氯离子,这也是产品中氯离子未能全部去除的可能原因之一。

图8 碱式碳酸铜产品的SEM照片
3 结论
a)以酸性氯化铜蚀刻废液为原料制备低氯含量的碱式碳酸铜,确定最佳工艺条件为:反应pH 7.0,沉淀剂配比n(NaOH)∶n(助剂A)=1∶2,反应温度70 ℃,反应时间1.0 h。
b)化学分析结果表明:产品的w(Cu2+)达55.62%,w(Cl-)为0.013%,符合HG/T 4825—2015《工业碱式碳酸铜》的要求;蚀刻废液中Cu2+的回收率接近100%。助剂A的引入使反应过程的pH发生缓慢变化,有利于碱式碳酸铜晶核的稳定、快速形成。
c)制备的产品为单一组分CuCO3·Cu(OH)2,小颗粒形貌呈不规则球形,直径为1.8~5.4 μm,较多小颗粒紧密团聚成姜块状的不规则大颗粒,粒径为48~75 μm。

