神经系统少见卒中模拟病
杨静,印卫兵
卒中模拟病(stroke mimics)[1]是指一大类在疾病的发病初期,患者的临床症状及体征类似卒中,而经详细的病史询问、检查、评估及随访后,最后证实患者并非卒中疾病的一组疾病,目前没有统一定义,因其临床症状类似卒中发作,容易被误诊。一些卒中模拟病不易被识别,本文现将临床工作中遇到的三类少见卒中模拟病病例介绍如下。
1 病例介绍
1.1 病例1 患者,女性,74岁,因“右侧肢体无力15天,精神异常9天”于2019年1月2日入院。患者15 d前无明显诱因出现右侧肢体无力,仅在搀扶下可行走,感头晕,后就诊于当地医院,行头颅CT提示:左侧脑桥低密度,给予抗血小板、调脂等治疗,症状未见好转。9 d前出现夜间躁动不安、言语混乱、摔砸物品等异常行为,随后症状逐渐加重,为进一步治疗收入我院。入院时神经系统检查:神志模糊,右上肢肌力3级,远端肌力0级,右侧下肢肌力0级,右侧巴宾斯基征(+),记忆力、计算力、共济失调等检查欠合作,余未见明显阳性体征。入院时NIHSS评分14分,FABS(facioplegia,atrial-fibrillation/age,blood-pressure,seizure)评分3分,远程卒中模拟病(telestroke mimic,TM)评分23分。既往有高血压病史,余无特殊史。实验室检查:血氨、肝肾功能、电解质、凝血检查未见明显异常;甲状腺功能:游离三碘甲状腺原氨酸2.16 pmol/L,促甲状腺素0.042 pmol/L,血清甲状腺球蛋白抗体147.9 IU/mL,余未见异常;肌酸激酶1433 U/L;风湿三项:CRP 153 mg/L,抗“O”和类风湿因子均无异常;免疫五项:IgA 4.67 g/L(正常范围0.7~3.5 g/L),IgG、IgM、补体C3和C4均未见异常。2019年1月10日头颅MRI示:左侧脑桥小片状亚急性梗死灶,无明显新发病灶(图1)。入院后给予阿司匹林100 mg+氯吡格雷75 mg+瑞舒伐他汀钙20 mg,辅以营养神经、抗感染等治疗10 d,症状好转不明显,结合患者临床特征及辅助检查,考虑诊断:①桥本氏脑病(Hashimoto’s encephalopathy,HE);②脑梗死。治疗加用泼尼松500 mg,静脉滴注,1次/日,冲击治疗5 d,后改为静脉滴注250 mg,1次/日,治疗3 d,患者症状明显好转,复查肌酸激酶正常。再次查体:神志清楚,计算力、反应力、定向力正常,右上肢近端肌力4级,远端肌力2级,右侧下肢肌力3级,右侧巴宾斯基征(+)。出院后继续应用泼尼松,逐渐减量治疗,1个月后复诊,患者神志清楚,反应可,右侧肌力近端肌力4级,远端肌力3级,右侧下肢肌力4级。

图1 病例1入院后DWI检查示左侧脑桥呈稍高信号
1.2 病例2 患者,男性,36岁,因“突发双耳听力障碍及言语不清19天”于2014年3月10日入院。患者19 d前下班后突然出现双侧耳鸣,伴幻听、躁动、头痛,不能理解他人说话,不能听见电话声音,3 d后头痛加重,呈爆炸样,双侧额颞区为主。2014年2月23日于当地医院行头颅MRI示:左侧颞顶叶异常信号影。初步诊断:脑梗死、炎症待排查(图2)。腰椎穿刺示:白细胞8×106/L,蛋白33.44 mg/dL,糖3.32 mmol/L,腺苷脱氢酶3.9 U/L,拟病毒性脑炎给予抗病毒、脱水、激素等治疗,症状改善不明显。既往无特殊疾病史。后转入我院进一步治疗,入院查体:神志清楚,精神可,听理解差,言语不清,记忆力、定向力无法配合,无失读,但无法理解文字内容,复述可,颈部轻度抵抗感,颏下2指,克氏征、布氏征(+)。入院时NIHSS评分5分,FABS评分5分,TM评分7分。入院第2天患者出现右手持物不能,双耳幻听,无法理解他人言语,第4天出现右手抽搐伴疼痛,后反复发作,每次持续2~3 min。实验室检查:血尿便常规、肝功能、肾功能、血脂、血清同型半胱氨酸、肿瘤标志物、甲状腺功能、输血八项、抗心磷脂抗体、抗ENA抗体未见异常,脑脊液检查未见明显异常。2014年3月14日头颅MRI示:双侧颞叶、左侧岛叶灰白质病变(图2),增强未见明显强化。脑电图示:轻度异常脑电图,脑地形图(较多θ慢波活动、θ频段能量轻度增高)。腓肠肌肌肉活检病理示:散在单个肌纤维嗜碱性增生,改良莫瑞氏染色法(MGT)染色可见破碎红纤维;基因检测示:线粒体基因MT-TL1m3243A>G杂合性突变。最终诊断:线粒体脑肌病伴高乳酸血症和卒中样发作综合征。给予辅酶Q10 10 mg,3次/日,复合维生素B2片,3次/日,奥卡西平0.3 g,2次/日。治疗1个月后复诊,无抽搐再发,无幻听,对答正常,仍有右侧肢体活动不灵。
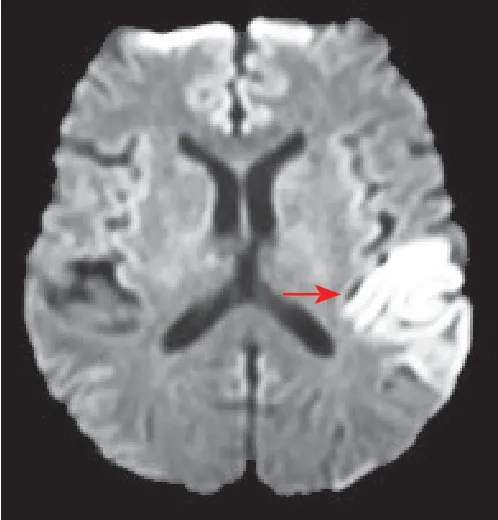
图2 病例2入院后DWI检查示颞叶高信号
1.3 病例3 患者,女性,63岁,因“头晕伴口角歪斜10小时”于2019年3月2日入院,患者10 h前突然出现头晕,伴口角歪斜、行走不稳,渐进性出现肢体不自主活动,立即就诊我院。2019年3月2日头颅CT及CTA示:双侧基底节区少许点片状低密度影,考虑缺血性卒中给予静脉溶栓(阿替普酶36 mg)治疗,症状好转不明显,为进一步治疗收入院。患者1个月前有“右侧动脉神经麻痹、视物模糊”病史,余无特殊病史。入院查体:神志清楚,躁动,言语含糊,右侧动眼神经麻痹,眼睑下垂,眼裂小,瞳孔较左侧大,对光反应迟钝,上视下视及内收不能,左侧巴宾斯基征(+),闭目难立征(+),余无明显阳性体征;NIHSS评分5分,FABS评分3分,TM评分21分。入院后实验室检查示:血尿便常规、凝血、糖化血红蛋白、甲状腺功能、免疫5项、同型半胱氨酸、输血八项未见异常,风湿三项示:类风湿因子32.4 IU/mL,CRP和抗“O”均无异常。入院后给予氯吡格雷75 mg,每日1次;阿司匹林100 mg,每晚1次;阿托伐他汀40 mg,每晚1次等治疗。2019年3月5日头颅MRI示:右侧基底节区急性梗死灶,中脑导水管左侧高信号灶。初步诊断:脑梗死?中枢神经系统脱髓鞘?(图3~4),MRA血管成像未见明显异常。腰椎穿刺示:脑脊液蛋白0.58 g/L,白细胞57×106/L,IgG 84.2 mg/L,脑脊液IgG寡克隆带区阳性,脑脊液特异性IgG寡克隆区阳性。最终诊断:多发性硬化(multiple sclerosis,MS)。后加用泼尼松500 mg,静脉滴注,辅以抑酸、补钙等治疗,5 d冲击治疗,后逐渐减量,最终减为泼尼松20 mg/d维持,1个月后复诊,患者无新发阳性体征。
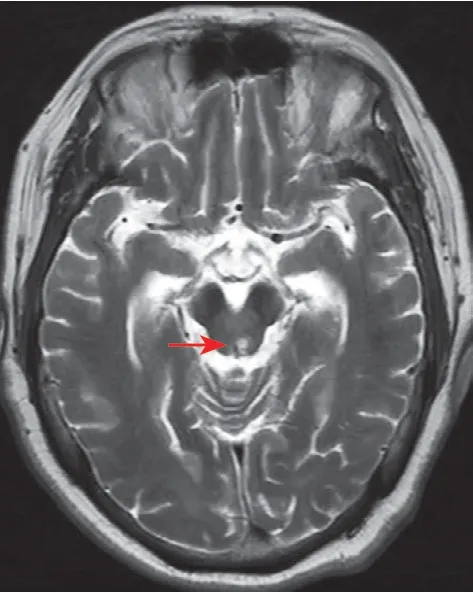
图3 病例3入院后T2WI检查示中脑导水管旁高信号
2 讨论
卒中模拟病在卒中急诊诊疗中占4.8%~31%[2],各种初始检测方法均无法达到100%的敏感度或特异度。常见的卒中模拟病包括癫痫、精神心理障碍、低血糖、面神经炎、偏头痛、颅内感染、颅内占位病变等。
HE是一种与体内自身免疫性甲状腺抗体相关的脑病,主要为女性,发病机制尚不明确,研究显示HE为自身免疫介导的血管炎所致[3];另有研究提示可能是多种抗神经元抗体与甲状腺组织的共有抗原发生直接免疫反应而致病,即自身免疫抗体学说[4]。其临床表现多样,病程呈缓慢进展,易复发,大部分预后良好,因其缺乏特异性,其诊断主要为排除性诊断。与卒中相比,HE卒中样发作有以下特点:以认知及精神行为异常多见,影像学常无定位血管或特异性改变,血清学抗甲状腺球蛋白抗体和抗甲状腺过氧化物酶抗体升高[5],糖皮质激素治疗效果显著[6]。
线粒体病是由于线粒体突变,线粒体呼吸链氧化磷酸化障碍而导致的一组代谢性疾病,以线粒体脑肌病伴高乳酸血症和卒中样发作综合征(mitochondrial encephalomyopathy with lactic acidosis and stroke-like episodes,MELAS)最常见,MELAS临床表现可多系统受累,核心症状为卒中样发作、癫痫发作、头痛和认知功能减退,影像学可出现急性局灶性脑实质损伤,MELAS诊断需结合临床及辅助检查,其中肌肉活检肌纤维中存在的破碎红纤维是确诊线粒体脑肌病的主要依据[7],基因检测为诊断的金标准[8]。与卒中相比,MELAS临床症状具有以下特点:患者常存在多系统受累,部分患者可早期出现肌无力、头痛、呕吐、身材矮小、精神运动发育迟滞等表现,卒中危险因素少,少数有家族史,常伴随痫性发作等。
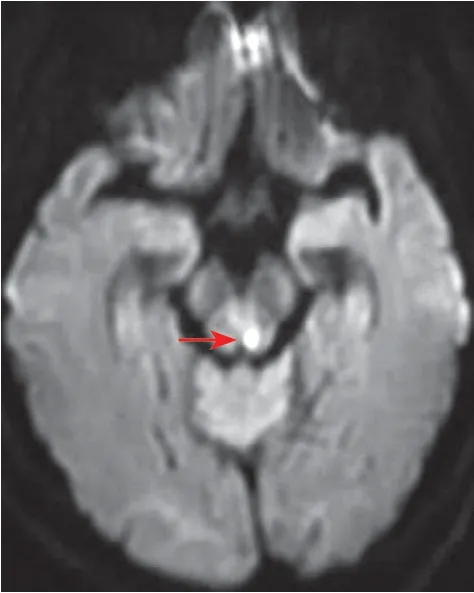
图4 病例3入院后DWI检查示中脑导水管旁稍高信号
MS是一种免疫介导的中枢神经系统脱髓鞘疾病,临床表现具有时间、空间多发性,症状可单一或以多种症状同时出现,由于该病病理生理学的高度异质性,诊断复杂,目前诊断主要采用2017修订McDonald版,内容包括临床症状、MRI检测到的典型病变和实验室检查结果[9],其中脑脊液特异性的寡克隆带区阳性被公认为MS实验室诊断金标准[10]。研究显示在某些MS诊断不确定的情况下,强烈建议脑脊液寡克隆带蛋白电泳检测[11]。MS大多为亚急性或慢性发病,少数以卒中样发病的MS,易误诊为卒中。与卒中相比,卒中样MS有以下特点:发病快,发病即为高峰期,临床症状表现存在时间和空间多发性,在激素治疗之后,肌力可能较快恢复等。
卒中模拟病病因复杂,目前尚无直接证据表明每一种卒中模拟病在超早期接受阿替普酶静脉溶栓都是安全的,因此对于临床工作者,尤其是初级临床工作者,应加强对卒中模拟病的临床认识。对于卒中低危、低NIHSS和TM评分、高FABS评分等可疑卒中患者,尤其缺乏常见的血管危险因素患者,应全面评估患者,追问病史,详细查体,有针对性完善相关检查,警惕卒中模拟病可能,避免漏诊及误诊。

