MSCT分析结直肠癌肠壁浸润程度价值研究
上海交通大学医学院附属第九人民医院放射科(上海 201999)
刘 慧 赵江民*
结直肠癌(colorectal cancer,CRC)是最常见的消化道肿瘤之一,在世界范围内发病率占恶性肿瘤第3位,位于肺癌、乳腺癌之后;死亡率占恶性肿瘤第4位,位于肺癌、肝癌和胃癌之后[1]。2015年中国癌症统计数据显示:我国结直肠癌发病率、死亡率在全部恶性肿瘤中均位居第5位[2-3]。对于不伴有淋巴结和远处转移的T1~T2期患者不推荐使用新辅助治疗,而对于T3、T4期患者新辅助放疗、化疗可以缩小病灶,从而减少复发率,提高生存率[4]。因此,选择简单有效的检查方法对其进行准确的诊断和术前分期十分重要,而近年来国内外关于结直肠癌术前分期的CT研究较多是关于CT结肠成像(computed tomography colonography,CTC)[5-7],但是CTC检查前准备复杂,包括清洁肠道、结肠充气(空气、二氧化碳)、注水扩张等,患者体验差,需要高度的配合,部分患者无法耐受,在临床工作中应用受限。本研究回顾性分析68例我院拟诊断为结直肠癌术前多层螺旋CT增强检查资料,旨在探索日常工作中简便可行的MSCT增强检查在结直肠癌中的应用,评估其在结直肠癌肠壁浸润程度方面的判断价值,结合病理结果,进而探讨MSCT在结直肠患者T分期诊断与病理分期的一致性。
1 资料与方法
1.1 临床资料 收集2016年1月至2018年4月在我院行结直肠根治性手术病人68例,术前均进行腹部增强CT检查拟诊断为结直肠癌,术后病理证实肿瘤为结直肠癌。68例病例中男性45人,女性23人,年龄34~92岁,平均年龄(67.9±12.3)岁,主要临床表现为大便习惯、性状改变,便血,腹痛等。按发生部位分:直肠24例,直肠乙状结肠交界处8例,乙状结肠11例,降结肠3例,横结肠3例,升结肠16例,回盲部3例。按病理类型分:腺癌59例,部分黏液腺癌3例,黏液腺癌5例,鳞癌1例。按分化程度分,低分化12例,中分化53例,高分化3例。
纳入标准:所有病例临床、影像及病理资料齐全;无其他部位原发恶性肿瘤史;术前未接受放疗、化疗及其他治疗手段。
排除标准:CT检查图像不满意影响诊断者;临床、病理资料不全者;有其他部位原发恶性肿瘤;有胃肠道先天畸形等。
1.2 成像方法 所有患者检查前空腹12h,检查前半小时饮用约500mL水。68例结直肠癌病例均采用Philips 256排CT或64排螺旋CT进行平扫及三期增强扫描,扫描范围从肺底向下至耻骨联合。扫描参数:管电压120kV,管电流200mA,层厚3mm,层距3mm,矩阵512×512。增强扫描经肘静脉用高压注射机注射非离子性造影剂碘海醇100mL,速率为4mL/s,三期开始扫描时间分别为动脉期25~28s,静脉期60s,延迟期100~120s。将CT扫描获取的图像数据传送至后处理工作站进行多平面重组(multiplanar reconstruction,MPR)等后处理。
1.3 观察内容及分期标准 CT扫描获取的图像数据传送至后处理工作站进行冠状位、矢状位及斜矢状位重建,观察病灶位置、大小、形态、边缘、边界、强化程度,重点观察肠壁浸润程度及周围组织、器官受累情况。
根据国际抗癌联盟(UICC)和美国癌症联合委员会(AICC)发布的第八版TNM分期,T1期为肿瘤侵犯黏膜下层,T2期为侵犯固有肌层,T3期为肿瘤穿透固有肌层到达浆膜下层或侵犯无腹膜覆盖的直肠旁组织,T4期为肿瘤穿透腹膜脏层,直接侵犯或粘连其他器官、组织。
CT上T分期标准:结合以往研究,普遍观点认为CT上难以将结直肠的黏膜下层与肌层分辨开来,且区分T1与T2期对临床治疗方式的选择区别不大,所以本研究将T1与T2期合为T1-2期,具体影像分期标准如下,T1-2期:肿瘤局限性突入腔内,肿瘤的边缘光整,肠壁外缘光滑,周围脂肪间隙清晰;T3期:病灶强化达管壁全层,与浆膜面间没有可以分辨的密度差,浆膜面形态规则,外缘光滑,周围间隙清楚;T4期:浆膜面不规则,突出于肠管轮廓外的团块,周围间隙不清或侵犯膀胱、输尿管等邻近器官[8-10]。
1.4 统计学方法 所有数据采用SPSS 17.0版软件包进行统计学处理,对术后病理结果与CT诊断的结果,采用Kappa一致率进行检验:Kappa值<0.4时,表示一致性差;0.4≤Kappa<0.75 时,表示一致性较好;Kappa≥0.75 时,表示一致性非常好。
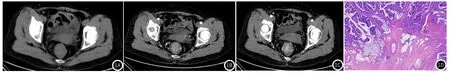
图1 患者1病灶CT影像图。
2 结 果
2.1 影像表现 结直肠癌在CT上表现为肠壁不均匀增厚、结节样肿块,部分向肠腔内突入或突出于肠轮廓外,伴有管腔不同程度狭窄。病例平扫CT值平均约(35.76±6.47)HU,增强后中度强化,其中动脉期CT值平均约(64.43±14.36)HU,门脉期CT值平均约(73.79±12.71)HU,病灶向周围脂肪间隙浸润表现为浆膜面不规则,脂肪间隙密度增高,可见条索状及斑片状密度增高影。
典型病例分析1:患者,女,61岁,便血一周,平扫(图1A)可见直肠中下段腔内软组织肿块影,管腔狭窄,增强后动脉期(图1B-1C)明显强化,强化未达全层,周围脂肪间隙清晰,并见直肠上动脉供血。CT诊断为T1-2期,术后病理证实为直肠腺癌,浸润至黏膜下层。
典型病例分析2:男,87岁,无明显诱因下排便习惯改变1月余。横断位(图2A)及冠状位(图2B)可见病灶位于直肠上段,与左侧输尿管分界不清(箭头);术后证实病灶穿透浆膜层,侵犯左侧输尿管。
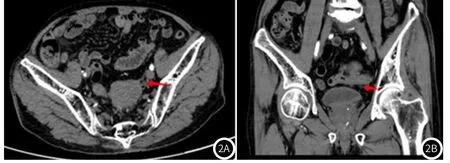
图2 患者2病灶CT影像图
2.2 CT上T分期结果 纳入的68例CT上T1-2期9例,T3期14例,T4期45例。根据术后病理结合T分期标准,T1-2期10例,T3期8例,T4期50例,CT的T分期与病理T分期比较见表1。
以病理研究为标准,病理诊断10例T1-2期病例中有3例在CT上高估为T3期,CT对T1-2期CRC诊断准确率为70%。病理诊断共8例,T3期病例中有2例在CT上低估为T1-2期,诊断准确率为80%。在50例术后病理诊断为T4期病例中,有5例低估为T3期,诊断准确率为90%。与病理T分期比较,MSCT总诊断准确率为85.2%,Kappa值为0.687,一致性较好。
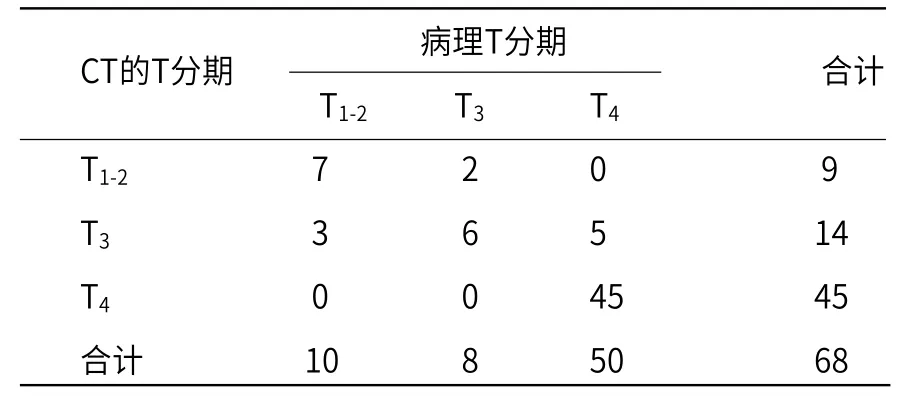
表1 CT与病理T分期比较
3 讨 论
结直肠癌早期可无明显症状,病情发展到一定程度可出现排便习惯改变、粪便性状改变、腹痛或腹部不适及肠梗阻相关症状。多层螺旋CT在重建的基础上可进行MPR重建,通过逐帧仔细观察,可以较准确地分析肿瘤肠壁浸润情况,在结直肠癌的诊断及分期中应用广泛。跟肠镜检查比较,MSCT优势在于不仅可以有效显示肿瘤的大小、位置及肠腔内的病变情况,还能显示管腔外的情况尤其是肠壁浸润程度。需要注意的是,直肠中下段为腹膜外位器官,以腹膜返折处为界,在分析增强CT资料时其T3、T4期标准有所不同。T3期为肿瘤浸润至直肠旁组织,T4期表现为肿瘤直接侵犯或粘连其他器官或组织。另外,以往研究显示[11-13],1%~7%结肠癌存在同步性癌肿,对于肠壁增厚或肿块形成引起管腔明显狭窄,肠镜无法通过梗阻段者,CT还可以显示闭塞性肠癌梗阻近端肠管情况[14]。
对于结直肠癌病例,特殊胃肠道检查可以增加检查敏感性,但在日常工作中常规推广有一定困难,本研究采用一种简单、方便、无创的检查技术观察肠壁及周围浸润情况,从而评估日常工作中CT对结直肠癌T分期的价值。与肠道内容物不同的是,肠道肿块尤其是息肉样腔内癌与肠壁是连续的,在冠状位上更易观察[15]。以病理研究为标准,病理诊断10例T1-2期病例中有3例在CT上高估为T3期,其中1例位于乙状结肠,1例位于直肠乙状结肠交界处,1例位于直肠,CT对T1-2期CRC诊断准确率为70%。病理诊断共8例T3期病例中有2例在CT上低估为T1-2期,诊断准确率为80%,均位于直肠中下段。这个部位无腹膜包裹,根据TNM分期标准,直肠中下段T3期肿瘤诊断标准为浸润至肠周脂肪组织,但无临近器官受累,回顾影像资料后发现,这2例病灶肠壁表面光滑,无明显肉眼可见浆膜受累,考虑与肿瘤微浸润所致种植有关。在50例术后病理诊断为T4期病例中,有5例低估为T3期,诊断准确率为90%,其中结肠3例,直肠乙状结肠交界处2例,仔细回顾这5例病灶,可以见到浆膜面毛糙,可见小斑片结节样、条索样高密度影。此外,CRC累及邻近器官为T4b期,主要表现为病灶与邻近器官及组织粘连、分界不清。
超过60%的CRC源于腺瘤,最初为良性病变,随着恶变风险的增加而演变为癌,而CRC患者中又存在多种基因型和表型差异使得个体对不同治疗方式有所差异[16-17]。以往研究显示,病理分期是影响结直肠癌预后的最重要因素[18-20],易呈浩等[21]与Mori[22]发现ⅡC期的5年生存率比IIIA、IIIB期5年生存率明显降低,提示肿瘤原发灶浸润深度对预后的重要影响,其中T分期是关键因素。本研究中T3、T4期病例较多,通过分析病灶浸润深度识别出T3、T4期,以期对选择正确的手术方式和新辅助放化疗有所提示,从而提高治疗效果,判断预后。
综上所述,通过结合多平面重组技术,分析病灶肠道浸润情况,CT可以对结直肠癌进行有效T分期,与病理结果比较,一致性较好。是否突破浆膜累及周围组织对于有腹膜包裹肠段T3、T4期肿瘤鉴别意义重大,但单纯周围组织内条索影不一定是阳性表现,可能与炎症反应相关,需要结合浆膜面是否光整、有无斑片结节影具体判断。对于直肠中下段无腹膜覆盖部分肠管则应注意T3、T4期分期与常规结直肠癌有所不同。

