磁共振扩散峰度成像联合磁共振加权成像在前列腺癌早期诊断中的应用*
绵阳市中心医院放射科(四川 绵阳 621000)
周 莹 陈 娇 贺国庆 张顺源 刘启榆*
前列腺癌(prostate cancer,PCa)是临床上常见的泌尿系恶性肿瘤之一,随着人口老龄化,PCa的发病率逐年上升,对患者的生活质量造成严重影响[1-2]。PCa发病较为隐匿,疾病发展缓慢,在中早期无明显临床症状,一旦出现临床症状,肿瘤一般已发展至晚期,对患者预后造成严重影响[3-5]。因此,早期诊断对提高患者的治疗效果、改善生活质量具有重要作用。随着影像检查技术的发展,磁共振成像(magnetic resonance imaging,MRI)在PCa的诊断中发挥重要作用[6-8]。因此,本研究通对3.0T磁共振扩散峰度成像(diffusion kurtosis imaging,DKI)联合磁共振加权成像(diffusion weighted imaging,DWI)在PCa患者诊断的应用进行了探讨。
1 资料与方法
1.1 一般资料 选取2018年1月至2019年1月我院收治的前列腺疾病患者100例,所有患者均进行MRI检查,并均于超声引导下进行前列腺组织穿刺活检。其中确诊42例PCa患者为观察组,年龄53~82岁,平均年龄(70.41±5.24)岁;58例前列腺增生患者为对照组,年龄52~81岁,平均年龄(69.54±5.31)岁。
纳入标准:所有患者均进行MRI检查,结果成像清晰,可观察到有效病灶;所有患者均是首次在超声引导下进行活检穿刺,进行病理分析;所有患者在检查前均未进行手术治疗、放化疗;所有检查患者家属均签署相关知情同意书。排除标准:检查前2周进行过病理检查、手术治疗或放化疗者;MRI图像不清晰,无法判断者。
1.2 检查方法 所有患者均采用西门子3.0T(MAGETOM Skyra)磁共振进行扫描,扫描前患者适量饮水,采取仰卧位,平静状态下从趾骨联合处对前列腺进行扫描。扫描序列包括横轴位与矢状位。扫描参数:横轴位T1WI(TR 350ms,TE 2.71ms)、T2WI(TR 7000ms,TE 86ms)、FLAIR(TR 8000ms,TE 103ms),层厚5.5mm,视野(FOV)240×180,矩阵320×320。DWI采用高分辨率3D梯度回波序列,成像参数:TR 28ms、TE 20ms,层厚1.3mm,层间隔1.3mm,翻转角15°,FOV180×180,矩阵384×240,层数81层,b值为1000s/mm2。DKI(TE 64ms,TR 4500ms),矩阵128×128,FOV30cm×30cm,层厚3mm,层间距0mm,扫描时间20min,b值为0、500、1000、1500s/mm2。
1.3 观察指标 (1)对所有患者扫描后的数据进行相关分析,分析DKI的参数(FA、MD、Da、Dr、MK、Ka、Kr),并对表现扩散系数(apparent diffusion coefficient,ADC)值进行测量和分析。(2)对PCa患者的受试者操作特征曲线(receiver operating characteristic,ROC)进行分析,判断DWI及DKI在诊断PCa患者的特异度及敏感度;(3)对两组患者进行PI-RADS评判标准进行评分[9]。1分:临床显著性癌极不可能,几率非常低(DWI:ADC及DWI均未见明显异常信号;T2WI:扫描区均中等信号);2分:癌不太可能存在,几率较低(DWI:ADC较模糊低信号;T2WI:局限性低信号或包膜内增生结节);3分:癌可能存在,几率中等(DWI:ADC上轻微或中低等信号,DWI上轻微高信号;T2WI:病灶信号不均,边界不清);4分:癌可能存在,几率较高(DWI:ADC上明显低信号,DWI上明显高信号,病灶直径小于1.5cm;T2WI:信号不清,信号均匀,中等低信号,病灶直径小于1.5cm);5分:癌极有可能存在,几率极高(DWI:表现同4分者,病灶直径大于1.5cm,有明显扩散受限征象;T2WI:表现同4分者,病灶直接大于1.5cm,有明显扩散受限征象)。
1.4 统计学方法 采用SPSS 22.0统计软件进行统计,计数资料采用χ2检验,计量资料以表示,两样本比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 PCa及前列腺增生患者DKI各参数值及ADC值比较 由表1可知,与对照组患者比较,观察组患者MK、Ka、Kr、FA值均明显升高,MD、Da、Dr及ADC值均明显降低,差异具有统计学意义(P<0.05)。
表1 两组患者DKI各参数值及ADC值比较

表1 两组患者DKI各参数值及ADC值比较
注:*表示与对照组比较,差异具有统计学差异(P<0.05)。
指标 对照组(n=58) 观察组(n=42) t值 P值DKI MK 0.56±0.07 1.04±0.19* 17.681 0.000 Ka 0.46±0.06 1.06±0.25* 17.622 0.000 Kr 0.57±0.07 0.96±0.17* 15.748 0.000 FA 0.15±0.04 0.25±0.37* 2.046 0.043 MD 2.34±0.33 1.18±0.48* 14.325 0.000 Da 2.71±0.28 1.14±0.45* 21.465 0.000 Dr 2.18±0.34 1.47±0.47* 8.770 0.000 ADC 1.41±0.66 0.98±0.22* 4.057 0.000
2.2 DWI联合DKI对PCa患者诊断的敏感度及特异度分析由表2可知,在PCa患者中MK、Ka、Kr特异度最高,MD、Da、Dr及ADC的敏感度最高。

图1 MRI联合DKI前列腺成像图注:图1A DWI不均匀高信号;图1B T2WI均匀低信号;图1C DKI示均匀低信号;图1D MRI增强示不均匀强化。
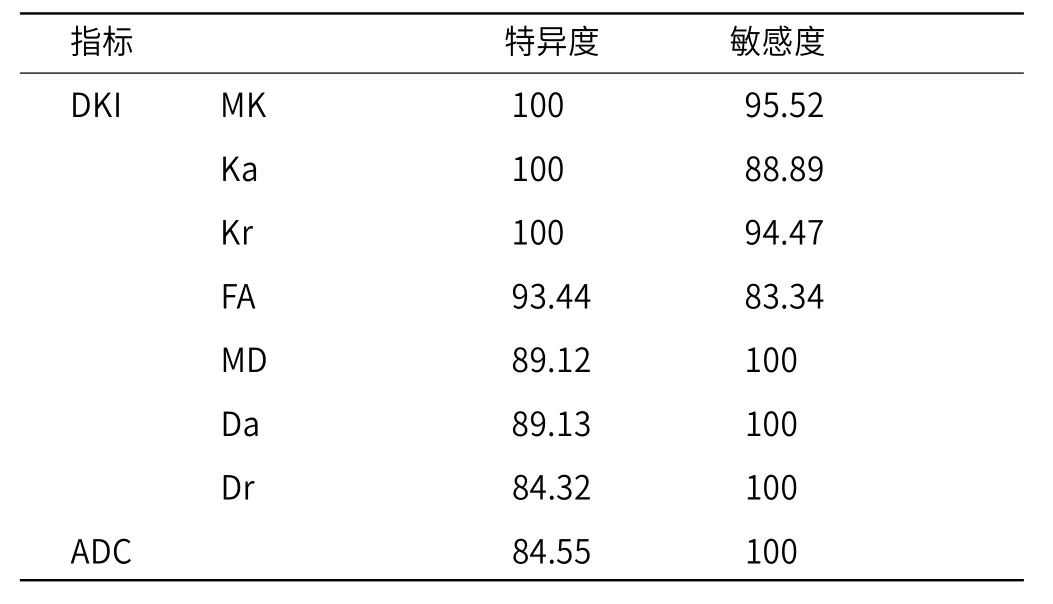
表2 DWI联合DKI对PCa患者诊断的敏感度及特异度分析(%)
2.3 两组患者PI-RADS评分结果分析 通过DWI联合DKI对两组患者的DWI、T2WI、DWI+T2WI评分进行PI-RADS比较,AUC值分别为0.921、0.932、0.935,经MedCalc分析,T2WI与DWI、DWI+DKI之间差异具有统计学意义(P<0.001),最佳评价阈值为PI-RADS评分为3分(表3)。
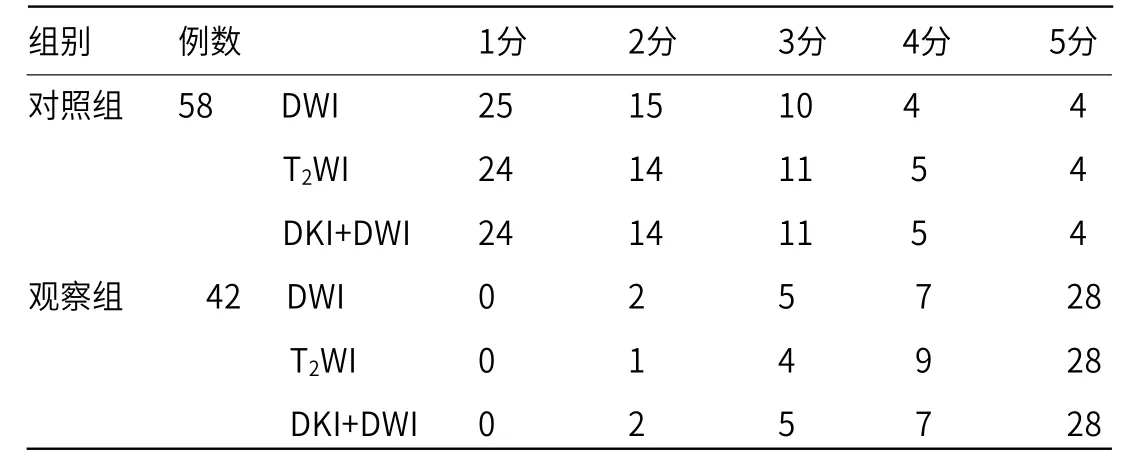
表3 两组患者PI-RADS评分结果分析(n)
2.4 MRI联合DKI前列腺成像分析 见图1。
3 讨 论
随着人们生活水平变化及人口老龄化趋势的逐渐加重,前列腺癌的患病率逐年上升,因此,及早检查并诊断出前列腺癌对患者的生存质量及治疗极为重要。目前,临床上常通过MRI检查,并辅助病理活检对前列腺疾病进行诊断。随着医学技术的进步,MRI成像技术取得重大发展,其中DKI、DWI等在前列腺疾病诊断准确率不断提高[10-12]。DWI是以高斯分布为模型的MRI成像技术,通过组织内水分子的扩散达到成像目的,但随着扩散信号的递减,较容易造成误差[13-14]。DKI作为当下MRI的新型成像技术,以非高斯分布为基础,可有效通过水分子的扩散程度,能有效提高对微组织结构成像的敏感度,接受更多的反应信号信息[15]。DKI通过二阶联合四阶三维张量反应组织内水分子的扩散程度。DKI最早应用于神经系统疾病的辅助检查,临床研究发现,DKI能明显提高脑胶质细胞瘤患者MK值的敏感性和特异性[16-17]。
本研究通过观察前列腺癌与前列腺增生患者发现,与前列腺增生患者比较,前列腺癌患者DKI中MK、Ka、Kr、FA值均明显升高,MD、Da、Dr及ADC值均明显降低,差异具有统计学意义(P<0.001)。MK值表示水分子扩散峰度的平均值,MK值越大表示扩散信号受限制越严重;MD表示水分子的平均扩散系数,MD值越低表示扩散信号受限制越严重。本研究中,随着前列腺癌组织的生长,癌组织细胞的排列方式紊乱,癌组织含水量逐渐减少,使组织中水分子扩散明显受限,从而导致前列腺癌组织MK值升高,MD值明显降低,而MD、Da、Dr敏感度最高,MK、Ka、Kr特异度最高,进一步说明DKI可有效提高前列腺癌患者的敏感度和特异性,这与相关研究相一致[18-19]。PI-RADSV2评分机制对前列腺癌的诊断也具有较高的敏感性及特异性[20-21],这与本研究中DKI的判断结果相一致。
综上所述,DKI作为一种新型MRI成像技术,能更加有效提高对前列腺癌患者诊断的敏感性及特异性,在前列腺癌疾病的定位、诊断及预后判断中发挥重要作用,有一定的临床应用价值。

