不同分期结直肠癌间质病理特征与预后及淋巴结转移的相关性
王景林,刘雪影,李 珀,项一宁,李大欢,许良璧
结直肠癌是临床上常见的恶性肿瘤之一。结直肠癌的淋巴结转移,与患者的预后密切相关。探寻结直肠癌淋巴结转移的危险因素,是完善结直肠癌“精准治疗”的重要一环。既往文献报道[1],可预测结直肠癌预后及淋巴结转移风险的标志物有40多种,目前美国癌症协会(American Joint Committee on Cancer,AJCC)第8版 分 期 系统推荐推荐肿瘤退缩评分、环周切缘等病理学标志以及K-RAS基因突变、N-RAS基因突变、v-raf鼠类肉瘤滤过性病毒致癌基因同源体B1(v-raf murine sarcoma viral oncogene homolog B1,BRAF)基因突变等分子生物学标志作为结直肠癌预后及疗效预测的指标,但尚缺乏结直肠癌间质病理特征与结直肠癌预后及淋巴结转移关系的系统分析。本研究拟通过对不同分期结直肠肿瘤患者的间质病理特征[肿瘤-间质比(tumorstroma ratio,TSR)、肿瘤出芽(tumor budding,TB)、肿瘤浸润前端癌相关性成纤维细(cancer associated fibroblasts,CAFs)细胞形态以及肿瘤腺体富集区域癌性间质反应(desmoplastic reaction,DR)程度]与患者预后及淋巴结转移的相关性进行分析,评估间质病理特征与结直肠癌预后及淋巴结转移的关系,从空间分布、时间分布、不同组成部分就癌性间质的特征进行探索性研究,进一步了解癌性间质在结直肠癌进程中发挥的作用,及其与淋巴结转移、预后的相关性,以期为结直肠癌患者的分层管理,提供新的理论依据。
1 资料与方法
1.1 一般资料
本研究为回顾性研究。共收集148例2014—2017年由贵州医科大学附属医院收治的,经内镜和(或)外科手术取得组织标本后病理确诊为结直肠癌患者的资料。其中男性73例,女性75例;中位年龄64岁(范围:26~87岁)。患者的基本临床资料见表1。
所有患者的间质病理特征来源于患者既往手术后医院保存的用10%甲醛溶液处理后的石蜡包埋组织,选用有代表性的组织块重新进行连续切片后行HE染色。该回顾性研究设计及实验方案符合赫尔辛基宣言要求,并得贵州医科大学附属医院伦理委员会批准(批准文号:2019003K)。
1.2 纳入和排除标准
样本量计算:假设在α=0.05(双侧)的显著水平下有90%的把握度检测到组间差异,PASS样本分析软件计算显示,本研究最少需要44例患者(若为2组则分别为22例)即可满足研究需求。收集高级别上皮内瘤变(high grade intraepithelial neoplasia,HGIN)和(或)或结直肠腺癌者的疾病信息,如性别、年龄、吸烟状况、饮酒状况、肿瘤部位、是否合并淋巴管浸润、是否合并神经/血管侵犯、TNM分期浸(根据AJCC制订的第8版结直肠肿瘤分期标准进行判定)。
纳入标准:(1)年龄>18岁,性别不限;(2)于本院内镜中心行内镜切除、内镜下黏膜切除术、内镜下黏膜剥离术或外科手术(根治手术、姑息手术)治疗者;(3)术前未行放疗或化疗、生物及肿瘤免疫治疗者;(4)术后有完整的临床病理资料,且明确诊断为HGIN和(或)或结直肠腺癌者。
排除标准:(1)明确诊断为炎性反应性肠病恶变、Peutz-Jeghers综合征、家族性腺瘤性息肉病及Lynch综合征的患者;(2)合并严重的心、肺基础疾病者;(3)合并严重的血液系统疾病及凝血功能障碍者;(4)妊娠状态者;(5)因术后并发症死亡者;(6)术后病理活检诊断为非腺癌的其他肿瘤者。
1.3 随访资料
本研究采用电话随访的联系方式,随访截止日期为2019年11月10日。随访内容包括了解患者术后的随诊及死亡情况,并进行可能的随访/复查的宣教。随访的终点为随访完成的日期或患者的死亡日期,生存时间定义为总生存(overall survival,OS)期,以月为单位。至随访结束时失访10例(随访率为93.24%)。
1.4 HE染色及结直肠癌间质病理特征相关标志物的结果判定
调阅患者既往病理诊断资料,阅片后选取含肿瘤浸润最深部位的组织块,重新切片后行HE染色。HE染色切片由2位高级职称病理诊断医师分别独立阅片复诊。如2位诊断医师就同一张切片存在不同意见,需经讨论后统一。
TSR的判定标准[2-3]:在光学显微镜下(放大倍数为100倍)选择肿瘤组织内间质浸润最明显的区域,评估每个视野内肿瘤细胞所占面积(剩余部分即为间质所占的面积),并计算肿瘤组织内部TSR(TSR=肿瘤实质细胞所占视野面积百分比/间质细胞所占视野面积百分比),以间质所占百分比最高的TSR作为最终取值;为排除癌旁组织的干扰,所选区域的间质四周必须有肿瘤组织包绕。将TSR≥1(即肿瘤实质占百分比≥50%)定义为间质稀少组,将TSR<1(即肿瘤实质占百分比<50%)的病例定义为间质丰富组(图1A)。
TB指在光学显微镜下观察发现,肿瘤浸润前端沿间质内散在的像芽孢一样的未分化形态的单个肿瘤细胞或小灶状肿瘤细胞群[2]。出芽1级0~4个细胞为出芽1级,5~9个细胞为出芽2级,10个以上细胞或细胞团为出芽3级(图1B)。
肿瘤浸润最前端CAFs形态的判定标准[3]:首先在低倍光学显微镜下(放大倍数为50倍)找到肿瘤浸润最前端(肿瘤浸润最深)区域后,切换至高倍镜下(放大倍数为200倍及400倍)观察肿瘤细胞和肿瘤腺体间间质的形态。成熟的癌性间质由细长的胶原纤维和纺锤形成纤维细胞组成,而未成熟的癌性间质由黏液样成分、瘢痕样胶原束、大而丰满的CAFs细胞组成。成熟的癌间质成分/未成熟的癌间质成分≥50%定义为成熟;<50%者定义为不成熟(图1C)。
肿瘤腺体富集区域癌性DR程度是否成熟的判定[4]:肿瘤腺体最富集区域参考TSR判定标准,即首先在低倍光学显微镜下(放大倍数为100倍)下找到肿瘤腺体最密集区域,随后切换至200倍及400倍下观察肿瘤细胞和腺体间质的形态。癌性间质反应的成熟度则根据肿瘤-间质中CAFs细胞和细胞外基质(extra cellular matrix,ECM)的比例,将肿瘤间质中致密粉染的胶原基质构成纤维母细胞(梭形细胞纤细、波浪样结构、核仁不明显)占细胞总数比例<10%定义为成熟型,肿瘤间质中活化的纤维母细胞(胖梭形形态伴显著细胞核和大核仁)>50%定义为不成熟型(图1D)。
1.5 统计学方法
采用R3.6.2(https://www.r-project.org)、R-studio(https://rstudio.com)与SPSS 25.0统 计学软件对研究数据进行统计学处理。组间生存率差异的比较采用log-rank法;用Kaplan-Meier法绘制生存曲线并计算平均OS期和中位OS期,Wilcoxon秩和检验法评价2组非参数资料间的差别,以P<0.05为差异有统计学意义。用COX风险比例回归模型评估患者间质病理特征(肿瘤分化程度、TSR、TB、肿瘤浸润前端CAFs细胞形态、肿瘤腺体富集区域DR程度)与生存时间的相关性,Logistics回归分析评价患者病理特征与淋巴结转移的相关性。
2 结果
2.1 生存时间
本回顾性研究中共纳入148例结直肠癌患者,平均OS期为(43.66±20.13)个月(范围:1~67个月),中位OS期为48.50个月。
2.2 患者临床与病理资料及其与生存相关性
148例患者中,TSR≥1者114例(77.03%);TB为1级 者58例(39.19%),2级 者53例(35.81%),3级者37例(25.00%);肿瘤浸润前端CAFs细胞形态成熟者42例(28.38%);肿瘤腺体富集区域DR反应程度成熟者85例(57.43%)。148例患者中,淋巴结转移阴性者86例(58.11%),淋巴结转移N1者26例(17.57%),淋巴结转移N2者36例(31.32%)(表1)。
Kaplan-Meier法生存曲线分析结果(图2)显示,神经或血管侵犯、淋巴结转移、TNM分期、肿瘤分化程度、TSR和TB均与OS期有关,差异有统计学意义(P值均<0.001)。
2.3 直肠癌患者预后的COX多因素回归分析
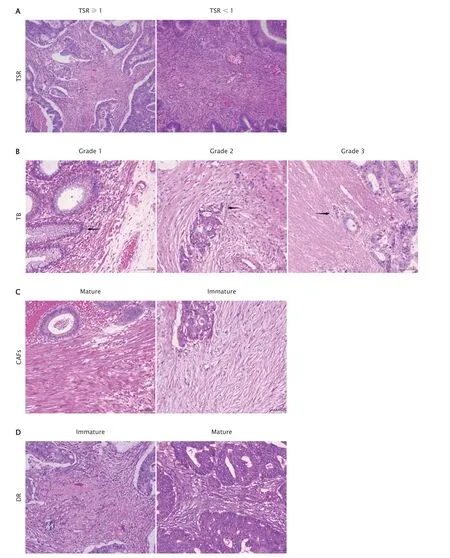
Fig.1 The tumor-stroma ratio (TSR) (A,×100),tumor budding (TB) (B,×200),morphology of cancer associated fibroblasts (CAFs) at the frontline of vertical invasion (C,×200) and desmoplastic reaction (DR) at the centre of tumor glands (D,×200) in colorectal cancer tissues were observed by HE stainging.图1 HE染色后观察结直肠癌组织中TRS(A)、TB(B)、肿瘤浸润最前端CAFs形态(C)以及肿瘤腺体富集区域癌性DR程度(D)
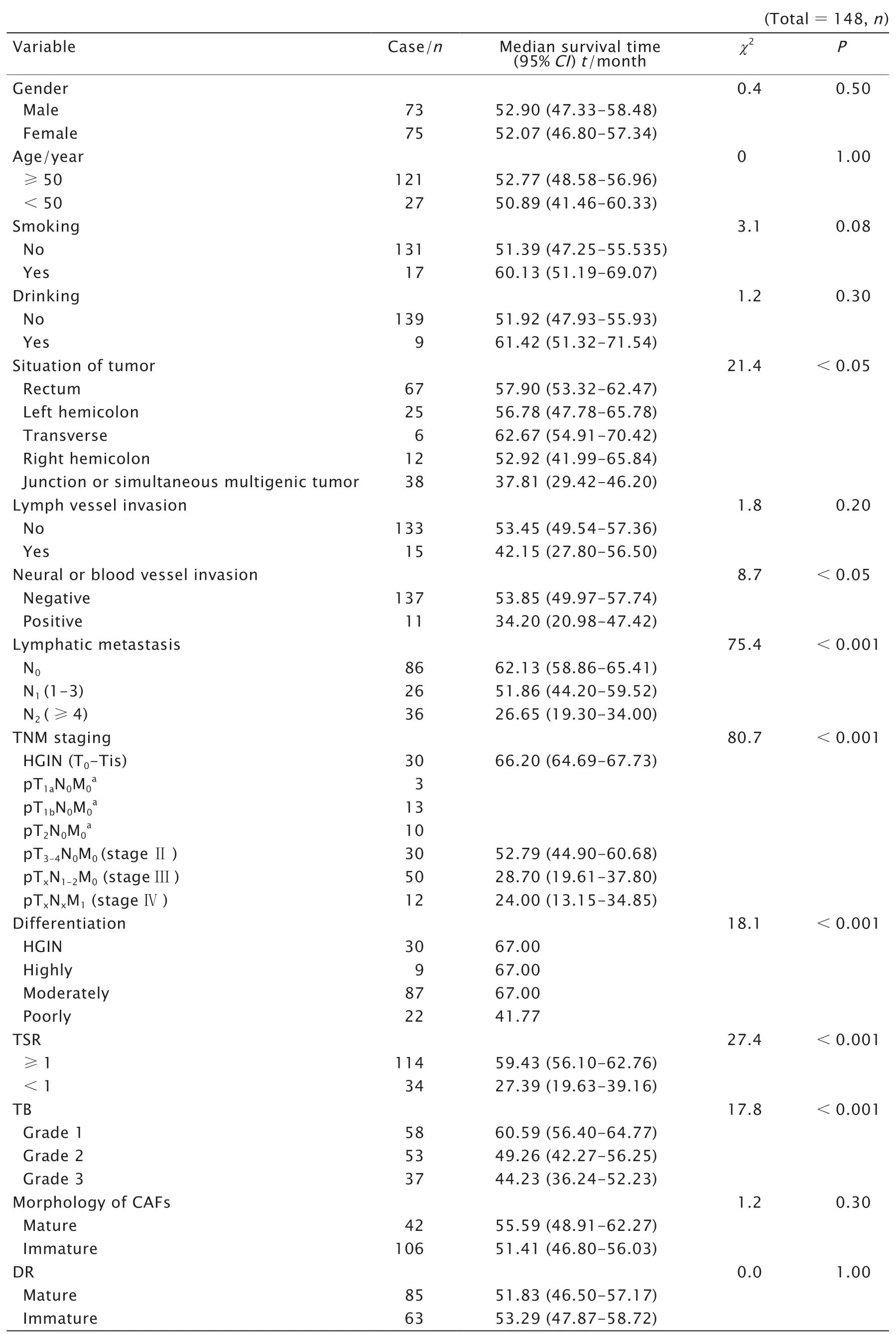
表1 患者的临床及病理特征Table 1 The clinical and pathological features of patient with colorectal cancer
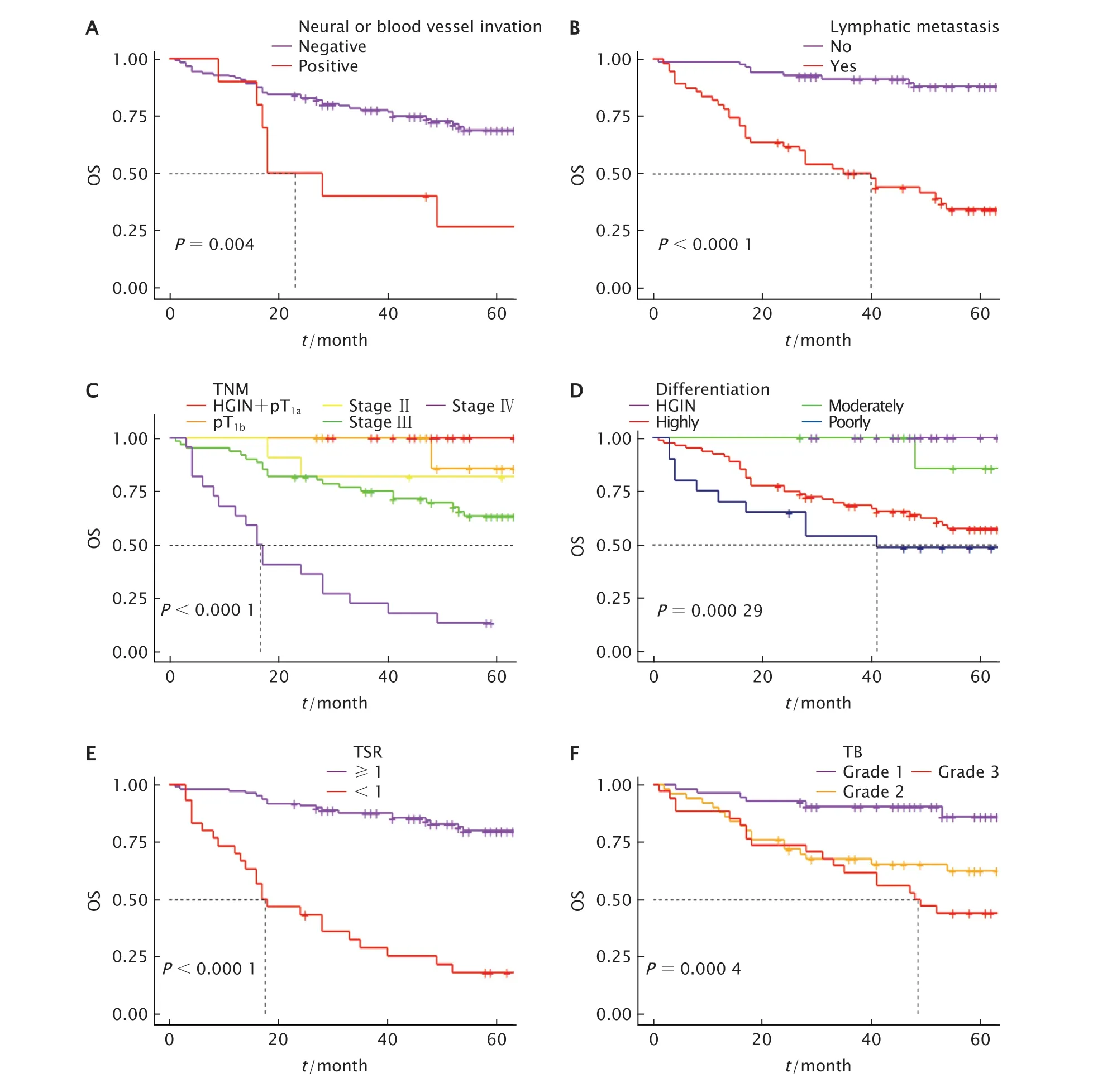
Fig.2 The overall survival (OS) curves of 148 patients with colorectal cancer on neural or blood vessel invasion (A),lymphatic metastasis (B),TNM staging (C),differentiation (D),tumor-stroma ratio (TSR) (E)and tumor budding (TB) (F) were analyzed by Kaplan-Meire.图2 Kaplan-Meier法分析神经或血管侵犯侵犯(A)、淋巴结转移(B)、TNM分期(C)、分化程度(D)、TSR(E)和TB(F)与患者OS期的相关性
COX比例风险回归模型分析结果(表2)显示,淋巴结转移、TSR与TB是影响结直肠癌患者预后的风险因素(P<0.001,P<0.05和P<0.05)。
2.4 结直肠癌间质病理特征情况
浸润深度、肿瘤分化程度、TB和淋巴结转移在不同TSR患者中的差异有统计学意义(P值均<0.001)。TSR<1(34例)的结直肠癌患者中,垂直浸润深度均>pT2,肿瘤分化程度为中分化者20例(58.82%)及低分化者14例(41.18%),且均合并淋巴结转移(34例,100.00%)(表3)。
86例无淋巴结转移结直肠癌患者的TSR均≥1(100.00%),TSR、TB和肿瘤浸润前端CAFs细胞形态在有淋巴结转移或无淋巴结转移组中的表达差异有统计学意义(P值均<0.05);62例有淋巴结转移的结直肠癌患者中,TSR<1者34例(54.84%),为未成熟的肿瘤浸润前端CAFs细胞形态者51例(82.26%)(表4)。
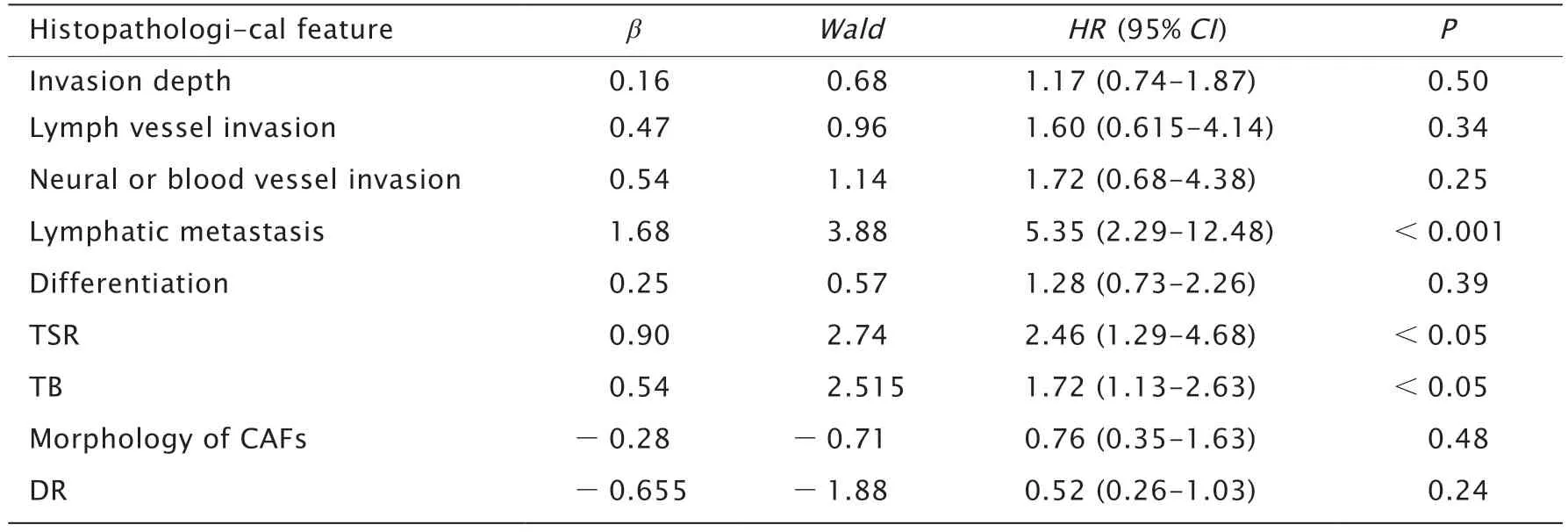
表2 COX多因素回归分析病理特征与结直肠肿瘤患者预后的相关性Table 2 COX proportional hazards mode analysis of the relationship between the pathological feature and the prognosis of patient with colorectal cancer
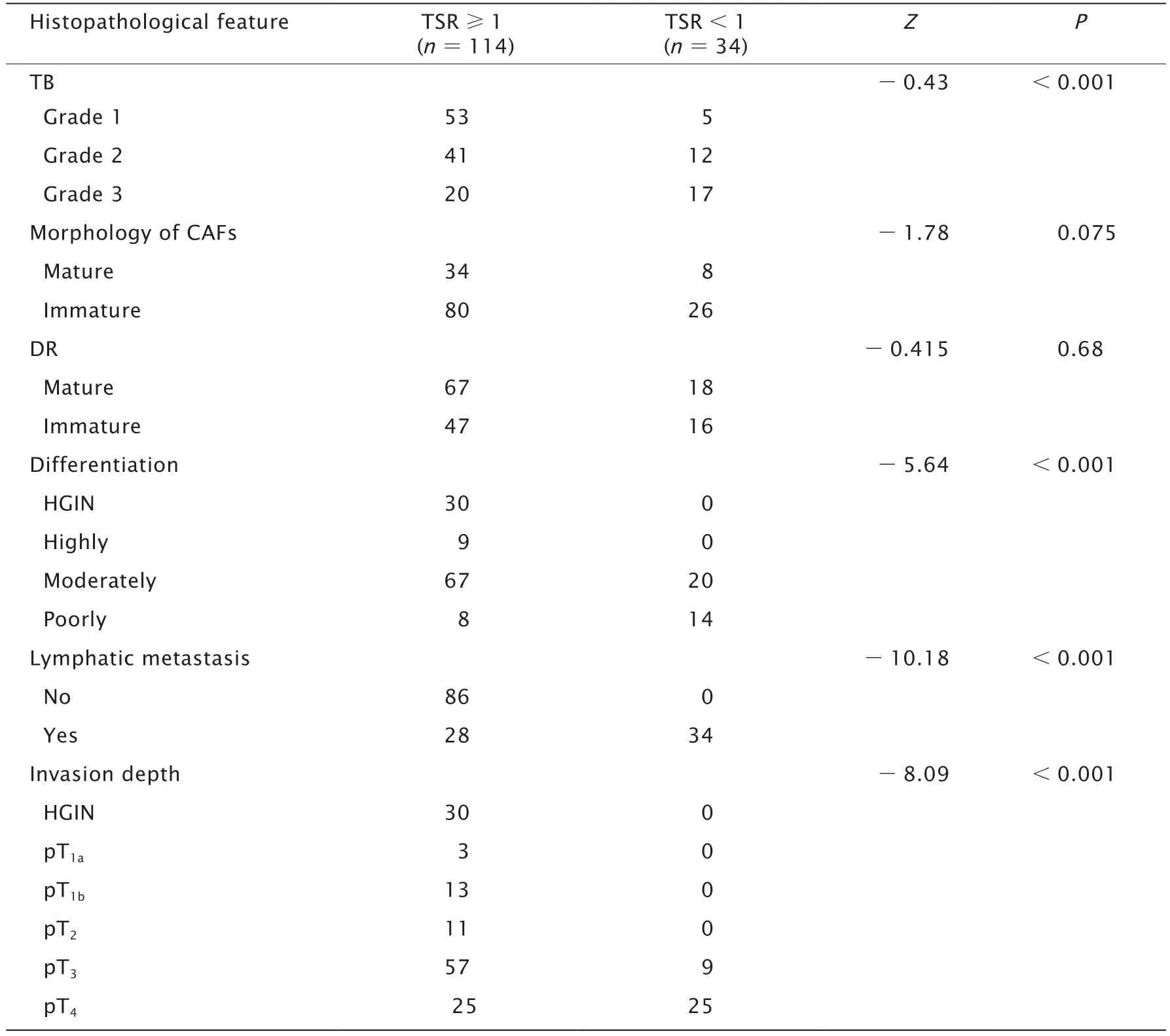
表3 TSR的不同组别之间间质病理特征的差异Table 3 Discrepancy of the stroma pathological feature expression between the different group of TSR

表4 淋巴结转移的不同组别之间间质病理特征的差异Table 4 Discrepancy of the stroma pathological feature expression between the different group of lymphatic metastasis
2.5 结直肠癌患者间质病理特征与淋巴结转移的关系
对患者的一般情况及间质病理特征进行Logistics单因素分析,结果(表5)显示神经或脉管侵犯、肿瘤分化程度、TSR、TB、肿瘤浸润前端CAFs细胞形态具有统计学意义(P值均<0.05)。将上述指标纳入多因素Logistics回归分析,结果显示肿瘤分化程度与TSR是影响结直肠癌患者淋巴结转移的风险因素。
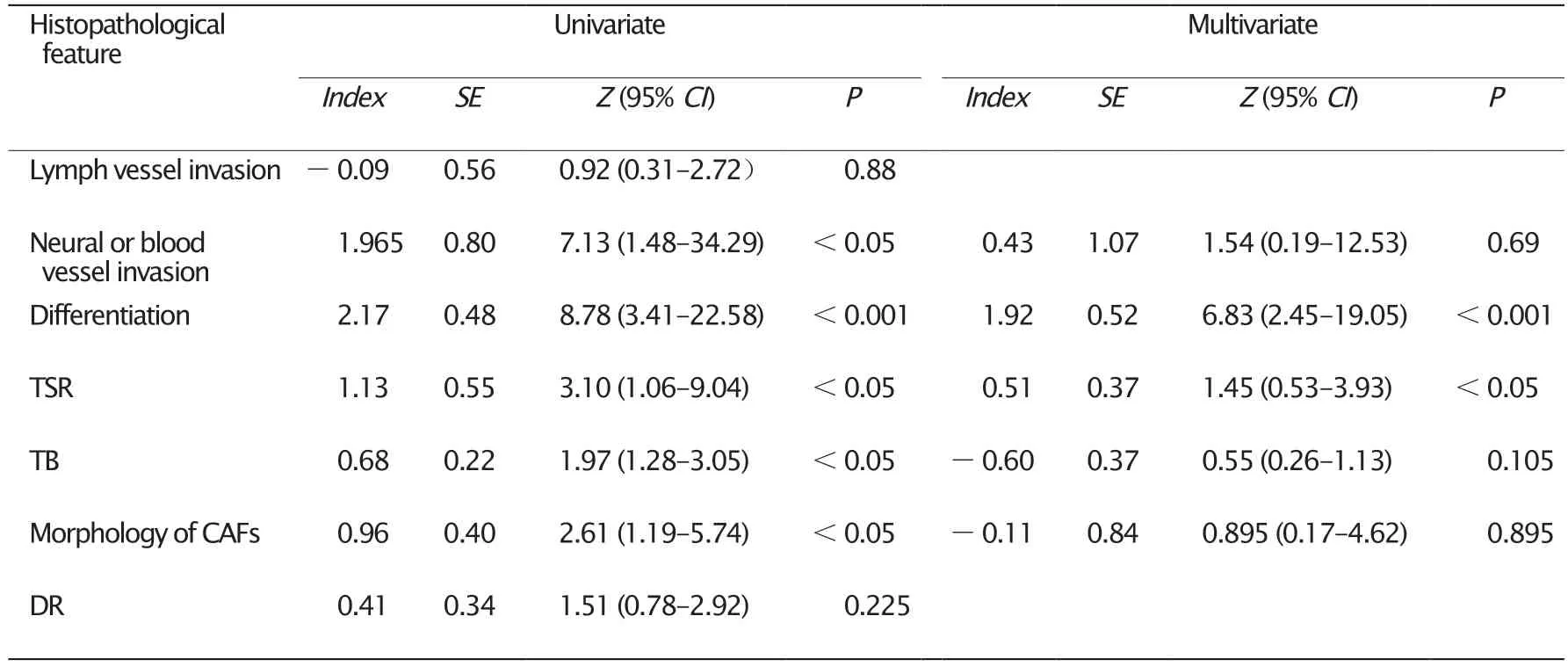
表5 Logistics回归分析评估患者临床及病理资料对淋巴结转移的影响Table 5 Logistics regression analysis of the relationship between the clinical and pathological feature and lymphatic metastasis
3 讨论
据Globol Cancer Statistics 2018[5]的统计,结直肠癌以10.2%的新发病率位于所有肿瘤中的第3位,而死亡率则是9.2%,位居肺癌之后的第2位。关于结直肠肿瘤预后及淋巴结转移因素的研究,对结直肠肿瘤的诊断和精准治疗有着重要的意义。既往关于结直肠癌的研究主要集中于肿瘤的实质细胞。肿瘤的间质通常指代肿瘤微环境(tumor microenvironment,TME),它由CAFs与ECM构成。随着对肿瘤认识的不断加深,肿瘤间质对肿瘤的生长、浸润、转移以及细胞免疫等多个层面的影响被不断地揭示[6]。当肿瘤处于早期局限于黏膜内时,肿瘤细胞的持续出现和积累仍可导致局部组织呈现出反复的“损伤-愈合”过程[7];肿瘤细胞释放的生长因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板衍生生长因子(platelet derived growth factor,PDGF)及成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)等,一方面可使原有静止的成纤维细胞被肿瘤细胞激活并重构,另一方面则促进ECM的增生。此时CAFs仍未完全激活,ECM未大量增生,在TME上则表现为间质比例显著少于肿瘤实质。有研究发现,在癌症的早期发展过程中间质可能起到阻碍原位癌的侵袭及转移的[8-10]。随着肿瘤的进一步发展,EMT持续发生,不断地导致肿瘤周围原有静止成纤维细胞逐渐向CAFs转化,并导致ECM的持续增长,间质比例逐渐升高。肿瘤间质对于肿瘤的浸润、转移的影响贯穿肿瘤的整个演进过程。
在本研究中,采用TSR来“定量”观察间质。所有HGIN及高分化腺癌者的TSR均≥1,34例TSR<1者均为浸润深度>pT2,分化程度为中分化-低分化且合并淋巴结转移者;这表明间质成分的增加对肿瘤的侵袭、转移能力起着显著促进的作用。本研究中发现,TSR≥1者的生存时间明显高于TSR<1者(P<0.001),且TSR<1是预后不良及合并淋巴结转移的风险因素。由此推断,该指标在预测患者结直肠癌预后及淋巴结转移起到重要的作用。
TB通常被认为是肿瘤细胞活动及开始发生转移的一个标志[11]。近年来的研究表明,出芽过程也是一个肿瘤细胞侵袭性与间质EMT过程共同作用导致的综合结果。出芽位于肿瘤的侵袭前沿,此处也是癌细胞与CAFs发生交互作用的场所;WANG等[12]的研究表明,间质细胞产生的生长信号导致了局部的TB表型。由此认为,TB可作为一个辅助反映肿瘤浸润前端的间质特性的指标,且与癌细胞的浸润和转移相关。MEYER等[13]在研究中发现,结直肠癌出芽细胞中,部分细胞出现CK+/VIM+双阳性。预示出芽的细胞有部分是同时显示上皮及间质特征,部分或全部显示上皮间质转化特征。
2019版日本结直肠癌治疗指南中将TB级数≥2作为预测结直肠癌早期淋巴结转移风险的重要因子出现,建议当TB等级≥2级时追加外科手术治疗。在本次研究中,114例TSR>1的病例中,低级别出芽(1级)更多见为53例(91.38%)。TB级数≥2为影响患者预后的风险因素(P<0.05),但将该因素纳入淋巴结转移的多因素Logistics回归分析后,差异无统计学意义;考虑可能与本研究中选取的进展期结直肠癌样本数量多于早期结直肠癌样本数量有关。
既往关于结直肠癌浸润前端CAFs形态观察与肿瘤腺体富集区域DR成熟度的研究较少。本研究拟通过对肿瘤浸润前端中央处的CAFs和ECM形态描述,进一步对TME在结直肠癌不同时期的成分及作用进行描述。根据相关文献的研究,肿瘤浸润前端CAFs为成熟型的患者通常预后较好[14-15]。本次研究发现,在16例早期结直肠癌(pT1N0M0)浸润前端CAFs中,有15例为非成熟型。猜测这可能是因为肿瘤早期阶段,癌性DR不明显,CAFs活化不完全,EMC产生较少有关;无淋巴结转移组的患者中,浸润前端CAFs成熟型显著增多,而且CAFs形态与TSR无明显相关性;CAFs形态与其功能有关,浸润前端非成熟型CAFs细胞与结直肠癌的浸润性生长方式及更高的T分期有关,另外可能与肿瘤浸润转移有关。然而,不同的肿瘤浸润前端CAFs形态与肿瘤腺体富集区域癌性DR成熟度的患者在生存分析中差异无统计学意义;此外肿瘤浸润前端CAFs形态、肿瘤腺体富集区域癌性DR成熟度在生存分析中差异无统计学意义,COX风险比例回归模型及Logistics回归分析也指出该指标与预后及淋巴结转移的关联性不佳。分析认为可能与以下因素相关:(1)HE染色对于癌性DR区域于中的CAFs和ECM的区分能力有限;(2)肿瘤腺体中央的DR及此处的CAFs在肿瘤的浸润、转移的过程中与肿瘤浸润前端的DR及CAFs可能作用不同;(3)CAFs也可能影响原发性肿瘤的ECM“顺应性”,导致ECM中的细胞及胶原形态发生改变,使位于肿瘤浸润前端与肿瘤腺体富集区域的ECM和CAFs功能不同[17]。后续拟通过免疫组织化学法的“鸡尾酒染色”,如α-SMA/胶原蛋白染色嵌套FAP/Vimentin染色,来达到对于该部位癌性间质反应的区分,从而更好的评价TME中不同成分的间质(CAFs和DR)在不同时期、不同部位的生物学功能。
综上所述,本次研究聚焦于结直肠肿瘤的癌性间质特征,从“定量-TSR”到“定性-癌浸润前端的CAFs形态和出芽”,从肿瘤中央到浸润前区,从结直肠肿瘤发生的不同阶段对其间质病理特征进行了阐述,并将间质病理特征同预后及淋巴结转移联系起来,为预测结直肠癌预后及淋巴结转移提供了新的理论依据。作为一个单中心的回顾性研究,本研究尚存在着一些缺陷:实验方法仅选取HE染色指标,较为单一;此次研究中浸润深度为pT1a的患者仅3例,pT1b仅13例,在病例的分组上也存在着选择偏倚。在后续的研究中,可考虑联合多中心、大样本量及增加间质病理观察的指标,进一步验证间质病理特征在不同分期结直肠癌中的表达及作用。