原发性肝癌的分层筛查与监测指南(2020版)
中华预防医学会肝胆胰疾病预防与控制专业委员会,中国研究型医院学会肝病专业委员会,中华医学会肝病学分会,中华预防医学会肿瘤预防与控制专业委员会感染性肿瘤防控学组
原发性肝癌简称肝癌,主要由起源于肝细胞的肝细胞癌(hepatocellular carcinoma,HCC)、起源于肝内胆管细胞的肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)和肝细胞胆管细胞混合癌(combined hepatocellular cholangiocarcinoma,CHC)组成[1],其中HCC占85%~90%。近年来,我国的肝癌诊疗技术取得了较大进步,但年龄标化后的患者总体5年净生存率仅由2000—2004年的11.7%提高到2010—2014年的14.1%,未见明显提高[2]。然而,接受根治性治疗的巴塞罗那肝癌临床分期(barcelona clinical staging of liver cancer,BCLC)为0期或A期肝癌患者,其5年总生存率可高达69.0%~86.2%,手术切除患者的5年总生存率为56.9%[3]。因此,科学地确定肝癌高危人群、制定分层的监测方案,是早发现、早诊断和提高肝癌总体生存率最关键的环节。
新版的美国肝病学会(American Association for the Study of Liver Diseases,AASLD)、欧洲肝病学会(European Association for the Study of the Liver,EASL)、韩国肝癌协会-韩国国家癌症中心、美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)、欧洲肿瘤内科学会和亚太肝病学会(Asian-Pacific Association for the Study of the Liver,APASL)的有关肝癌诊治指南中,对肝癌高危人群的定义和筛查监测方案仍存在差异[4-9]。2019年,国家卫生健康委员会(简称卫健委)更新了我国《原发性肝癌诊疗规范》,将慢性病毒性肝炎、酒精性及非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和各种原因的肝硬化定义为肝癌高危人群,推荐腹部超声检查(ultrasonography,US)联合血清甲胎蛋白(alpha-fetoprotein,AFP)间 隔6个 月 检 查1次,作为肝癌高危人群的监测方案[10]。2014年日本肝病学会将肝癌高危人群进行了分层,对于极高危人群采用了AFP、异常凝血酶原(desγ-carboxy-prothrombin,DCP)、甲胎蛋白异质体(lens culinaris agglutinin-reactive fraction of AFP,AFP-L3)联合腹部US或增强CT或MRI,以及必要时同时采用2种影像学方法,间隔3~4个月检查1次的监测方案[11]。研究显示,BCLC A期肝癌占60%~65%,显著高于全球早期肝癌诊断率的10%~30%[12],这说明分层监测的指导意见更有利于肝癌的早期诊断。
随着肝病基础与临床流行病学研究的进展,人们对肝癌高危人群的认识有了越来越多的新证据。安全、有效的抗病毒药物被广泛应用,95%以上丙型肝炎病毒(hepatitis C virus,HCV)被根除,80%~90%的乙型肝炎病毒(hepatitis B virus,HBV)得到有效抑制,这些也导致肝癌风险人群的变迁。因此,中华预防医学会肝胆胰疾病预防与控制专业委员会、中国研究型医院学会肝病专业委员会、中华医学会肝病学分会和中华预防医学会肿瘤预防与控制专业委员会感染性肿瘤防控学组组织了国内肝病消化、肝脏外科、肿瘤介入、感染病及流行病学等领域的专家共同制定本指南。本指南的制定按照循证医学依据和指南研究和评价工具AGREE Ⅱ的标准[13],成立了指导组、撰写组、讨论组(包括通信专家)和证据评估组。本指南旨在医院和社区人群中,筛查有确切病因的肝癌风险的患者,为科学的辨识肝癌高危人群及分层监测提供指导意见;帮助从事肝病或感染病、消化、肝脏外科、疾病预防与控制等专业的医师,为肝癌高危人群的筛查与监测决策提供参考依据。指南不是强制性标准,不可能包括或解决肝癌高危人群筛查与监测中的所有问题。因此,医师在面对某一患者时,遵循本指南的原则,充分了解患者的病情特点和意愿,结合当地医疗资源和临床实践经验,制定合理的肝癌风险人群分层筛查与监测计划。
指南中提及的证据和推荐意见基本按照GRADE系统(推荐分级的评估、制定与评价)进行分级(表1)。

表1 GRADE系统循证医学证据级别及推荐等级
1 筛查与监测的定义
肝癌的筛查与监测是一项国家公共卫生计划。通过在社区或医院人群中进行筛查,发现伴有肝癌风险的患者,并使患者加入到肝癌的终生监测计划,实现肝癌的早诊和早治,旨在降低与肝癌相关死亡和总体肝病相关死亡[14]。
1.1 筛查
1951年美国慢性病协会正式推出了筛查的概念,即通过有效、简便和经济的检查方法,将可能有病或缺陷、但表面上看似健康或无症状的人,与那些无病的人区别开来。筛查既可以发现慢性病中的早期患者,又可辨识发生这些疾病的高危人群。按人群不同分为机会性筛查、目标人群筛查和群体普查3种。机会性筛查是个体主动或自愿到医疗机构进行相关疾病的检查;目标人群筛查与群体普查是社区或单位有组织地为目标人群提供相关疾病的检查。值得注意的是,筛查不等于诊断检查。
1.2 监测
指连续、系统、随时间纵向推移、定期的对高危人群进行检查。除筛查的指标外,对肝癌高危患者采用超声造影、增强CT和(或)MRI等影像学检查,以便发现BCLC 0或A期的早期肝癌,也称加强筛查[15]。监测包括被动监测和主动监测。
1.3 筛查与监测的伤害
筛查与监测存在多种类型的伤害,包括身体、高成本和心理等伤害。在一项单中心队列研究中,680例肝硬化患者接受了为期3年的肝细胞癌监测,27.5%患者报告了监测相关的身体伤害,其中9.7%患者接受了多次增强CT或MRI检查,0.4%接受了侵入性检测[16]。尽管腹部US和AFP对患者没有直接的身体伤害,但与诊断相关的潜在伤害仍然存在。
2 肝癌病理学和癌前病变
根据病理学分类,肝癌分为HCC、ICC和CHC。由于导致HCC和ICC的发病机制和危险因素暴露等差异,不同国家和地区人群的肝癌病理学类型略有差异。ICC在欧美人群中的发病逐渐上升[17],我国HCC和ICC变化趋势尚无确切的报道。我国国家癌症中心报道了2 172例患者的肝癌病理学类型,其中HCC约占83.9%,ICC约占11.0%[18]。由于缺乏特异性血清和组织标志物,早期肝癌与癌前病变或癌前疾病的诊断一直是临床和病理科医师争论的难题[19]。肝癌的发生和发展是一个多基因突变、多信号通路的癌变过程,大多遵循从慢性肝炎→肝硬化→肝硬化增生结节→低级别不典型增生结节(low-grade dysplastic nodules,LGDN)→高级别不典型增生结节(highgrade dysplastic nodules,HGDN)→早早期肝癌→早期肝癌→进展期肝癌这一过程,这是一个多步骤从分子到临床的演变过程[20]。日本学者研究显示,肝硬化增生结节进展为肝癌的1、3和5年累积发生率分别为3.3%、9.7%和12.4%,LGDN(称为癌前病变)进展为肝癌的1、3和5年累积发生率分别为2.6%、30.2%和36.6%,HGDN(称为癌前病变)进展为肝癌的1、3和5年累积发生率分别为46.2%、61.5%和80.8%[21]。另外,肝癌也呈现肿瘤大小(通常认为肿瘤直径的截点值为2 cm)随时间倍增的生长规律[22]。因此,在监测肿瘤直径<2 cm的肝癌前病变或癌前疾病中,临床上有足够的机会与肝癌进行鉴别,以实现肝癌早期诊断和治疗的目标。因此,加强对肝癌前疾病及癌前病变的认识,对于精准的辨识肝癌高危人群和早期肝癌诊断意义重大。
3 流行病学及疾病负担
85%~95%的肝癌发生在肝硬化的基础上,肝穿刺活检病理学确诊存在较高风险。对伴肝硬化背景患者的肝癌确诊应采用放射学诊断标准,而不依赖病理学诊断。因此,全球范围内,包括中国,通常采用统计学方法对肝癌发病与归因进行估计,如根据国际疾病分类第10版(international Classification of diseases,ICD-10)和有确切病理学的数据推算,或采用多元估算方法,与人群实际发病可能有一定的偏差[23]。
3.1 发病率与死亡率
基于GLOBOCAN 2018年数据,根据ICD-10,全球肝癌新发约792 031例,人口年龄调整(age-standardized rates,ASR)发病率为8.9/10万,位居恶性肿瘤发病谱第6位,其中男性ASR发病率为13.4/10万,位居恶性肿瘤发病谱第5位;女性ASR为4.7/10万,位居恶性肿瘤发病谱第9位[24]。全球肝癌发病率最高的国家是蒙古国,ASR为90.0/10万,肝癌死亡约727 661万例,ASR死亡率为8.1/10万,位居恶性肿瘤死亡谱第4位;其中男性位居恶性肿瘤死亡谱的第2位,女性位居恶性肿瘤死亡谱的第6位,全球肝癌死亡率最高的国家仍然是蒙古国[24]。欧美地区肝癌发病率和死亡率较低,但近10年来呈逐步上升趋势;亚洲人群的肝癌发病率较高,但发病率和死亡率均呈现逐年下降趋势[24]。
GLOBOCAN 2018年报道,中国人群肝癌的ASR发病率为17.7/10万,ASR死亡率为16.4/10万,均居全球第9位;2014年中国肝癌新发约364 800例,居全部肿瘤发病第4位,死亡318 800例,居全部肿瘤死亡第2位;每年肝癌总发病和死亡例数约占全球的一半,并具有显著的城乡和地区差别;农村地区人口调整发病率为20.07/10万,死亡率为17.52/10万,高于城市的发病率(16.13/10万)和死亡率(13.64/10万)[23]。目前,中国西部地区的发病率(20.85/10万)、死亡率(16.98/10万)均高于中部地区(分别为18.23/10万和15.97/10万)和东部地区(分别为15.31/10万和13.52/10万)[23]。随着我国生活环境的改善、乙型肝炎疫苗预防免疫接种和慢性HBV感染的有效抗病毒治疗等[25],2000—2014年中国的肝癌标化发病率每年下降2.3%,其中<40岁年龄组每年下降3.9%[23]。同时,肝癌发病年龄逐年增大,城市和农村地区男性平均发病年龄由2000年的59.67和56.53岁延迟到2014年的62.66和61.20岁,女性由65.50和60.60岁延迟到69.87和66.07岁[26]。
3.2 疾病负担
全球范围内,在恶性肿瘤死亡和致伤残调整生命年(disability-adjusted life-years,DALYs)中,肝癌位居第2位[24]。2017年在中国所有慢性疾病中,肝癌成为第5位导致早死损失生命年(years of life losts,YLLs),第7位 导致DALYs的 疾病[27]。1990—2017年,DALYs和YLLs均呈上升趋势,在所有年龄组人群中,DALYs增加了43.5%[95%不确定性区间(uncertainty interval,UI)为31.2~60.3],YLLs增加了21.2%(95%UI为10.8~35.2)[27]。人口老龄化是肝癌所致疾病负担增加的主要原因[24,26]。
推荐意见1:肝癌的筛查与监测应纳入国家公共卫生计划,旨在降低与肝癌相关死亡和总体肝病相关死亡(C1)。
推荐意见2:我国肝癌发病年龄逐渐增大;年龄调整发病率呈逐年下降趋势,但所导致的疾病负担仍呈上升趋势(A1)。
4 肝癌的病因
90%以上肝癌病因学较为明确,包括肝硬化、HBV感染、HCV感染、酒精和非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)(现更名为代谢相关脂肪性肝病,本指南仍用NAFLD)和糖尿病等,以及致癌物的长期暴露,如黄曲霉毒素B1(aflatoxin B1,AFB1)和马兜铃酸(aristolochic acid,AA)等;另外,肝癌家族史可显著增加病毒感染人群的肝癌发病风险。
4.1 肝硬化
各种原因导致的肝硬化是HCC发生过程中最重要的环节,85%~95%的HCC具有肝硬化背景[28]。慢性HBV相关肝硬化患者肝癌年发生率为3%~6%,是我国HCC的首要病因[29],HCV肝硬化年肝癌发生率为2%~4%[30]。HBV和(或)HCV相关肝硬化患者,抗病毒治疗后获得持续病毒学应答(sustained virological response,SVR),其发生肝癌的风险显著降低。一个由多病因组成的2 079例肝硬化患者随访10年的队列研究显示,NAFLD和自身免疫性肝硬化患者10年累积HCC发病率分别为16.3%和4.6%[31]。与HBV和(或)HCV相关的肝硬化相比,酒精性肝硬化患者发生HCC的绝对风险降低2~3倍[32]。肝硬化进展为HCC的风险受年龄、性别、病因、肝癌家族史和糖尿病等相关因素影响。在肝硬化患者中,年龄较大、男性、合并血小板计数低(<100×109/L)和食管静脉曲张者发生HCC的概率更高。已有研究表明,HCC发生率与门静脉压力或通过瞬时弹性成像测定的肝脏硬度指数(liver stiffness measurement,LSM)相关[33]。慢性胆道疾病、血色病、肝卟啉病以及α1-抗胰蛋白酶缺乏症等引起的肝硬化可能会增加HCC的风险,但在世界范围内占比均很小。
4.2 慢性HBV感染
全球范围内HBV感染是HCC的首要病因,尤其是在东亚和非洲国家[34]。我国国家癌症中心对1 823例HCC患者病因分析结果显示,86.0%为HBV单纯感染,6.7%为HBV和HCV混合感染[18]。研究显示,乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)为阴性的隐匿性HBV感染者,HCC发生风险较非HBV感染者增加,调整后的相对危险度(relative risk,RR)为2.86 [95%可信区间(confidence interval,CI)为1.59~4.13][35]。具有肝癌家族史的HBV感染者有更高的HCC风险,一项对22 472例中国台湾地区居民随访(16.12±2.89)年的研究显示,在HBsAg阴性人群中,无肝癌家族史的人群HCC累积发病率为0.62%,伴肝癌家族史为0.65%;但在HBsAg阳性人群中,在无肝癌家族史人群中HCC累积发病率为7.5%,伴肝癌家族史人群中HCC累积发病率高达15.8%[36]。
乙型肝炎e抗原(hepatitis B e antigen,HBeAg)状态、外周血乙肝病毒的脱氧核糖核酸(HBV-DNA)载量、HBV基因型和相关基因突变等与HCC风险有关[37-41]。一项对江苏省启东市的研究显示,在启东肝癌高发区,与HBsAg和HBeAg同时阴性者相比,HBsAg阳性但HBeAg阴性、HBsAg与HBeAg双阳性患者发生HCC的RR分别为13.25(95%CI为6.67~26.33)和28.05(95%CI为13.87~56.73)[37]。值得注意的是,HCC累积发生率与HBV-DNA水平并非呈线性正相关,HBV-DNA载量为104~106拷贝/mL者,发生HCC的风险比(hazard ratio,HR)最高,而当HBV-DNA载量>106拷贝/mL时,HR反而有所下降[38]。对于HBeAg阴性,HBV-DNA在2 000~20 000 IU/mL者,HBV核心相关抗原(hepatitis B core-related antigen,HBcrAg)≥10 KU/mL时,HCC发生风险显著增加[39]。对于HBeAg阴性、HBV-DNA载量<2 000 IU/mL,但HBsAg≥1 000 IU/mL者,HCC发生风险较HBsAg<1 000 IU/mL者增加13.7倍(95%CI为4.8~39.7)[40]。因此,在抗病毒治疗时代,HBsAg、HBcrAg定量与HBV-DNA载量互补,可作为预测HBV感染者进展为HCC的标志物[39,41]。然而,在50岁后,即使HBsAg消失的HBV感染者,HCC发生的风险仍较高。HBV基因型和基因的变异可显著增加HCC的发病风险,包括HBV前S区的变异(OR=3.77,95%CI为2.57~5.52)、增强子Ⅱ区C1653T变异(OR=2.76,95%CI为2.09~3.64)和T1753V变异(OR=2.35,95%CI为1.63~3.40)、核心启动子区A1762T/G1764A双突变(OR=3.79,95%CI为2.71~5.29)等,是HCC风险的独立预测因子[42]。并且,这些突变在HCC的发展过程中具有不断积累的趋势[43-44]。
在抗病毒治疗时代,核苷(酸)类似物[nucleos(t)ide analogues,NAs]一线抗病毒药物—恩替卡韦(entecavir,ETV)、富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate,TDF)及富马酸丙酚替诺福韦酯(tenofovir alafenamide fumarate,TAF)的应用,可显著降低了HBV患者进展为肝硬化及HCC的风险[45-47]。α-干扰素(interferon-α,IFN-α)是另一类的抗病毒药,也可降低慢性HBV患者进展为肝癌的风险[48]。但是,无论NAs或IFN-α治疗后,均不能完全消除慢性HBV感染进展为肝癌的风险。
4.3 其他病因
4.3.1 慢性HCV感染
HCV感染发生HCC归因于为HCV所致的肝硬化。在北美,59%(95%CI为3%~79%)的HCC归因于HCV感染;北欧地区为28%(95%CI为10%~55%),欧洲其他地区为40%(95%CI为32%~49%);非洲中北部为79%(95%CI为69%~86%)HCC归因于HCV感染[49]。在我国,HCV单独感染仅占HCC全部病因的1.7%~2.5%,HCV合并HBV感染者占6.7%[18]。在HCV感染者中,HCC风险增加的因素包括男性、年龄较大、合并人类免疫缺陷病毒或HBV感染、糖尿病和长期饮酒等[9,50-52]。肝癌家族史也能增加HCV感染者的HCC发病风险,一项对西方人群进行的荟萃分析显示,具有肝癌家族史但HBsAg和抗HCV抗体双阴性人群,发生HCC风险的OR=2.94(95%CI为0.94~9.21),但在病毒感染阳性人群中,HCC在无家族史人群中的风险为OR=38.19(95%CI为21.97~66.39),具有肝癌家族史人群HCC风险OR=72.48(95%CI为21.92~239.73)[53]。研究显示,聚乙二醇干扰素(PEGIFN)或直接抗病毒药物(direct-acting antivial drugs,DAA)均能降低HCV相关肝硬化及HCC发生的风险[54]。
4.3.2 酒精性肝病、NAFLD或伴糖尿病
酒精性肝病是欧美国家HCC的主要病因,仅次于HCV或HBV感染。一项法国多中心652例酒精性肝硬化队列研究显示,HCC的年发生率为2.9%,酗酒(乙醇≥80 mL/d)显著增加肝硬化发生HCC风险[50]。一项病例对照研究显示,单纯酒精性肝硬化、HCV或HBV肝硬化进展为HCC风险的OR分别为4.5(95%CI为1.4~14.8)、15.3(95%CI为4.3~54.4)和12.6(95%CI为2.5~63.1),而酒精肝伴有慢性HCV或慢性HBV感染等2个或以上因素者OR高达53.9(95%CI为7.0~415.7)[51]。吸烟、肥胖和糖尿病等与酒精之间存在交互增强HCC风险的关系[50]。一项荟萃分析显示,戒酒后HCC患病风险每年可下降6%~7%,但降至非饮酒者的风险等级则需23年(95%CI为14~70)[52]。
NAFLD是目前全球最常见的肝脏疾病,正在成为HCC的重要病因[55]。一项涉及欧洲4个队列约13万例NAFLD或NASH患者的研究显示,NAFLD或NASH患者的肝癌风险较普通人群提高了3.51倍(95%CI为1.72~7.16),在没有肝硬化背景的HCC患者中,NAFLD患者比例高达26.3%[56]。我国一项社区人群前瞻性队列研究(US诊断为NAFLD)中,只有肝功能异常即谷氨酸氨基转移酶(alanine aminotransferase,ALT)>80 U/L的NASH患者,发生HCC的风险较对照组增加了4.41倍(95%CI为1.40~13.96)[57]。由于部分NAFLD同时也合并酒精性肝病,因此NAFLD对HCC的确切风险度还有待进一步明确。NAFLD伴糖尿病患者,其发生HCC的风险比正常人高1.8~2.5倍,在各种族中均是HCC发病和预后的独立因素[58-59]。
4.3.3 致癌物暴露
饮食中AFB1暴露是造成撒哈拉以南非洲、东南亚和中国部分农村地区HCC高发的重要原因,国际癌症研究署(International Agency for Research on Cancer,IARC)于1987年将其列为Ⅰ类致癌物。AFB1本身的直接致癌作用存在争议,但研究显示,AFB1与HBV感染之间存在很强的交互作用[60-61]。一项病例对照研究显示,在HBsAg阴性人群中,单纯AFB1暴露增加致HCC的风险为非暴露者的1.9倍(95%CI为5.0~7.5),当叠加慢性HBV感染时,HCC风险可增高至60.1倍(95%CI为6.4~561.8)[60]。随着我国政府改水改粮措施的实施,AFB1在我国肝癌高发区人群中的暴露水平已有显著下降,其在我国HCC病因学中的贡献度也正在逐渐减弱[61]。
AA存在于马兜铃属及细辛属等植物中,是很多中草药方的常见成分。2012年AA被IARC列为Ⅰ类致癌物。通过对HCC的基因组特征分析提示,亚洲人群HCC中具有AA特征性突变的比例远高于欧美,尤其是中国台湾地区高达78%[62]。在乙型肝炎患者中,AA暴露与HCC风险之间存在剂量反应关系[63]。
4.4 肝癌病因的变迁
随着新生儿乙型肝炎疫苗预防接种,致癌物AFB1暴露的有效控制,青壮年人群中HBV所致HCC发病显著下降[25,61,64]。HBV和HCV感染的筛查与及时有效地抗病毒治疗,也导致HBV和HCV相关HCC比例将逐渐下降[65],而酒精、NAFLD等非传染性肝病所占比例逐渐增加,其HCC发生率也增加。慢性肝病的病因变化引起全世界范围HCC的病因也逐渐发生变迁。
推荐意见3:慢性乙型肝炎是HCC的主要病因(A1)。酒精、代谢相关性疾病患者肝癌的发病率逐年增加(B1)。AFB1增加HBV感染、酒精性肝病患者肝癌的发生风险(A1)。
推荐意见4:各种原因导致的肝硬化是肝癌的重要环节,慢性HBV相关肝硬化是我国HCC的首要病因(A1)。
5 肝癌高危人群的辨识与分层
肝硬化及未抗病毒治疗或未获得SVR的慢性HBV或HCV感染者,是我国HCC的主要高危人群。
5.1 肝硬化患者HCC风险分层
肝硬化患者是全球各指南公认的HCC高危人群。但肝硬化发生HCC的风险,因病因等不同而异。根据这一特性,多伦多HCC风险指数(Toronto HCC risk index,THRI)纳入了年龄、性别、肝硬化病因(自身免疫性肝病0分、获得SVR的丙型肝炎0分、其他肝病36分、脂肪性肝炎54分、未治疗的慢性丙型肝炎或慢性乙型肝炎各97分)以及血小板计数5项变量,构建了总计366分的THRI模型(表2)。低危组(<120分)、中危组(120~240分)和高危组(>240分)5年HCC累积发病率分别为1.2%、4.4%和15.4%,10年HCC累积发病率分别为3.0%、10.0%和32.0%[31]。THRI模型在我国也得到较好的验证,归类于低、中和高危组的肝硬化患者,5年HCC累积发病率分别为0.0%、13.0%和34.0%,预测模型的受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)为0.707[66]。THRI模型意义是,即使在HCC高危的肝硬化患者中,仍有进一步风险分层的必要,即能区分出HCC的极高危人群。除肝硬化病因外,具备以下特征的肝硬化患者,发生HCC的风险更大:(1)US发现肝脏结节(1~2 cm)或病理学为LGDN和HGDN。研究显示,LGDN和HGDN进展为肝癌的年发生率约分别为10%和20%[21]。(2)肝硬化合并糖尿病的患者,其HCC发生风险较不伴糖尿病的患者增加2~3倍[67]。(3)肝硬化结节(≤1 cm),未接受抗病毒药物治疗或治疗后仍持续存在低病毒载量HBV-DNA患者,肝癌发生率显著增加[68]。
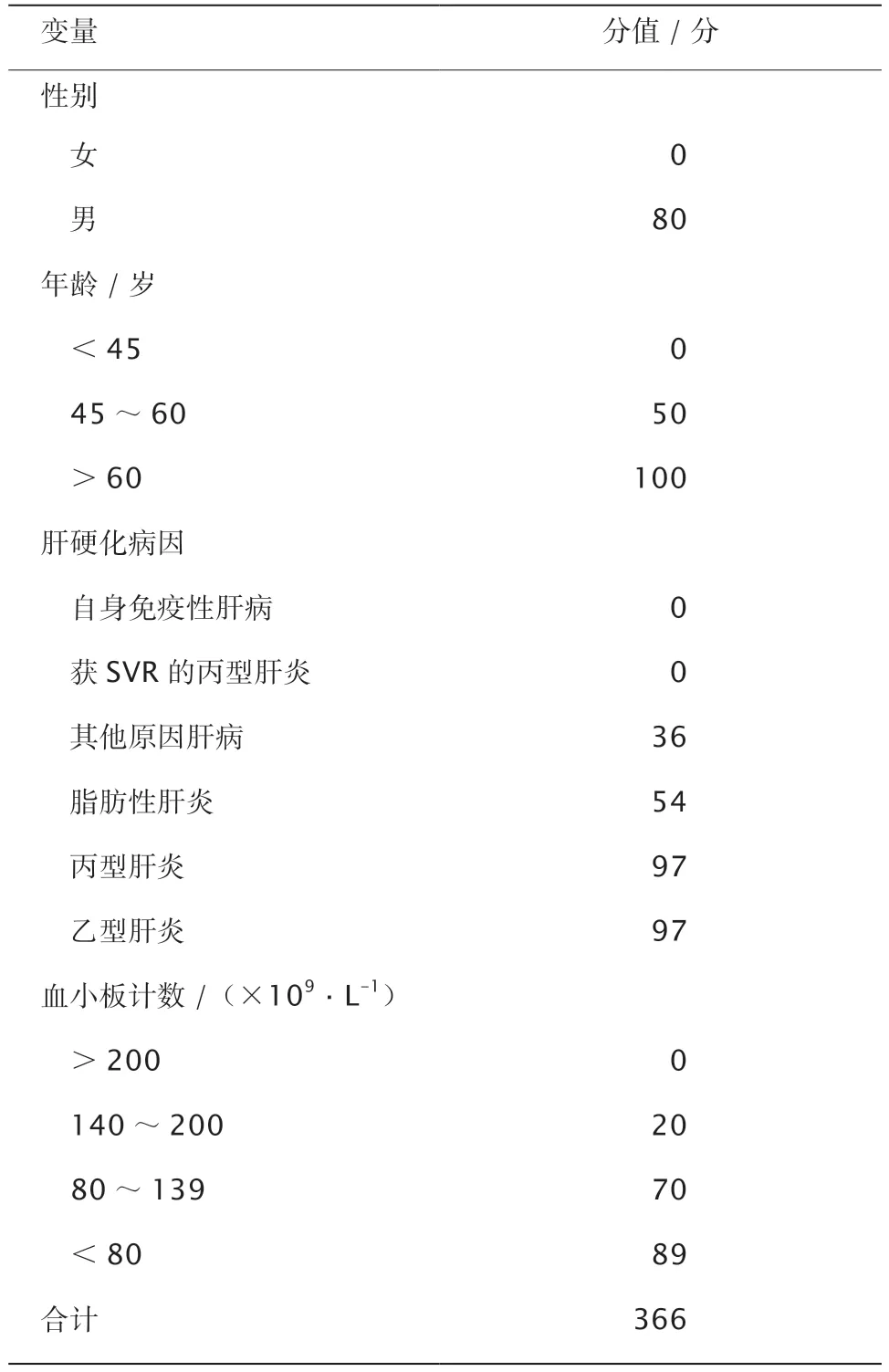
表2 多伦多HCC风险指数模型参数与赋值
近年来,作为无创检查肝硬化手段的LSM在HCC风险分层中的价值也逐渐显现。韩国一项前瞻性研究显示,在HBV感染者中,LSM为8.1~13.0 kPa、13.1~18.0 kPa、18.1~23.0 kPa和>23.0 kPa的患者,发生HCC的HR分别为3.07、4.68、5.55和6.60[34]。在中国台湾地区HCV感染者中,当LSM<12.0 kPa时,HCC的5年累积发病率仅有0.9%,而当LSM处于12.0~24.0 kPa和>24.0 kPa区间时,HCC的5年累积发病率则可分别上升至9.5%和45.1%[69]。因此,在所有原因所致的慢性肝病患者中,要重视肝硬化的早期诊断与筛查。
5.2 HBV感染者HCC风险分层
尽管HBV感染是HCC的主要病因,但在没有肝硬化的情况下,一生中仅6.2%~9.5%的HBV感染者进展为HCC。免疫耐受期HBV感染者中(ALT和AST持续正常,HBeAg阳性,HBV-DNA载量>107IU/mL;肝脏病理确认无明显炎性反应或纤维化),10年肝癌累积发生率仅为1.7%[70]。有中国台湾地区学者针对未接受抗病毒治疗的HBV感染者发生HCC的危险分层,构建了包括性别、年龄、ALT、HBeAg状态和HBV-DNA水平5个参数、总计17分的REACH-B模型[38](表3),评分0~5分为低危、6~11分为中危、12~17分为高危。最低分组(0分)和最高分组(17分)患者在3、5和10年内HCC发生率分别为0.0%和23.6%、0.0%和47.4%以及0.0%和81.6%。在启东市肝癌高发区,以性别、年龄、HBeAg状态和HBV-DNA水平4个参数构建了AGED模型(共12分)[37],其高危组(≥10分)20年内发生HCC的风险是低危组(≤4分)的20.3倍。尤其重要的是,低危组发生HCC的风险与无HBV感染的普通人群已经基本一致,这提示对于低危组的HBV感染者,并无必要和高危组一样接受相同的HCC监测方案。

表3 REACH-B模型参数与赋值
基于欧洲9个前瞻性队列1 815例慢性乙肝患者、口服ETV或TDF抗病毒治疗5年结果,构建了包括年龄、性别和血小板计数3个参数、总计25分的PAGE-B模型(表4)用于评估抗病毒治疗后HBV感染患者发生HCC的危险度[71];按评分分为低危(0~9分)、中危(10~17分)和高危(18~25分)3组患者,在发现队列和验证队列人群中,HCC的5年累积发生率在评分为低危者为均为0.0%、评分为中危者为3.0%~4.0%,评分为高危者为16.0%~17.0%。韩国队列验证了PAGE-B模型在亚洲人群中同样有效,5年HCC预测力的AUC为0.77[72]。最近,PAGE-B研究团队又构建了用于抗病毒治疗5年后,重新评估HCC发病风险的SAGE-B模型[73],包括抗病毒5年后的年龄和LSM这2个参数,共计15分;同样按评分分为低危(≤5分)、中危(6~10分)和高危(≥11分)3组患者,12年HCC累积发生率分别为0.0%、4.0%和13.8%。总之,即使在抗病毒治疗的慢性HBV感染者中,5年HCC累积发病率总体上仍有5.7%~8.4%,尤其是归为高危组的患者,但值得指出的是,低危组患者5年[72]和12年[73]HCC阴性预测率高达97.5%~100.0%,提示这些患者可免于每年2次的常规肝癌监测。

表4 PAGE-B模型参数与赋值
总之,男性、年龄>40岁、一级亲属肝癌家族史和糖尿病等因素都会增加HBV感染者发生HCC的风险。此外,抗病毒治疗失败或耐药,如rtA181T、rtL80I、rtN236T突变或存在低病毒血症(low-level viremia,LLV)等,也会增加HCC的发生风险[74]。
5.3 其他人员HCC风险分层
5.3.1 HCV感染者中HCC风险分层
在未经治疗的HCV感染者中,血清HCVRNA、ALT以及HCV基因型1b是HCC的独立预测因子[30,75]。在HCV感染治疗患者中,年龄和肝纤维化程度是HCC发生的主要因素。PegIFN或DAA治疗后获得SVR慢性HCV感染患者,HCC风险虽可明显下降,但并不能彻底消除,尤其是肝硬化患者[54,76]。因此,前期已被纳入HCC监测的患者,目前并无停止监测的参考指标,应按原计划继续进行HCC监测。
5.3.2 NAFLD和酒精肝病患者HCC风险分层
对于NAFLD,尤其是非肝硬化阶段的NAFLD患者HCC筛查与监测,各国重视程度均低于HBV或HCV感染者。这主要因为NAFLD在普通人群中的患病率较高[77],而NAFLD和NASH罹患HCC的风险度又比HBV或HCV感染者低,对所有NAFLD人群开展筛查不具成本效益。因此,在NAFLD中对HCC的危险度分层显得尤为重要。一项涉及欧洲4国共136 703例NAFLD/NASH患者的多中心前瞻性队列显示,用于评估肝纤维化程度的FIB-4指数[(年龄×AST)/(血小板计数×)],可对NAFLD/NASH患者中发生HCC的风险度进行分层。与FIB-4<1.30(无明显纤维化)患者相比,FIB-4为1.30~2.67(中度肝纤维化)和FIB-4>2.67(重度肝纤维化/肝硬化)患者发生HCC的HR分别为3.74和25.20[55]。因此,在这些患者中要重视筛查肝纤维化和肝硬化,目前尚缺乏LSM等无创纤维化指标对酒精性肝病患者进展为HCC的分层证据。
5.3.3 肝癌家族史人群
在HBV或HCV感染人群中,一级亲属伴肝癌家族史显著增加HCC发生风险[36,53,78]。中国台湾地区的学者在对22 472名居民随访总计362 268人/年,共发生374例HCC,在HBsAg阳性患者中,有肝癌家族史可将HCC风险提高2.54倍[36]。对江苏省总计2 011例肝癌和7 933例非肝癌对照分析显示,HBV阴性但伴肝癌家族史的HCC风险增加的OR为2.76(95%CI为1.88~4.05),但在HBV阳性、伴一级肝癌家族史的人群中,HCC风险的OR为41.34(95%CI为23.69~72.12)[78]。因此,一级亲属伴肝癌家族史,使HBV感染者[36,78]或HCV感染者[53]在各阶段患HCC风险显著增加,需引起特别注意。
尽管HBV或HCV感染是HCC的主要病因,但由非病毒因素导致的HCC比例逐年上升。近来,我国学者应用全球11个前瞻性队列(共计17 374例患者)的数据,构建了由年龄、性别、血小板计数、白蛋白和胆红素等5个参数组成的,总分为100分的aMAP模型,用于不分病因的肝病患者HCC风险预测。归于低危组(<50分)患者,3和5年HCC累积发生率仅为0.0%和0.8%,由于这些患者中HCC年发病率已<0.2%,认为可免于每6个月1次的HCC监测。而归于中危组(50~60分)和高危组(60~100分)患者的3年HCC累积发生率分别为1.5%和4.8%,5年HCC累积发生率分别8.1%和19.9%。然而,该研究发现低危组患者占45.0%,高危组患者仅占17.9%[79]。因此,aMAP模型对高危人群及非病毒性肝病患者进展为HCC的辨识作用尚需要进一步评估。
总之,对肝癌风险人群实施分层管理,可能是提高早期肝癌诊断率和成本效益最重要的策略。肝癌高危人群的辨识与分层见表5。
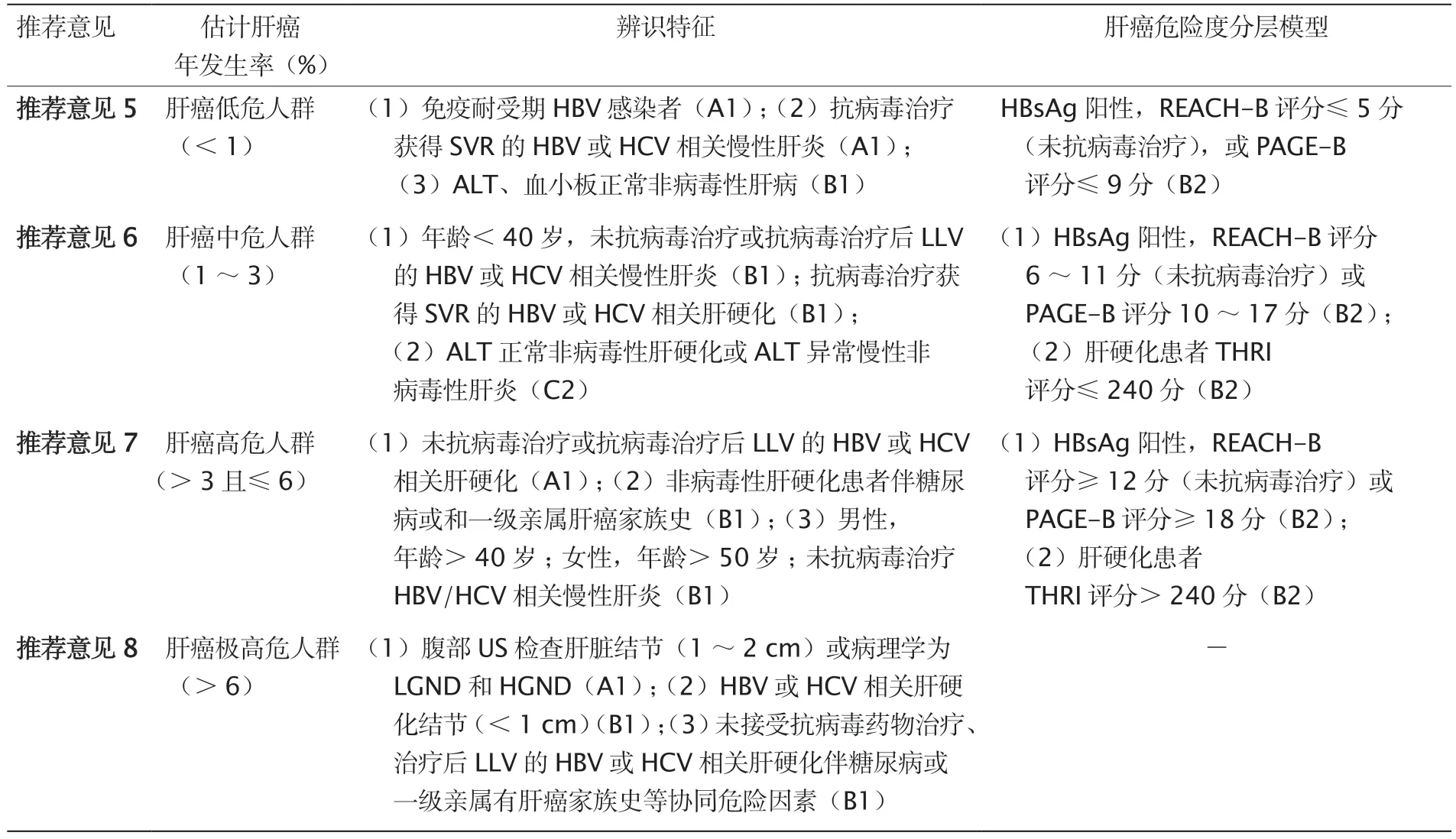
表5 肝癌高危人群的辨识与分层
6 筛查与监测工具
6.1 腹部US
US由于其操作简便、灵活、无创和价格低,被很多国家的指南推荐作为肝癌的筛查方法[80]。US可较灵敏的发现肝内占位性病变,准确区分囊性或实性病变。直径>2 cm的肝脏肿瘤,根据病灶血供等特征,US有助于鉴别其良恶性。总体来讲,对于直径<2 cm、2~3 cm、4~5 cm和>5 cm的肝癌,US诊断的灵敏度分别为39%~65%、76%、84%和90%[81]。超声多普勒不仅可以看到病变内的血液供应,还可以识别病变与血管之间的关系。超声造影使肝脏占位内的血流动力学变化可视化,并有助于鉴别诊断各种肝脏占位性病变的性质,提高US诊断肝癌的灵敏度和特异度[82-83]。US容易受到检查者经验、手法和细致程度以及患者肥胖的影响,然而不管早期肝癌US灵敏度低的原因是什么,US仍是肝癌筛查与监测最重要的工具。
6.2 多排螺旋CT和MRI
多排螺旋CT和MRI是诊断肝癌及临床分期最重要的工具,但设备价格高,难以在基层医院应用。动脉期明显的异质性增强,门静脉期和(或)实质平衡期显示出肿瘤增强程度降低,快速洗入和洗出的增强模式是肝癌的CT影像特征[79]。MRI组织分辨率高,采用特异性对比剂钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)增 强 扫 描,可显著提高早期肝癌的诊断灵敏度和特异度[84]。对于肝硬化结节≤2 cm,采用Gd-EOB-DTPA增强MRI检查,其敏感度和特异度分别为96.0%和96.6%;MRI增强扫描对HGDN具有高灵敏度(94.7%)和特异度(99.3%),可较准确鉴别早期HCC和HGDN[85]。有学者对407例肝硬化患者进行了前瞻性监测(4~6个月1次)显示,在发现的43例肝癌患者中,增强MRI检出率为86%,明显高于US的27.9%;而假阳性的比例明显低于US(分别为3.0%和5.6%);74.4%(32/43)的患者为早早期肝癌(单个结节直径<2 cm)[86]。因此,与US相比,在极高HCC危险的肝硬化患者中,Gd-EOB-DTPA增强MRI监测,可提高早早期HCC的检出率[84]。然而,对于直径≥2 cm的肝癌,CT与MRI诊断的灵敏度相似[81]。增强MRI是否能取代US检查作为肝癌极高危人群监测工具,还需要深入研究。
6.3 AFP、DCP和AFP-L3
20世纪70年代,由于中晚期HCC比例较多,AFP的灵敏度可达72%~87%。但随着医学影像学的发展,早期肝癌诊断比例不断增加,AFP诊断HCC的价值也有所下降。AFP水平与肿瘤大小有关,部分良性肝病、肝母细胞瘤和胃肠系统恶性肿瘤患者血清AFP也会升高[87]。肿瘤直径<2 cm、2~5 cm和>5 cm的肝癌中,AFP正常(<20 ng/mL)所占的比例分别为50%~70%、30%~50%和20%~30%[81]。总体上看,AFP诊断HCC的灵敏度为25%~65%,特异度为80%~94%[81]。因此,2010年的AASLD以及2018年的EASL指南均已不再将AFP作为HCC诊断的必备指标。但是,AFP与腹部US联合检查,可提高HCC诊断的灵敏度。由32项研究组成的荟萃分析(共计13 367例患者)表明,单独腹部US发现HCC的灵敏度低于腹部US联合AFP(RR=0.88,95%CI为0.83~0.93)[16]。一项针对1 487例HBV感染者的研究显示,仅用AFP监测,就能发现早期HCC,并延长患者的生存时间;在超声设备或检测经验有限地区,AFP作为HCC监测的工具仍有意义[88]。同时,在抗病毒治疗时代,AFP可提高HBV相关HCC发生的早期预警,如果抗病毒治疗未能使患者的AFP水平下降,则应警惕HCC风险[89]。因此,腹部US联合AFP可提高早期HCC的灵敏度,尤其是非病毒性肝炎相关的肝硬化患者[90]。
DCP也称维生素K缺乏症或拮抗剂Ⅱ诱导的蛋白质(protein induced by vitamin K absence or antagonist Ⅱ,PIVKA-Ⅱ),1984年首次报道在HCC患者血清中升高。一项包括31个研究的荟萃分析显示,临界值为40 mAU/mL时,PIVKA-Ⅱ诊断HCC诊断灵敏度为66%,特异度为89%[91]。PIVKA-Ⅱ在不同肿瘤大小、不同人群以及不同病因中,诊断HCC的能力均优于AFP。一项我国多中心研究也显示,PIVKA-Ⅱ在区分HCC与对照之间的正确率比AFP高6.2%~20.7%[92]。由于PIVKA-Ⅱ和AFP的形成机制不相同,两者之间无相关性;在AFP阴性的HCC患者中,PIVKA-Ⅱ诊断HCC的AUC为0.86。因此,AFP联合PIVKA-Ⅱ,可提高早期HCC的检出率。
AFP-L3是AFP的岩藻糖基化变异体,慢性肝炎和肝硬化患者AFP主要成分为AFP-L1,肝癌患者AFP主要成分为AFP-L3。一项荟萃分析显示,AFP-L3诊断HCC的总体灵敏度和特异度为48.3%(45.9%~50.7%)和92.9%(91.6%~94.0%)[93]。基于性别、年龄和AFP、AFP-L3和DCP3种血清标志物构建的GALAD模型,诊断早期肝癌的敏感度与特异度分别为85.6%和93.3%,区别肝癌与慢性肝病AUC>0.9,且该模型不受病因及抗病毒治疗的影响[94-95]。
6.4 其他血清蛋白标志物
HCC蛋白标志物还包括:α-L-岩藻糖苷酶、血清铁蛋白、骨桥蛋白、Glypican-3、热休克蛋白90α、高尔基体蛋白73、热激蛋白27和Dickkopf1等。由于这些生物标志物在其他恶性肿瘤、肝硬化或慢性肝炎患者中也会增高,限制了其作为肝癌标志物的应用价值[96]。
6.5 新的血清生物标志物
6.5.1 微小RNA(microRNA,miRNA)
miRNA是一种由20~25个核苷酸组成的非编码RNA,在转录后水平调控目的基因的表达。由外泌体包裹的miRNA在血循环中稳定性较高,具有血清学标志物的应用前景。一项荟萃分析显示,诊断HCC的灵敏度和特异度均>80%的单一miRNA,包括miR-130b、miR-150、miR-182、miR-215和miR-96。尤其重要的是,在BCLC 0期的早早期肝癌中,miRNA组合检测的诊断灵敏度和特异度也可分别达到86.1%和76.8%[97]。由7种miRNA(miR-122、miR-192、miR-21、miR-223、miR-26a、miR-27a和miR-801)组成的肝癌诊断试剂盒,其区分肝癌患者和正常人群的正确率达94.1%[98]。miRNA作为一种新的标志物,存在的主要问题是重复性欠佳,仍有待大样本、多中心临床验证其应用价值。
6.5.2 液体活检
液体活检作为精准医学时代检测的标志物,包括循环肿瘤细胞、循环肿瘤DNA(circulating tumor DNA,ctDNA)、外泌体、肿瘤相关甲基化、循环游离DNA(circulating cell-free DNA,cfDNA)和长链非编码RNA等[99-100]。ctDNA相关基因的改变,例如p15、p16、APC、SPINT2、SFRP1、p16INK4a、TFPI2、GSTP1和RASSF1A与HCC发生和发展有关。研究显示,cfDNA甲基化,在诊断肝癌方面具有高灵敏度和特异度,且与肿瘤大小、肿瘤分期和治疗应答等密切相关[101]。由于当前液体活检的成本尚较高,因此不适宜用于肝癌的筛查和监测。
总之,除AFP外,包括AFP-L3和PIVKA-Ⅱ以及其他血清蛋白标志物、液体活检在内所有新的标志物,均需要经过EDRN提出的肿瘤标志物发现和验证的5个临床阶段的充分评估[102],才能将其作为肝癌筛查、监测或诊断的指标。
推荐意见9:腹部US联合血清AFP是肝癌监测的一线工具(A1)。
推荐意见10:血清AFP联合AFP-L3及PIVKA-Ⅱ检测,可提高早期肝癌的检出率(B2)。
推荐意见11:肝癌极高危险人群中,Gd-EOB-DTPA增强MRI可提高对肝硬化增生结节、LGND和HGND的鉴别能力,显著提高早早期肝癌的检出率(B1)。
推荐意见12:液体活检等新的肝癌血清标志物,无论是单独还是联合,作为肝癌筛查与监测的血清指标,仍缺乏临床充分评估与严格验证,不推荐用于常规筛查与监测(C1)。
7 肝癌的监测
在有肝癌风险的人群中,终生监测有助于肝癌的早诊早治,降低其病死率。一项包括47项研究(包括15 158例肝硬化患者)的荟萃分析显示,监测可显著提高早期肝癌诊断率(OR=2.08,95%CI为1.80~2.37)和肝癌根治率(OR=2.24,95%CI为1.99~2.52),与肝癌患者总生存率有关(OR=1.90,95%CI为1.67~2.17),监测组患者的3年累积生存率为50.8%,而在非监测组患者仅为27.9%[103]。另一项由17 820例HBV感染者随机对照队列研究显示,AFP联合腹部US监测6个月1次,监测组肝癌患者1和2年生存率分别为88.1%和77.5%,而非监测组肝癌患者的1年生存率为0.0%[104]。因此,科学的确定监测目标人群及分层监测方案,是提高肝癌患者整体生存率及成本效益最关键的环节。
7.1 目标人群
关于肝癌监测的目标人群,认为以下几个条件是必要的:(1)监测目标人群HCC的发生危险足够高。不同病因的肝病患者进展为肝癌的危险有差别;在抗病毒治疗时代,不同临床阶段HBV或HCV感染发生肝癌的危险差别也很大。不论是否存在肝硬化,HBV感染者进展为肝癌的年危险度>1.5%,或肝癌发生率>0.2%,才适合监测。(2)监测目标人群的HCC诊断率高于由症状、体征或偶然影像学检查的早期HCC诊断率。(3)监测目标人群中,肝癌治疗后的长期生存率要比未监测人群高[105-106]。一项包括8 900例慢性病毒性肝病患者(HBV感染15%,HCV感染80%,混合感染5%)的前瞻性队列研究显示,每6个月1次腹部US联合AFP监测肝癌,中位随访时间为10年,最后有8.6%的患者进展为HCC,其中47.3%为肝硬化患者进展为HCC[107]。无肝硬化的慢性HBV或HCV感染者中,肝癌年发生率低,尤其是有效抗病毒治疗后HCC发生风险降低达70%[107],达不到需要监测肝癌的阈值。但是,在HBV相关肝硬化患者中,抗病毒治疗后HCC年发生率仍高达1.5%~2.5%[76,108]。SINGAL等[109]对446例Child-Pugh A/B级肝硬化患者的前瞻性分析结果显示,腹部US联合AFP监测6个月1次,中位随访3.5年,在这些肝硬化患者中,肝癌年发生率为2.8%,3和5年的累积发生率分别为5.7%和9.1%,其中早期肝癌占73.2%。另一项多中心研究显示,慢性乙型肝炎患者进行ETV或TDF治疗后,前5年和第2个5年间,无/肝硬化患者的HCC年发生率分别为0.49%和0.47%,但在有肝硬化患者中,HCC年发生率则为3.22%和1.57%。上述结果表明,接受抗病毒治疗的HBV相关肝硬化患者,HCC的发生率仍高于监测的阈值。而抗病毒治疗后,获得SVR的HBV非肝硬化患者,似乎没有监测肝癌的必要[110]。因此,肝硬化是必须监测肝癌的高危人群。然而,迄今尚无针对肝硬化患者的多中心、大样本、随机对照的肝癌分层监测的研究。
值得指出的是,失代偿期肝硬化(Child-Pugh B或C级)发生HCC的风险更大[111]。由于这些患者存在肝功能衰竭或难控制的并发症,不能接受肝癌根治性治疗,因此,AASLD指南推荐,除非这类患者有条件进行肝移植,从成本效益角度考虑,没有必要进行肝癌的监测。不过,随着肝癌综合治疗技术的提高,如果早诊早治能使患者延长3个月以上的寿命,在失代偿期肝硬化患者中监测肝癌还是必要的。对于失代偿期HBV相关肝硬化患者来说,经有效抗病毒治疗后,可以出现肝硬化逆转或“再代偿”,动态监测肝癌,对于降低肝病整体病死率仍很重要[46,108]。在等待肝移植的患者中也有必要进行监测,因为肝癌可能会改变患者的优先等候级别和预后。
7.2 监测间隔
全球各指南推荐肝癌监测间隔不一致。新版的AASLD、EASL、LI-RADS、NCCN及APASL指南,以及2019年国家卫健委发布的《原发性肝癌诊疗规范》推荐,肝癌高危人群间隔6个月监测1次。日本肝病学会将肝癌高危人群进行了分层,对于极高危人群间隔3~4个月监测1次,低危人群间隔6个月1次。有学者比较了慢性肝炎合并血小板减少患者,间隔4个月和12个月监测1次,结果显示3年累积HCC发生率在2组间差异无统计学意义。但是,间隔4个月监测1次的患者中,早早期肝癌及接受根治性治疗的患者最多[112]。也有学者回顾性研究分析了52 823例临床诊断为HCC患者的临床资料,诊断前间隔6、12、24和36个月监测1次腹部US,监测和未经监测组人员中,可接受根治性治疗者分别占24.3%(95%CI为23.7%~24.9%)、26.9%(95%CI为25.7%~28.2%)、22.9%(95%CI为21.8%~24.1%)、21.3%(95%CI为19.9%~22.8%)和18.3%(95%CI为17.8%~18.8%);总体而言,间隔6个月1次监测肝癌,可接受根治性治疗的患者比例仍很低[113]。在失代偿期HBV相关肝硬化患者中,间隔3个月1次腹部US联合AFP监测肝癌,在发生肝癌的患者中,BCLC A期占66.7%;而间隔6个月监测组,BCLC A期占15.4%,2组可根治性治疗的患者分别占76.2%和36.5%[114]。一项多中心随机对照研究发现,在1 278例肝硬化患者中间隔3和6个月监测HCC,共123例患者进展为HCC;监测间隔缩短至3个月,2组患者在早期肝癌(肿瘤直径<3 cm)诊断率(79%和70%)以及局灶性结节发现率(20.4%和13.2%)差异无统计学意义;3个月监测组中<1 cm结节所占的比例为41%,明显高于6个月1次监测组的28%[115]。因此,缩短监测间隔,非恶性病变检出率较高,也可能增加了不必要的回访。基于社区与医院HBV或HCV感染队列,肝硬化3~6个月监测1次,慢性肝炎6~12个月监测1次,均可延长肝癌患者的长期生存率[116]。在肝癌高发地区,50岁以上普通人群,间隔2年1次腹部US监测比二步筛查法(第一步筛查高危人群,第二步监测肝癌)有更好的成本效益[117]。
因此,科学的对肝癌高危人群进行分层管理,采取分层的监测间隔和监测工具可能具有更高的成本效益(图1)。
7.3 依从性
有研究显示,中晚期肝癌最主要原因是患者没有接受肝癌筛查和监测、未接受肝癌危险因素的干预或未识别潜在的肝硬化[118-119]。总的来看,在临床实践中仅有52%的患者有较好的依从性,能够遵循指南或专家意见进行肝癌筛查与监测。有学者分析了多中心1 020例肝硬化患者肝癌监测的依从性,大部分患者如果常规检查正常或无症状,无需进行监测。73.1%的患者接受了1次以上的监测;其中,1年2次监测者占37.7%,且与肝病专科医师相关(OR=30.1,95%CI为17.5~51.8),50%患者报告了监测的困难,包括费用(28.9%)、时间(24.1%)和交通(17.8%)[120]。同样,对慢性丙型肝炎患者长期治疗的队列也显示,在发生晚期肝癌患者中,13%的患者无筛查,17%的患者无随访,70%的患者无监测[121]。因此,肝癌早期诊断取决于对肝癌高危患者的全病程管理、规范的监测。
7.4 召回
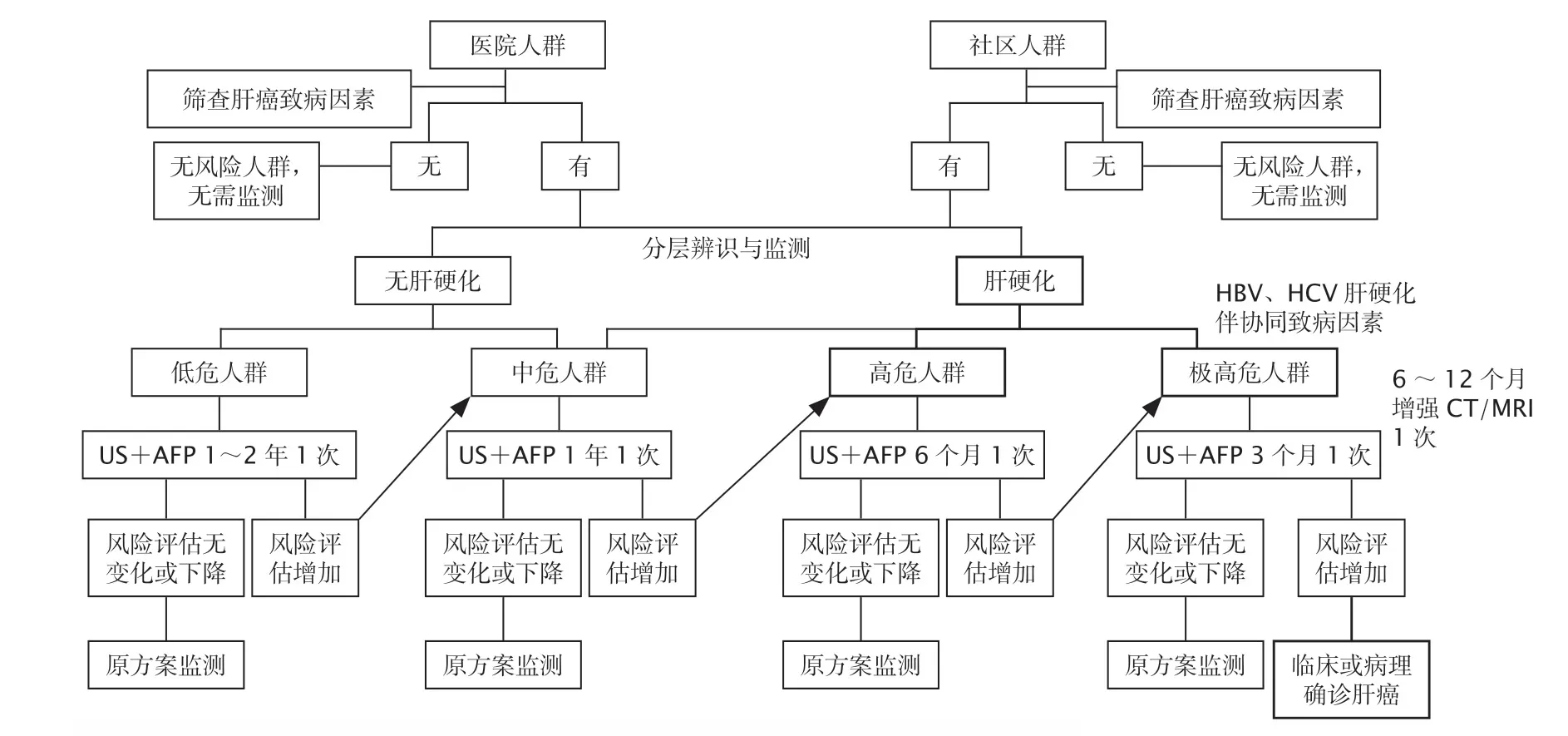
图1 肝癌高危人群的分层筛查与监测路线图
召回是肝癌监测过程中,提高早期诊断率最重要的策略。对腹部US检出≤1 cm结节者,可在3~6个月内重复US检查。US发现1~2 cm结节者,采用Gd-EOB-DTPA增强MRI检查,可提高早期肝癌与HGND的鉴别能力[84]。对于不确定的病变,仍需要进行诊断性肝活检。
7.5 成本效益
在肝癌高危人群中,腹部US联合AFP监测具有较好的成本效益[122]。尽管在肝癌低危患者(年发生率<1%)6个月1次US和(或)AFP监测,可发现早期肝癌,但成本效益显著高于肝癌高危患者(年发生率>3%)[123]。因此,对肝癌高危人群进行分层管理,采取分层的监测方案是必要的[124]。但其成本效益尚需基于随机对照或大样本队列研究进行评价。
推荐意见13:肝癌低危人群,1年或以上1次常规监测(C2);肝癌中危人群,1年常规监测1次(C1);肝癌高危人群,6个月1次常规监测(A1);肝癌极高危人群,3个月1次常规监测,6~12个月增强CT或MRI检查1次,以提高早期肝癌诊断率(B1)。
推荐意见14:失代偿肝硬化患者肝癌风险更高,在这些患者中监测肝癌,也可延长生存时间及提高肝移植优先等候级别和预后、降低肝硬化总体病死率(C2)。
推荐意见15:肝癌筛查与监测仍存在一定程度的障碍,在慢性肝病进展为肝癌的全病程管理中,科普教育、微信或电话访视均可提高筛查与监测的依从性(C1)。
推荐意见16:只有在足够肝癌发生危险度、足够样本量的目标监测人群中,实施肝癌的分层监测方案,才可能显示其成本效益(C1)。
8 肝癌根治术后的监测
肝癌切除术、肝移植和局部消融治疗(射频消融、微波消融、冷冻消融和高强度超声聚焦消融等)是目前指南推荐的肝癌根治方法,是肝癌患者获得长期生存最重要的手段[5-10]。但遗憾的是,患者术后5年肝癌复发转移率高达40%~70%[125]。肝癌根治术后的监测是早期发现其复发转移最重要的措施。
8.1 监测间隔
研究显示,肝癌根治术后最早复发可在术后2个月,大部分患者术后1~2年复发或转移[126]。肝癌复发转移的危险因素是多方面的,包括术前存在微小的播散病灶或者是多中心的肝癌发生、肝癌致病因素未根除、HBV基因突变、患者心理及肝功能状态等有关[127-128]。一旦早期发现肝癌复发,可以选择再次手术切除、局部消融等,以延长患者的生存时间,提高生活质量。根治性治疗后肝癌监测间隔及适宜的监测工具尚无统一的意见,也缺乏高质量的临床证据。
8.2 肝癌复发转移的防治
肝癌复发转移的防治仍是临床未解决的难题。高HBV-DNA载量及肝脏炎性可导致肝细胞坏死及残余肝细胞再生,导致较高的HBV相关肝癌的复发率[125]。有研究显示,TDF可显著降低HBV相关肝癌患者术后5年肿瘤复发、肝移植以及死亡的风险[129]。因此,国内外指南也推荐,NAs可用于防治HBV相关肝癌患者术后复发转移。尽管抑制血管生成的分子靶向药物预防根治术后肝癌复发的证据不足,但是对不符合手术切除适应证的进展期肝癌或肝癌复发,仍可以选择索拉菲尼、仑伐替尼和安罗替尼等小分子靶向药物,或选择联合治疗方案(如免疫检查点抑制剂联合小分子靶向药物、免疫检查点抑制剂联合抗血管生成靶向药物)等,可延长患者的总体生存时间[130-131]。详细药物方案可参考2019年卫健委发布的《原发性肝癌诊疗方案》。
推荐意见17:肝癌根治性治疗后的患者,2年内可参考肝癌极高危人群监测,3个月常规监测,采用增强CT或MRI检查可发现肝癌早期复发转移(C1);超过2年,可参考肝癌高危人群监测,6个月常规监测(C1)。
推荐意见18:有效抗病毒治疗可降低HBV相关肝癌的复发与转移(B1),ETV、TDF和TAF作为慢性乙型肝炎的一线抗病毒药物,可防治HBV相关肝癌的复发与转移(B1)。
推荐意见19:小分子抗血管生成等靶向药物单药或联合免疫检查点抑制剂,用于不可手术切除肝癌的治疗(A1)以及根治性治疗术后肝癌复发与转移的预防(C2)。
9 尚待研究和解决的问题
(1)肝癌前疾病及癌前病变的演变规律:在肝硬化→肝硬化再生结节→LGND→HGND→早早癌→早期癌→进展期肝癌的进展过程中,缺乏特异性的早期肝癌及临床分期的生物标志物。需要进一步研究基于人工智能的影像学大数据标志物,鉴别肝硬化再生结节与HGND及早期肝癌的临床价值。(2)肝癌不同危险人群的监测间隔与适宜监测工具:研发肝癌高危人群的简便分层辨识模型,如自我监测APP。肝癌监测间隔仍需要随机对照或大样本队列研究,特别是肝癌根治术后患者的监测间隔与监测工具,尚无高质量的临床证据。(3)在肝癌高危及极高危人群中,需要开展肝癌监测的卫生经济学评价,以验证在这些目标人群中,肝癌监测的公共卫生策略及长期的成本效益。(4)无论是医务人员还是患者,依从性仍是肝癌监测的主要障碍。
执笔专家
丁惠国(首都医科大学附属北京佑安医院肝病消化中心)
屠 红(上海市肿瘤研究所癌基因与相关基因国家重点实验室)
曲春枫(国家癌症中心国家肿瘤临床医学研究中心中国医学科学院北京协和医学院肿瘤医院分子肿瘤学国家重点实验室免疫室)
曹广文(海军军医大学基础医学部流行病学教研室)
庄 辉(北京大学医学部基础医学院病原生物学系)
赵 平(中国癌症基金会学术部)
徐小元(北京大学第一医院感染科)
杨永平(解放军总医院肝病医学部肝癌诊疗中心)
卢实春(解放军总医院肝胆胰外科医学部)
执笔专家对本文有同等贡献
讨论专家(按姓氏汉语拼音字母排序)
安纪红(内蒙古自治区人民医院感染科)
蔡建强(国家癌症中心国家肿瘤临床医学研究中心中国医学科学院北京协和医学院肿瘤医院肝胆外科)
蔡守旺(解放军总医院第一医学中心肝胆外科)
陈国凤(解放军总医院第五医学中心肝硬化中心)
陈红松(北京大学人民医院肝病中心)
陈京龙(首都医科大学附属北京地坛医院肿瘤介入科)
陈立刚(厦门大学附属中山医院消化科)
陈永鹏(南方医科大学南方医院感染中心)
陈 煜(首都医科大学附属北京佑安医院肝病中心四科)
段钟平(首都医科大学附属北京佑安医院肝病人工肝及疑难肝病中心)
邓国宏(陆军军医大学第一附属医院感染科)
高沿航(吉林大学第一医院感染科)
高艳景(山东大学齐鲁医院消化科)
高月求(上海中医药大学附属曙光医院肝病科)
韩 涛(天津市第三中心医院消化科)
韩 英(空军军医大学第一附属医院消化科)
何 清(深圳市第三人民医院肝病二科)
胡瑾华(解放军总医院第五医学中心肝衰竭中心)
黄 缘(清华大学附属北京清华长庚医院肝胆胰中心)
贾继东(首都医科大学附属北京友谊医院肝病中心)
江应安(武汉大学人民医院感染科)
姜小清(海军军医大学东方肝胆外科医院外科)
李 非(首都医科大学宣武医院普外科)
李 磊(首都医科大学附属北京佑安医院肝病消化中心)
蔺淑梅(西安交通大学第一附属医院消化科)
刘福全(首都医科大学附属北京世纪坛医院介入中心)
刘景丰(福建医科大学孟超肝胆医院肝胆胰外科)
陆伦根(上海市第一人民医院消化科)
陆 伟(天津市肿瘤医院消化科)
罗新华(贵州省人民医院感染科)
闾 军(首都医科大学附属北京佑安医院肿瘤内科)
马 红(首都医科大学附属北京友谊医院肝病中心)
南月敏(河北医科大学第三医院中西医结合肝病科)
任万华(山东第一医科大学附属省立医院感染科)
谭 林(阜阳市第二人民医院肝病二科)
陶开山(空军军医大学第一附属医院肝胆胰脾外科)
魏 来(清华大学附属北京清华长庚医院肝胆胰中心)
汪 静(西南医科大学附属中医医院感染科)
王凤梅(天津市第二人民医院消化科)
王宏光(中国医学科学院肿瘤医院肝胆外科)
王 磊(山东大学第二医院感染科)
温志立(南昌大学附属第二医院消化科)
文天夫(四川大学华西医院肝脏外科)
吴 彪(海南省人民医院感染科)
肖 宁(中国疾病预防控制中心寄生虫病预防控制所)
谢 雯(首都医科大学附属北京地坛医院肝病中心)
辛绍杰(解放军总医院第五医学中心肝衰竭中心)
刑卉春(首都医科大学附属北京地坛医院肝病中心)
杨积明(天津市第二人民医院肝病科)
杨 丽(四川大学华西医院消化科)
杨 玲(华中科技大学同济医学院附属协和医院消化科)
杨尹默(北京大学第一医院肝胆外科)
易永祥(南京市第二医院肝病中心)
尤 红(首都医科大学附属北京友谊医院肝病中心)
余祖江(郑州大学第一附属医院感染科)
张大志(重庆医科大学附属第二医院感染科)
张 国(广西自治区人民医院消化科)
张红光(镇江市第三医院肝病科)
张明香(沈阳市第六人民医院肝病科)
张跃新(新疆医科大学第一附属医院感染科)
赵 鸿(北京大学第一医院肝病中心)
赵景民(解放军总医院第五医学中心病理科)
周 俭(复旦大学附属中山医院肝肿瘤外科)
周永健(广州市第一人民医院消化科)
祖红梅(青海省第四人民医院肝病一科)
指导专家
庄 辉(北京大学医学部基础医学院病原生物学系)
董家鸿(清华大学附属北京清华长庚医院肝胆胰中心)
贾继东(首都医科大学附属北京友谊医院肝病中心)
段钟平(首都医科大学附属北京佑安医院肝病人工肝及疑难肝病中心)
谢渭芬(海军军医大学长征医院消化内科)
赵 平(中国癌症基金会学术部)
蔡建强(国家癌症中心国家肿瘤临床医学研究中心中国医学科学院北京协和医学院肿瘤医院肝胆外科)
南月敏(河北医科大学第三医院中西医结合肝病科)
魏 来(清华大学附属北京清华长庚医院肝胆胰中心)
秘书
韩 莹(首都医科大学附属北京佑安医院肝病中心二科)
高竹清(首都医科大学附属北京佑安医院肝病消化中心)
杜 旻(上海市肿瘤研究所癌基因与相关基因国家重点实验室)
张雯雯(解放军总医院肝胆胰外科医学部)
利益冲突:所有作者均声明不存在利益冲突