住院新生儿超说明书用药研究的系统评价
周怡廷,张钰,何华云,华子瑜
(重庆医科大学附属儿童医院,儿童发育疾病研究教育部重点实验室,国家儿童健康与疾病临床医学研究中心,儿童发育重大疾病国家国际科技合作基地,儿科学重庆市重点实验室,重庆 400014)
尽管新生儿医学研究已取得重大进展,但当前适用于新生儿的药物信息仍十分有限,在临床实际工作中常会因治疗需要而发生超说明书用药(off-label drug use)[1]现象。超说明书用药主要根据临床经验、专家意见或文献,并非不当或非法使用,但因缺乏药物有效性和安全性数据,可能会对新生儿造成严重后果[2]。因此,本研究在各国儿童超说明书用药研究[3-24]的基础上,对住院新生儿超说明书用药现状进行系统评价,评估住院新生儿超说明书用药的情况,了解用药特点,分析可能的原因及与药物不良反应的关系,并为今后降低新生儿超说明书用药发生率及相关研究提供建议和参考。
1 资料与方法
1.1 文献检索
计算机检索中国生物医学文献数据库(CBM)、中国知网(CNKI)、维普(VIP)、PubMed、EMBase数据库,中文检索词:说明书、超说明书、新生儿、婴儿、儿童、儿科;英文检索词:off-label use、drug labeling、off label、unlabeled、neonate、newborn、infant、baby、babies。检索时限均为建库至2019年12月。
1.2 纳入标准与排除标准
纳入标准:(1)国内外有关超说明书用药的观察性研究;(2)研究对象是住院新生儿;(3)提供患儿例数、超说明书用药例数、超说明书用药医嘱数等数据;(4)中、英文发表的全文或摘要。排除标准:(1)单独针对某类(种)药物或疾病的超说明书用药;(2)无法提取新生儿资料、超说明书用药资料的;(3)综述、报告、会议记录等或数据库重复收录的。
1.3 文献筛选提取和质量评价
由2名研究者筛选文献,按照统一格式对纳入文献进行数据提取和质量评价。每个过程均独立完成,如有不同意见则通过讨论达成一致后方可进入下一流程。提取数据:第一作者姓名、发表年份、国家、研究设计、药物信息参考来源、超说明书用药判断标准和分类、患儿例数、医嘱数及超说明书用药医嘱数、超说明书用药药品情况、超说明书用药发生的相关因素。质量评价采用澳大利亚Joanna Briggs Institute(JBI)循证卫生保健中心推荐的对现况调查类研究的质量评价工具[25],包含9个评价项目,需对每个项目作出“是、否、不清楚、不适用”的判断,最终讨论决定该研究是否纳入。
1.4 统计学方法
应用RevMan 3.4.0软件进行单个率的Meta分析,对率进行双反正弦变化后合并。I2>50%采用随机效应模型,提示各研究间具有异质性,反之则采用固定效应模型。所有检测均采用双侧检验,检验水准α=0.05。应用SPSS 25.0软件,分类变量采用χ2检验,同时制作柱状图、饼图来描述分布情况,P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果
检索出1 060篇相关文献,最终纳入22篇[3-24],见图1。
2.2 纳入研究的基本特征及质量评价
纳入文献发表时间为1999-2019年,涵盖17个国家,主要来自欧洲。欧洲起步最早(1999年)并持续关注;亚洲于2002年起步于以色列,发表时间集中于2016-2019年,主要来自中东地区;中国起步较晚(最早发表时间为2015年);美洲以巴西、加拿大为代表,共发表3个研究。纳入研究均有明确的药品纳入标准,除中国发表的2项研究[3,7]纳入所有药品外,其余研究排除的药品主要是水电解质平衡液、血液制品、肠外营养液等。所有研究均有超说明书用药医嘱的判断标准和分类。纳入研究采用的药品信息参考来源不一,7项研究[3,6-7,9,13-14,17]以药品说明书为依据,其余研究以药品管理部门批准发布的药品信息、行业协会编撰的药品信息集或指南手册、国家药典、临床用药信息数据库等为参考依据。纳入研究均为观察性研究,其中13项前瞻性研究,9项回顾性研究。14项研究[11-24]对象来自新生儿重症加护病房(NICU),其余8项[3-10]来自三级医院新生儿病房及NICU。共纳入3 400例次新生儿,47 226条用药医嘱,其中26 172条超说明书用药医嘱。纳入研究的基本特征及质量评价见表1。

图1 文献筛选流程

表1 纳入研究的基本特征及质量评价
2.3 超说明书用药类型
所有研究均定义了超说明书用药,以超出药品说明书建议的用药年龄、适应证、剂量、频次、用药途径使用药物为主。19项研究进一步报告了定义中涉及的各类型超说明书用药医嘱数据,主要为无儿童用药信息用药、超剂量用药、超频次用药及超年龄用药。
2.4 超说明书用药发生率Meta分析
因各研究存在异质性(I2>50%),采用随机效应模型分析,结果显示,超说明书用药新生儿比例92%(95%CI 85%~97%),超说明书用药医嘱比例52%(45%~69%),提示超说明书用药是新生儿病房的普遍现象。见图2、图3。
2.5 超说明书用药涉及药物类别
9项研究[3,7-11,15-17]按照解剖治疗化学分类系统(anatomical therapeutic chemical,ATC)对超说明书用药涉及药物进行分类,提示超说明书用药涉及抗感染药物(32.97%)、神经系统药物(14.33%)、心血管系统药物(12.82%)、呼吸系统药物(10.33%)、电解质平衡药物(9.89%)、血液系统药物(7.15%)、消化系统药物(5.40%)、遗传代谢及内分泌系统药物(2.78%)、其他(4.31%)。其中抗感染药物主要是氨苄西林、庆大霉素,主要原因是超剂量和频次。
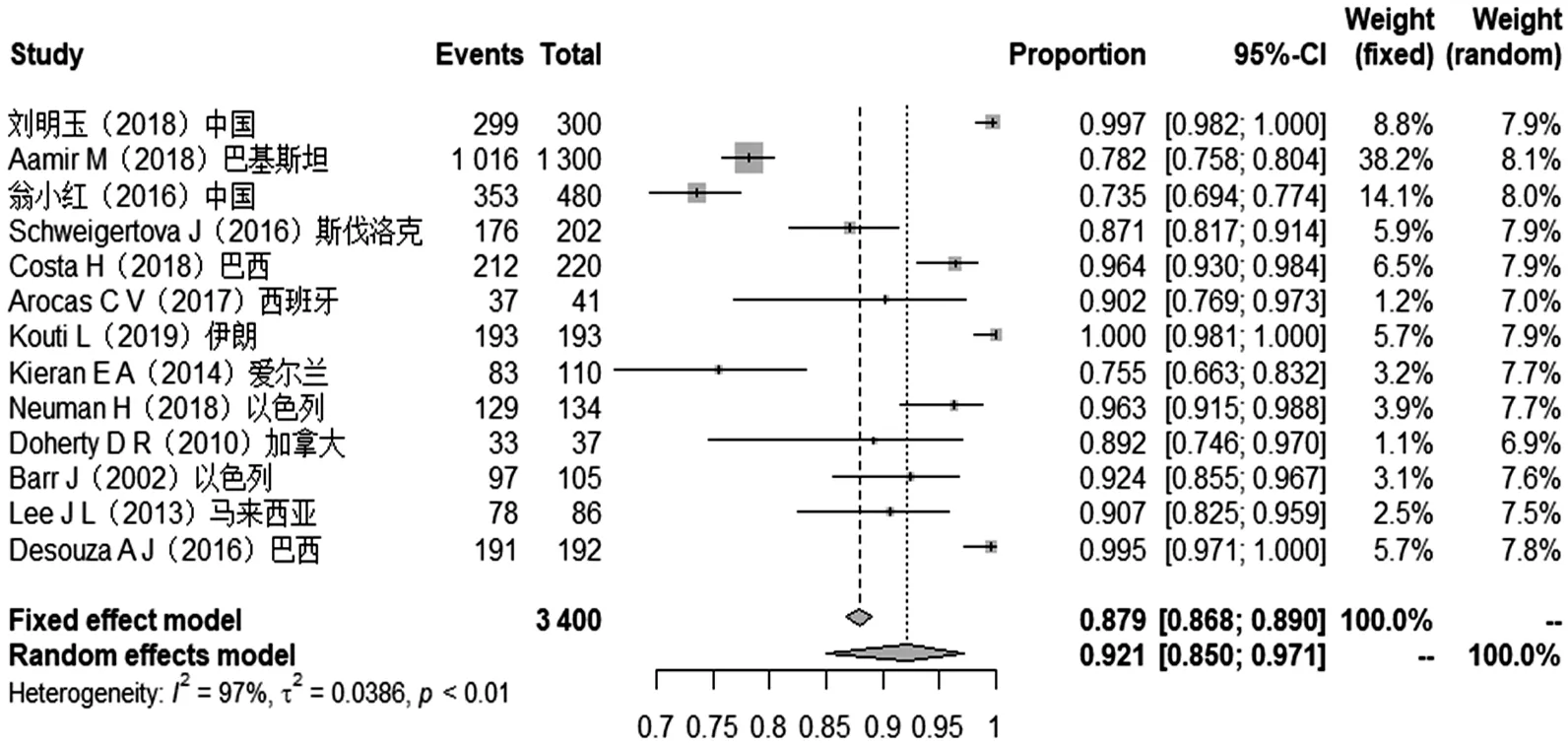
图2 超说明书用药新生儿比例森林图
2.6 超说明书用药的影响因素
Aamir M等[4]认为,早产、接受3种以上药物、住院时间>5 d是新生儿发生超说明书用药的危险因素;Mazhar F等[5]认为,住院时间长、机械通气、NICU治疗是危险因素;Kouti L等[12]认为,胎龄与超说明书用药发生率无相关性。巴基斯坦[4]、伊朗[12]、巴西[22]等研究显示,早产儿超说明书用药发生率是足月儿的1.174倍(P<0.01);NICU新生儿超说明书用药发生率显著增高,是新生儿病房的3.848倍。因此,早产、NICU新生儿更容易发生超说明书用药,见表4。

图3 新生儿医嘱超说明书用药发生率森林图

表4 住院新生儿超说明书用药的影响因素
3 讨论
本研究显示,住院新生儿超说明书用药发生率高达90%,且超说明书用药医嘱占比为50%以上。2015年发表的全球住院儿童超说明书用药系统评价[26]显示,新生儿超说明书用药发生率比其他年龄组儿童高,中位数为50.5%;2006年和2018年发表的儿科患者超说明书用药综述[27-28]中,新生儿超说明书用药发生率分别为93.0%、99.5%。这些文献与本研究结果一致,说明新生儿超说明书用药是临床普遍现象。
超说明书用药类型因研究而异,主要为“无儿童用药信息”用药或超年龄、剂量、频次,提示新生儿用药信息缺乏可能是导致超说明书用药的主要原因。这可能是由于缺乏临床药物试验[28],新生儿生长发育水平难以与年龄、体质量、体表面积等单一因素建立线性关系[29],药物研发具有难度;同时为了将药物推向市场,制药公司必须进行广泛的研究以提供产品数据,然而新生儿用药占药品市场比例较小,样本量获取困难,且由于情感原因和伦理风险,新生儿药物试验远比其他年龄组人群困难[30]。此外,因超剂量、频次(高于或低于药品说明书推荐)而发生超说明书用药的比例也较高。临床医师可能是基于临床经验或专家共识、新出现的证据而作出积极、理性的调整[31],如庆大霉素治疗新生儿败血症时[31-32],根据患者的年龄和肾功能,药品说明书建议每日总剂量分为2~3次,随后的临床效果显示每日1次的临床结局等效或优于前者,且毒性风险较低。这说明超说明书用药并不意味着不合理应用,可能是由于药品说明书更新滞后[33]。在新生儿临床药物试验提供更多的数据之前,临床决策应以现有的最佳证据为指导,在高质量研究的前提下,将研究发现的现有药物存在的超说明书用药使用情况纳入药品说明书或制定临床实践指南。
分析发现,超说明书用药药物主要是抗感染药物及神经系统、心血管系统、呼吸系统等疾病相关药物。抗感染药物是新生儿最常用的治疗类药物,其中氨苄西林、庆大霉素因超剂量和频次用药成为主要的超说明书用药药物。研究[14,8-10,18-24]显示,适度镇静、镇痛可减少氧耗,降低应激反应和代谢需求,避免酸中毒,改善呼吸机同步性、降低病死率[34],所以相关药物在NICU使用增多,以阿片类和苯二氮类为主[10],而这些药物的新生儿用药信息极其有限,属于超说明书用药药物。一项调查12个国家NICU用药情况的研究[35]显示,NICU最常用的20种药物中,含9种高危药物,包括芬太尼、吗啡、庆大霉素等。因此,在安全性和有效性证据不足情况下,新生儿超说明书用药存在较大安全隐患。
现有研究证实,超说明书用药会增加ADR发生率。Eguale T等[36]认为,超说明书用药是ADR的危险因素,抗感染药物、中枢神经系统药物ADR发生率明显高于其他药物。一项对欧美地区儿童ADR的研究[37]显示,52%ADR报告来自于2岁以内婴幼儿,尤其是新生儿,且超说明书用药的患儿发生ADR概率更高。Bellis J R等[38]认为,ADR主要为胃肠道或皮肤不良反应,ADR与超说明书用药显著相关,每增加1个超说明书用药药物,ADR风险增加23%。新生儿肝、肾等主要药物代谢器官尚未发育成熟,更容易受到药物的毒性作用,新生儿超说明书用药发生率高,ADR发生风险更高。但新生儿期是不断变化而且较短暂的时期,能被观察到的ADR数量和临床特征都可能随着日龄和生长发育阶段的不同而不同,需要根据其变化重新评估,而要从与器官功能障碍、发育不成熟和潜在疾病相关的混杂反应中鉴别出真正的ADR是很困难的[37],所以新生儿ADR发生率极可能被低估。本文纳入的研究中,几乎没有详细报告与新生儿超说明书用药相关的ADR,说明其监测颇具难度,也说明药品监测与ADR评价系统不成熟,应该成为新生儿医师、药理学研究者和临床药师的共同关注领域,通过协同工作和建立数据库改进监测系统,正确识别、主动监测ADR、报告和评估药物引起的危害,以提高药物使用的有效性和安全性。
本研究的不足之处在于:(1)仅检索PubMed和EMBase两个外文数据库,仅纳入中英文发表的研究,一些符合纳入标准的超说明书用药研究可能因未被数据库收录或者其他语言发表而被排除;(2)为了尽可能了解国内外住院新生儿超说明书用药情况,纳入不同地域研究,但每个研究设计存在异质性,可能会对最终结果产生影响;(3)纳入的研究是回顾性或前瞻性研究,其固有的偏倚风险高于随机试验。
综上所述,90%以上的住院新生儿发生过超说明书用药,新生儿用药信息的缺乏可能是导致超说明书用药的主要原因,而后者会增加新生儿ADR发生率,应关注药品ADR监测与评价系统,保障新生儿用药安全。

