马铃薯蛋白-黄原胶微凝胶的制备及其乳化特性研究
刘兴丽,杨龙松,赵双丽,吴凤,张华
1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001;2.食品生产与安全河南省协同创新中心,河南 郑州 450001;3.河南省冷链食品质量安全控制重点实验室,河南 郑州 450001
0 引言
马铃薯蛋白(PP)为马铃薯淀粉加工后的副产物[1],其氨基酸组成比例均衡,含有大多数谷物没有的赖氨酸,营养价值可与动物蛋白媲美[2].PP按相对分子质量大小可分为三部分:高相对分子质量蛋白、马铃薯糖蛋白、蛋白酶抑制剂[3].其中,马铃薯糖蛋白具有良好的凝胶形成性、起泡性、乳化性等功能性质[4].目前,我国对PP的研究较少且不深入,主要集中在淀粉废液中蛋白的分离、改性等方面.
微凝胶是通过生物大分子间的交联形成三维网络结构,同时保持大量的溶剂分子、尺寸在微米级及以下的凝胶颗粒[5].微凝胶在稳定乳液等方面有着广泛的应用,其制备方法主要包括静电复合法、喷射均质法等[6].其中,静电复合法是通过两种或两种以上聚合物间的静电吸引力而相互聚集,如通过阴离子多糖与带正电的蛋白质静电复合制备微凝胶.B.Yin等[7]利用大豆蛋白与大豆多糖,在pH值为3.5时所制备的静电复合物具有良好的乳化能力,乳液粒径达到250 nm,经过加热后的乳液可在NaCl浓度为200 mmol/L或pH值为2~8的介质中保持稳定.T.Tran等[8]通过研究大豆可溶性多糖对酸性大豆蛋白分散液和乳状液的稳定作用发现,二者之间相互作用的本质是静电复合,所得静电复合物可通过空间排斥作用有效改善基于大豆分离蛋白的O/W乳液的动力学稳定性.樊雪静等[9]利用大豆分离蛋白与寡糖在pH值为6.0时制备了静电复合物,发现大豆分离蛋白-水苏糖和大豆分离蛋白-棉子糖的乳化稳定性比大豆分离蛋白分别提高了132.40%和116.00%.以上研究表明,采用静电复合法制备的凝胶复合物可有效改善乳液的稳定性.
目前,与微凝胶相关的蛋白研究主要集中在蛋清蛋白、大豆蛋白等,而关于PP与多糖静电复合的研究未见报道.黄原胶属于阴离子多糖,在较低浓度时会形成不受温度、盐浓度变化影响的黏性溶液,与其他多糖溶液相比具有较高黏度,是一种非常有效的稳定剂.鉴于此,本文拟采用静电复合法制备马铃薯蛋白-黄原胶微凝胶(PP-XGM),并对其结构和乳化特性进行研究,以期为PP和多糖的开发利用提供一定的理论基础.
1 材料与方法
1.1 实验材料
PP(蛋白质量分数为90.01%),西安四季生物科技有限公司产.食品级黄原胶(XG),山东阜丰发酵有限公司产;福临门大豆油,中国粮油食品集团有限公司产.实验所用其他试剂均为分析纯.
1.2 主要仪器与设备
MS7-H550-Pro型磁力搅拌器,龙兴创实验仪器有限公司产;FE20 Plus 型pH测量计,梅特勒-托利多仪器有限公司产;LGJ-50FD型冷冻干燥机,京松源华兴科技发展有限公司产;Turbiscan Lab型多重光散射仪,法国Formulaction公司产;TD5M型低速离心机,上海卢湘仪离心机仪器有限公司产;Nano-ZS90型激光纳米粒度仪,英国Malvern公司产; FA25型高剪切分散乳化机,德国弗鲁克流体机械制造有限公司产;UV762型紫外分光光度计,上海仪电分析仪器有限公司产;JSM-7100F型场发射扫描电镜,日本电子公司产;F-7000型荧光分光光度计,日本日立公司产;JEM-100CX-Ⅱ型透射电镜,日本电子株式会社产.
1.3 实验方法
1.3.1PP-XGM的制备根据夏晓凤[10]的方法,略有改动.称取一定质量的PP(质量分数为1.00%)和XG(质量分数分别为0.05%、0.10%、0.20%、1.00%),分别用去离子水进行溶解,持续搅拌3 h,将制备好的溶液放入 4 ℃ 冰箱中过夜;将XG溶液加入到PP溶液中,持续搅拌 4 h,使用浓度为0.1 mol/L的HCl溶液将上述溶液pH值分别调节至2.0~4.0,得到相应pH值的PP-XG静电复合溶液;在80 ℃、90 ℃温度下,将上述静电复合溶液水浴加热不同时间后,立即放入冰水中冷却至室温,即得PP-XGM;最后将PP-XGM冻干保存,备用.
1.3.2ζ-电位的测定在激光纳米粒度仪上进行ζ-电位的测定.分别将冻干后的PP-XGM样品和马铃薯蛋白-黄原胶物理复合物(PP-XG)配成溶液,用相同pH值的磷酸盐缓冲液稀释到合适的质量浓度.测试温度为 25 ℃,设置平衡时间为2 min.
1.3.3 动力学稳定性的测定乳液的动力学稳定性由动力学稳定性指数(TSI)表征,乳液的TSI越大,表明其动力学稳定性越差;反之,乳液的TSI越小,表明其动力学稳定性越好[11].取 7.5 mL质量浓度为 0.001 g/mL 的蛋白微凝胶溶液,加入2.5 mL 大豆油,用高速分散均质机于19 000 r/min 条件下均质120 s,得到新鲜的皮克林乳液.在近红外光源波长880 nm,温度25 ℃条件下,使用多重光散射仪对样品进行动力学稳定性测定.在仪器配套的圆柱形玻璃管中加入20 mL样品,每隔25 s扫描一次,持续扫描1 h.
1.3.4 粒径的测定用磷酸盐缓冲液将样品稀释至相同质量浓度,采用激光纳米粒度仪对样品的平均表观流体力学粒径和多分散系数(PDI)进行测定[12],其中,PDI越小,说明颗粒的分布越均匀.测定温度为25 ℃,平衡时间为 2 min.
1.3.5 内源性荧光光谱的测定内源性荧光光谱用于评价色氨酸残基周围的构象变化.首先将PP、PP-XG、PP-XGM用磷酸盐缓冲液(pH=7.0,浓度为0.01 mol/L)稀释至质量浓度为1 mg/mL,然后用荧光分光光度计检测溶液的内源性荧光光谱[13].激发波长为290 nm,扫描发射光谱范围为300~420 nm,激发波长和发射波长狭缝宽度均为2.5 nm.
1.3.6 微观形貌的测定采用透射电镜观察PP-XGM的微观结构:取一滴样品稀释液(约20 μL)滴加到透射电镜专用的碳膜铜网上,吸附15 min后,用滤纸吸附多余部分,室温下干燥10 min,测试的加速电压为 80 kV.
1.3.7 乳化特性的测定取一定量的PP-XGM于容器中,加入浓度为0.01 mol/L的磷酸盐缓冲液(pH=7.0),将PP-XGM溶液的质量浓度稀释至 1 mg/mL;取1 mL稀释后的PP-XGM溶液加入3 mL大豆油中,用高剪切分散乳化机搅打2 min,设置转速条件为10 000 r/min;分别于0 min和10 min时从容器底部量取50 μL乳液,加入到5 mL 质量分数为0.1% 的十二烷基磺酸钠溶液中,充分混匀后,用紫外分光光度计测其吸光度值,波长设置为500 nm,以SDS空白溶液调零[14].乳液的乳化稳定性指数(ESI)计算公式如下:
式中,A0和A10分别表示乳液静置0 min和10 min的吸光度值.
1.4 数据分析
所有实验均重复3次,数据用Microsoft Excel 2016软件处理,结果以(平均值±标准差)的形式表示.用Origin 8.5软件作图、SPSS 17.0 软件进行显著性分析,采用Duncan’s多重比较法进行显著性检验,P<0.05为判定显著性的条件.
2 结果与分析
2.1 PP-XGM的制备条件分析
2.1.1pH值范围的确定pH值会影响蛋白质和多糖带电基团的解离程度,进而影响二者的相互作用[15].因此,在制备PP-XGM前,首先需要考查pH值对PP和XG的影响.pH值对PP和XG的ζ-电位的影响如图1所示.由图1可以看出,当pH值为4.3时,PP的ζ-电位为0;当pH值大于4.3时,PP的ζ-电位均为负值,带正电荷;当pH值小于4.3时,PP的ζ-电位均为正值,带负电荷.当pH值在2.0~8.0范围内时,XG的ζ-电位均为负值.随着pH值的增大,XG的羧基离子化程度增加,带电量增多,ζ-电位的绝对值越来越高.当pH值在 2.0~4.0范围内时,PP和XG带相反电荷,可实现二者之间有效的静电吸引作用.

图1 pH值对PP和XG的ζ-电位的影响Fig.1 Effect of pH value on ζ-potential of potato protein and xanthan gum

图2 pH值对皮克林乳液动力学稳定性的影响Fig.2 The effect of pH value on the dynamic stability of Pikering emulsion
2.1.2pH值对皮克林乳液动力学稳定性的影响依据2.1.1研究结果,进一步研究pH值在 2.0~4.0范围内的PP-XGM对乳液动力学稳定性的影响.pH值对皮克林乳液动力学稳定性的影响如图2所示.由图2可以看出,所有乳液样品的TSI均随时间的延长而不断增大,最后趋于平缓,说明时间越长,乳液越不稳定.当pH值为4.0和3.5时,所制备的PP-XGM稳定乳液的效果远远劣于其他pH值下所制备的PP-XGM.这可能是因为此时乳液的pH值处在蛋白质等电点附近,PP发生自聚集,与XG相互作用较弱.当pH值为3.0时,乳液的TSI最低,说明该条件所制备的PP-XGM稳定乳液的效果较好.
2.1.3 热处理条件对皮克林乳液动力学稳定性的影响热处理条件对皮克林乳液动力学稳定性的影响如图3所示.未经热处理的PP与XG所形成的静电复合物是可逆的,在复合物溶液 pH值高于蛋白质等电点的情况下,不能形成相互作用的聚集体.热处理可使蛋白质分子结构被破坏,与多糖结合的位点增加,疏水基团暴露,疏水相互作用增强,同时,热处理也使多糖的构象发生改变,二者的相互作用增强[16].另一方面,热处理可减少可逆反应的发生,提高聚合物的稳定性,抑制蛋白质分子间的聚集.由图3可以看出,与90 ℃热处理不同时间所制备的PP-XGM相比,80 ℃热处理不同时间所制备的PP-XGM稳定乳液的效果更好.这可能是因为超过一定温度后,PP变性严重,PP与XG形成的微凝胶界面活性下降,从而稳定乳液的能力下降.另外,由80 ℃热处理30 min所制备的PP-XGM稳定的乳液,其TSI最低,表明其动力学稳定性最好.
2.1.4 不同PP/XG质量比对皮克林乳液动力学稳定性的影响XG的加入可增加蛋白质的润湿性、分子的伸展程度和疏水基团的暴露.当XG质量分数较低时,因其不足以覆盖所有液滴,会发生桥架絮凝现象;当XG质量分数过高时,又会发生排斥絮凝现象[17].因此,XG和蛋白质的质量比会影响乳液的动力学稳定性.保持PP质量分数为1.00%,溶液pH值为3.0,80 ℃热处理30 min,PP/XG质量比对皮克林乳液动力学稳定性的影响结果如图4所示.由图4可以看出,当PP/XG质量比为51时,乳液动力学稳定性最差.这可能是因为在pH值为3.0时,PP所带正电荷与XG所带负电荷相中和,使复合物所带净电荷接近于0,此时所形成的PP-XGM吸附的油滴无法抵抗吸引力而发生絮凝,乳液的TSI随之减小.当PP/XG质量比分别为201,101和11时,乳液的各TSI变化曲线相近,TSI均较小,其中,当PP/XG质量比为11时,乳液的动力学稳定性最好.
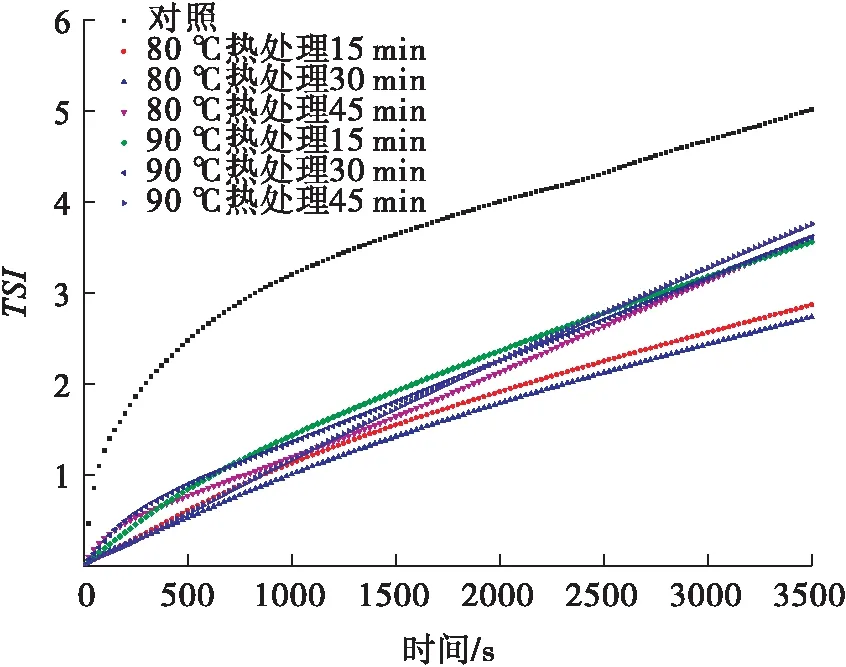
图3 热处理条件对皮克林乳液动力学稳定性的影响Fig.3 The effect of heat treatment conditions on the dynamic stability of Pickering emulsion
2.2 PP-XGM的结构表征分析
2.2.1PP-XGM的粒径和PDI分析PP、PP-XG 和PP-XGM的粒径和PDI检测结果见表1.由表1可知, PP-XG和PP-XGM的粒径较PP均明显增大.这是因为XG本身的粒径较大,XG和PP以静电作用形成复合物后,该复合物的粒径明显增大.PP-XGM的粒径(473.10 nm)远大于PP-XG的粒径(222.85 nm),这可能是因为加热导致蛋白质分子结构被破坏,与多糖结合位点增加,相互作用增强,形成了较大的聚集体[18].PP-XGM的PDI明显小于未处理的PP-XG,说明形成微凝胶后,颗粒分布更均匀.

图4 PP/XG质量比对皮克林乳液动力学稳定性的影响Fig.4 The effect of potato protein/xanthan gum mass ratio on the dynamic stability of Pickering emulsion
2.2.2PP-XGM的内源性荧光光谱分析PP-XGM的内源性荧光光谱和荧光指数(FI)如图5和表2所示.由图5和表2可知,与PP相比,PP-XG和PP-XGM的最大吸收波长λmax发生了不同程度的蓝移,这可能是因为热处理时,原来包埋在PP分子内的色氨残基被暴露在溶剂中,而疏水作用又将色氨残基重新包埋[19].PP-XGM的λmax向更短波长处移动,这是由于PP与XG通过静电、氢键等非共价相互作用引起了蓝移.PP-XGM的荧光强度(FI)下降最显著,这可能是因为XG与PP之间的静电相互作用导致蛋白质构象改变,发生荧光猝灭.
2.2.3PP-XGM的微观形貌分析PP-XGM的微观形貌如图6所示.由图6可以看出,PP为单分散的球形颗粒,与XG静电复合后,PP-XG为圆球状.将PP-XGM中的单一颗粒放大后发现,核与壳的密度不同,说明PP-XGM为核壳结构.有研究表明,核壳结构内部为蛋白质,外部较疏松的结构为多糖[12].PP与XG通过静电作用形成PP-XG,当蛋白质被加热到接近其热变性温度时,会从PP-XG中分离出来,并聚集在一起形成蛋白质核,而蛋白质表面的阳离子与带负电的XG相互吸引,形成具有核壳结构的颗粒.PP-XGM的尺寸小于通过激光粒度仪测得的粒径.这可能是因为纳米颗粒中大部分水分在TEM的高真空室内蒸发,导致一些颗粒收缩.由图6c)可知,PP-XGM与背景对比强烈,表明PP与XG交联紧密.

表1 PP、PP-XG和PP-XGM的粒径和PDI检测结果

图5 PP、PP-XG和PP-XGM的内源性荧光光谱Fig.5 Endogenous fluorescence spectra of PP、PP-XG and PP-XGM

表2 PP、PP-XG和PP-XGM的荧光指数
2.3 PP-XGM的乳化特性分析
油相的体积分数在乳状液乳化过程中起主导作用.PP、PP-XG和PP-XGM对乳液乳化稳定性的影响如图7所示.由图7可以看出,所有实验组别的ESI值均随油相体积分数的增加呈先增大后减小的趋势,其中,由PP和PP-XG稳定的乳液在油相体积分数为40%时稳定性最好.这是因为油相体积分数的增加提高了乳液黏度,降低了乳化速度[20].而随着油相体积分数的进一步增加,颗粒的数量变得不足以完全稳定油滴,乳液的稳定性下降[21].在油相体积分数相同的条件下, PP-XGM的乳化稳定性高于PP,这一方面可能是因为PP-XGM的电位绝对值越大,微凝胶表面所带电荷越多,颗粒之间的静电斥力越强,可有效抑制颗粒之间的聚集,提高乳液稳定性;另一方面可能是因为由PP稳定的乳液中絮凝物以开放的结构存在,而由PP-XGM稳定的乳液中,油滴被固定在微凝胶网络结构中,乳液的稳定性增强[22].此外,PP-XGM吸附到油滴表面可增加水相黏度,抑制液滴的移动,进而提高乳液的稳定性[23].

图6 PP、PP-XG和PP-XGM的微观形貌Fig.6 Micro-morphology of PP、PP-XG and PP-XGM

图7 PP、PP-XG和PP-XGM对乳液乳化稳定性的影响Fig.7 The influence of PP,PP-XG and PP-XGM on the emulsification stability of emulsion
3 结论
本研究对PP-XGM的制备条件进行了优化,确定了PP-XGM的最佳制备条件为PP/XG质量比11,pH值3.0,80 ℃热处理 30 min.结构表征分析发现:静电复合后,PP-XGM的粒径变大,PDI变小,颗粒分布更均匀;与PP相比,PP-XG和PP-XGM的最大吸收波长λmax发生了不同程度的蓝移,且PP-XGM的FI下降最显著; PP-XGM呈核壳结构.制备条件优化后的PP-XGM可提高乳化体系的稳定性.该研究可为马铃薯蛋白及多糖资源的开发利用提供一定的技术支持.

