兔羊膜间充质干细胞的体外分离培养及鉴定
荣 誉,郭东新,田 河
(1.辽宁中医药大学 实验动物中心,沈阳100032;2.沈阳农业大学 畜牧兽医学院,沈阳110161)
近20 年来,干细胞生物学受到广泛关注,人们对干细胞的优点有了更深入的认识,同时也探索了将其应用在不同领域的潜力[1-2]。 干细胞已经用于治疗人类血液系统疾病和皮肤再生,但在人类其他疾病的应用还处于探索阶段[3-4]。在兽医领域,大量的动物试验为细胞疗法在多种疾病治疗作用的评估提供了坚实的基础[5-6]。间充质干细胞(mesenchymal stem cells, MSCs)是由早期中胚层发育而来的非造血成体干细胞,该细胞在体外可以贴壁生长,并呈现梭型[7]。 在适当条件下可以大量扩增,并转化为间充质祖细胞,进而分化成各种组织细胞,如脂肪、骨、成纤维细胞等。 羊膜是胎膜最内层,是由羊膜间充质干细胞和羊膜上皮细胞组成的,许多研究已经证实这两种细胞都具有干细胞特征。 胎盘在胎儿出生后常被丢弃,而动物在分娩后会吃掉胎盘,可以说胎盘是在胎儿产出后的废弃物。 SCHERJON 等[8]从羊膜培养、扩增出间充质干细胞,并诱导分化,表达了脂肪细胞和软骨细胞的表型,证实了其干细胞特性。 羊膜来源广泛,取材方便,并且无伦理学限制,与其他间充质干细胞来源组织相比,具有无可比拟的优越性[9]。 本研究以人羊膜间充质干细胞的相关研究为基础,分离培养兔羊膜间充质干细胞,研究其基本生长特点,鉴定其干细胞相关基因和蛋白的表达,以期为兽医领域提供新的干细胞来源。
1 材料与方法
1.1 试验动物
2 只2 岁龄清洁级雌性待产新西兰大白兔,由沈阳农业大学畜牧兽医学院提供。动物处理符合机构实验室动物使用指南。
1.2 试剂
DMEM/F12 培养液、DPBS 缓冲液、LG-DMEM 培养液、胎牛血清、0.25%胰蛋白酶-0.02%EDTA、二甲基亚砜(DMSO)、Ⅰ型胶原酶、双抗,均购自美国Gibco 公司;山羊血清,购自中国北京市博奥森生物技术有限公司;台盼蓝染色液、4%多聚甲醛固定液, 购自中国北京市索莱宝科技有限公司;PE-CD29、PE-CD34、PE-CD49d、PECD73、FITC-CD45、FITC-HLA-DR,均购自美国BD 公司;地塞米松、胰岛素、3-异丁基-1-甲基黄嘌呤、吲哚美辛、β-甘油磷酸钠、牛血清白蛋白、茜素红、油红O、DAPI,均购自美国Sigma 公司;碱性磷酸酶显色试剂盒购自北京康为世纪有限公司。
1.3 仪器设备
全自动高压灭菌锅(日本TOMY 公司)、微量移液器(德国Eppendorf 公司)、超净工作台(中国江苏省苏净集团有限公司)、二氧化碳培养箱(美国Thermo 公司)、电子分析天平(德国Sartorius 公司)、冷冻离心机(德国Eppendorf 公司)、普通电冰箱(0~4℃)(中国青岛市海尔股份有限公司)、超低温电冰箱(日文SANYO 公司)、电热恒温水浴锅(中国北京市长风仪器仪表有限公司)、倒置相差显微镜(日本Olympus 有限公司)、激光共聚焦显微镜(德国Leica 公)、流式细胞仪(美国BD 公司),以及培养皿、离心管、培养板、冻存管(美国Corning 公司)。
1.4 方法
1.4.1 rAMSCs 的分离培养 参考人羊膜间充质干细胞的分离方式,将待产母兔用丙泊酚诱导麻醉后,再使用异氟烷气体维持麻醉,通过剖腹产手术取出胎儿并获取兔胎盘组织,放入含双抗的无菌生理盐水瓶中保存并运送至试验室。在超净工作台中用下机械剥离羊膜层与绒毛膜层,其中透明且没有血管的一层为羊膜。将剥离下的羊膜放入无菌生理盐水中清洗数次,再使用DPBS 清洗3 次。 使用眼科镊子与剪刀将羊膜组织剪碎,移入50mL 离心管中,每管加入5mL 羊膜组织,等待进一步处理。接下来分两步对收集的羊膜进行处理:首先去除羊膜上的单层上皮,向离心管中加入5mL 0.25%胰蛋白酶-0.02%EDTA,放入37℃水浴锅中消化30min,然后加入10mL 含10%胎牛血清的DMEM/F12 培养液终止消化,1500r·min-1离心5min 弃去上清, 使用DPBS 重悬后再次离心,重复操作2 次对羊膜进行清洗以除去消化掉的上皮细胞;然后,向经过清洗的羊膜组织中加入5mL 含有1mg·mL-1的Ⅰ型胶原酶,37℃水浴锅中消化60min,然后加入10mL 含10%胎牛血清的DMEM/F12 培养液终止消化,消化液经过细胞筛过滤后移入10mL 离心管,1500r·min-1离心5min 后弃去上清,细胞沉淀经DMEM/F12 培养液(含10%胎牛血清、100U·mL-1青霉素和100μg·mL-1链霉素)重悬后接种到培养瓶中,放入37℃,5%CO2饱和湿度条件下培养,每隔2d 换液,每天观察细胞生长情况。
1.4.2 rAMSCs 的传代培养 当原代培养的细胞的汇合度达到80%~90%时,弃掉旧培养液,使用DPBS 清洗细胞2 遍,加入2.5mL 0.25%胰蛋白酶-0.02%EDTA,放入37℃培养箱中消化2min,倒置显微镜下观察,当大部分细胞收缩为圆形并漂浮起来后,加入5mL 含有10%胎牛血清的DMEM/F12 培养液终止消化,反复轻柔吹打使培养皿底部的细胞全部漂浮于培养液中。将细胞悬液移入10mL 离心管中,1500r·min-1离心5min 后弃去上清,细胞沉淀经DMEM/F12 培养液(含10%胎牛血清、100U·mL-1青霉素和100μg·mL-1链霉素)重悬后接种到培养瓶中,放入37℃,5%CO2饱和湿度条件下培养,每隔2d 换液,当细胞的汇合度达到80%~90%时再次传代培养。
1.4.3 rAMSCs 的生长曲线测定 取生长良好的P3 和P10 代rAMSCs,弃掉旧培养液,使用DPBS 清洗细胞2遍,加入2.5mL 0.25%胰蛋白酶-0.02%EDTA,放入37℃培养箱中消化2min,然后在显微镜下观察,当大部分细胞收缩为圆形并漂浮起来后,加入5mL 含10%胎牛血清的DMEM/F12 培养液终止消化,反复轻柔吹打使培养皿底部的细胞全部漂浮于培养液中,再将细胞悬液移入10mL 离心管中,1500r·min-1离心5min 后弃上清,加入DMEM/F12 培养液(含10%胎牛血清、100U·mL-1青霉素和100μg·mL-1链霉素)重悬细胞沉淀,调整细胞浓度后接种在24 孔板中,每孔3×104个细胞,每隔2d 换液。从第2 天起,每隔1d 随机选取3 孔细胞进行计数,并求3 个孔的平均值,连续计数8d。 以培养时间为横坐标,细胞数量为纵坐标,绘制生长曲线。
1.4.4 rAMSCs 的冻存 取生长良好的P3 代rAMSCs,弃掉旧培养液,使用DPBS 清洗细胞2 遍,加入2.5mL 0.25%胰蛋白酶-0.02%EDTA,放入37℃培养箱中消化2min,倒置显微镜下观察,当大部分细胞收缩为圆形并漂浮起来后,加入5mL 含有10%胎牛血清的DMEM/F12 培养液终止消化,反复轻柔吹打使培养皿底部的细胞全部漂浮于培养液中。将细胞悬液移入10mL 离心管中,1500r·min-1离心5min 后弃去上清,每个离心管中加入1mL 提前预冷的冻存液(含有450μL DMEM/F12 培养液、500μL 胎牛血清和50μL DMSO)重悬细胞,将细胞悬液移入冻存管中,标记好细胞名称、冻存时间和操作人。 立即将装有细胞的冻存管依次置于4℃冰箱30min,-20℃冰箱2h,-80℃冰箱过夜。 第2 天将这些冻存管转入液氮罐中长期保存。
1.4.5 rAMSCs 的复苏 取保存在液氮罐中的冻存管,放入提前预热好的37℃水浴锅中,快速摇晃冻存管使其解冻,当冻存管中还存在一粒小冰块时,使用75%酒精对冻存管外部消毒后移入超净工作台。 用移液器将冻存管中的细胞悬液移入10mL 离心管中,1500r·min-1离心5min 后弃去上清,加入DMEM/F12 培养液(含10%胎牛血清、100U·mL-1青霉素和100μg·mL-1链霉素)重悬细胞沉淀,调整细胞浓度后接种在培养皿中,放入37℃,5%CO2饱和湿度条件下培养,1d 后换液。 取复苏后的细胞悬液,调整细胞密度为1×106个·mL-1,将100μL 0.4%台盼蓝染色液与900μL 细胞悬液混合均匀,使用细胞计数板分别技术活细胞和死细胞,计算细胞复苏率。
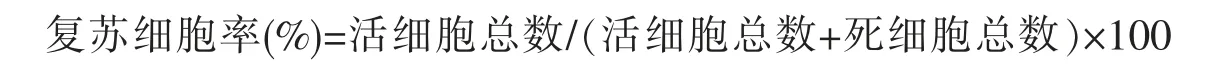
1.4.6 免疫荧光检测OCT4、SOX2 和NANOG 的表达 (1)取生长良好的P3 代rAMSCs,经消化离心并重悬后,接种在放有载玻片的24 孔板中,生长至60%~70%的汇合度时,移液器吸去旧的培养液,每孔500μL DPBS 轻柔冲洗3 次,弃去DPBS 后加入500μL 4%多聚甲醛,放入4℃冰箱中过夜固定;(2)次日弃去固定用的4%多聚甲醛,使用含有2%BSA 的DPBS 轻柔冲洗3 次,加入500μL TritonX-100 于37℃温箱中通透2h,再使用含有2%BSA 的DPBS 轻柔冲洗3 次;(3) 加入500μL 山羊血清于37℃温箱中封闭2h, 再使用含有2%BSA 的DPBS轻柔冲洗3 次;(4)分别加入100μL 经过稀释的OCT4、SOX2 和NANOG 一抗于4℃冰箱过夜孵育,使用DPBS代替一抗作为阴性对照;(5)加入含有2% BSA 的DPBS 放在摇床上清洗5min,加入100μL 经过FITC 标记的IgG 二抗,于37℃温箱中避光孵育2h,再使用含有2%BSA 的DPBS 轻柔冲洗3 次;(6)加入100μL DAPI 染液于37℃温箱中孵育10min;(7)使用含有2%BSA 的DPBS 轻柔冲洗3 次后取出载玻片,通过激光共聚焦显微镜拍照。
1.4.7 流式细胞技术鉴定细胞表型 取生长良好的P3 代rAMSCs,弃掉旧培养液,使用DPBS 清洗细胞2 遍,加入2.5mL 0.25%胰蛋白酶-0.02%EDTA,放入37℃培养箱中消化2min,加入5mL 含有10%胎牛血清的DMEM/F12 培养液终止消化。 将细胞悬液移入10mL 离心管中,1500r·min-1离心5min 后弃去上清,使用DPBS 重悬细胞沉淀并将细胞密度调整为1×107个·mL-1;在多支10mL 离心管中加入细胞悬液100μL,分别加入使用FITC标记的CD45, HLA-DR 和PE 标记的CD29,CD34,CD49d,CD73 抗体,37℃温箱孵育30min,然后加入2mL DPBS溶液,混匀后1500r·min-1离心5min 后弃去上清,每管再使用500μL DPBS 重悬,将样品送入流式细胞仪进行检测。 使用DPBS 代替抗体作为对照,每次检测使用10000 个细胞,通过Cell Quest 软件对结果进行分析。
1.4.8 成脂诱导分化 取在6 孔板中培养的生长良好的P3 代rAMSCs,当生长至80%~90%汇合度时,弃掉旧培养液,DPBS 清洗2 遍,试验组加入成脂诱导培养液,对照组加入LG-DMEM 完全培养液,每3d 换液,共诱导21d。
通过油红O 染色鉴定诱导后细胞中的脂肪滴。 细胞诱导21d 后,弃去旧的培养液,使用DPBS 轻柔冲洗2遍,4%多聚甲醛提前预冷后加入6 孔板中,移入4℃冰箱中固定1h,再DPBS 轻柔冲洗3 次,60%异丙醇轻柔冲洗1 次,加入油红O 染色工作液,室温染色10min,使用100%异丙醇轻柔冲洗1 次终止染色,再用DPBS 冲洗2 次,通过倒置显微镜观察并拍照。
1.4.9 成骨诱导分化 选取在6 孔板中培养的生长良好的P3 代rAMSCs,当生长至80%~90%汇合度时,弃掉旧培养液,DPBS 清洗2 遍,试验组加入成骨诱导培养液,对照组加入LG-DMEM 完全培养液,每3d 换液,共诱导28d。
通过碱性磷酸酶染色鉴定诱导后细胞中成骨细胞的标志性酶。 细胞诱导28d 后,弃去旧的培养液,使用DPBS 轻柔冲洗2 遍,4%多聚甲醛提前预冷后加入6 孔板中,移入4℃冰箱中固定1h,再DPBS 轻柔冲洗3 次,加入碱性磷酸酶染色液,室温避光染色20min,使用DPBS 冲洗2 次终止染色,通过倒置显微镜观察并拍照。
通过茜素红染色鉴定诱导后细胞的钙盐沉积。 细胞诱导28d 后,弃去旧的培养液,使用DPBS 轻柔冲洗2遍,70%乙醇提前预冷后加入6 孔板中,移入4℃冰箱中固定1h,再DPBS 轻柔冲洗3 次,加入0.1%茜素红染色液,室温染色20min,使用DPBS 冲洗2 次终止染色,通过倒置显微镜观察并拍照。
2 结果与分析
2.1 细胞形态学观察
通过酶消化法分离获得的rAMSCs 呈典型的BMSCs 样,刚接种的细胞在培养液中呈大小不等的圆形和细胞团块(图1A);培养24h 后还有大量未贴壁细胞悬浮在培养液中,但已开始有部分细胞开始贴壁生长,细胞形态多样;72h 后细胞开始快速增殖,首次全量换液除去未贴壁细胞,可以观察到细胞呈卵圆形、长梭形和多角形等不规则形(图1B);6~8d 后原代培养的细胞生长到80%~90%汇合度,此时可以传代培养,经过多次换液和传代培养后,杂细胞逐渐清除,细胞得到纯化,P3代细胞形态单一,形态呈长梭形(图1C)。 P1~P6 代rAMSCs 生长速度较快,6d 即可铺满培养瓶底部, 形态均一呈长梭形,P7~P10 代rAMSCs 生长减缓,8~10d 铺满瓶底,P11 代以后,细胞生长更加缓慢且形态扁平不规则,胞浆内有折光性颗粒,并伴有细胞崩解死亡(图1D)。
2.2 细胞生长曲线
P3 代和P10 代rAMSCs 的生长曲线都呈“S”型(图2),1~2d 为潜伏期,细胞生长平缓,3~6d 为对数期,细胞生长迅速,7~8d 为平台期,生长趋于平缓,随后细胞生长进入停滞状态。 P3 代细胞增值能力强,细胞生长速度较快,而P10 代细胞生长缓慢。
2.3 免疫荧光检测干细胞标志蛋白OCT4、SOX2 和NANOG 的表达
通过免疫荧光对P3 代rAMSCs 检测干细胞标志蛋白OCT4、SOX2 和NANOG 的表达, 结果显示rAMSCs的细胞核呈蓝色荧光,细胞质中存在绿色荧光。 对照组以DPBS 代替一抗,细胞质中没有荧光出现。 说明rAMSCs表达OCT4(99.53%)、SOX2(98.36%)和NANOG(98.87%)蛋白(图3)。
2.4 流式细胞术鉴定细胞表型
通过流式细胞仪鉴定经抗体标记的P3 代rAMSCs,结果显示,CD34 的表达率为0.87%;CD45 的表达率为0.42%;HLA-DR 的表达率为0.35%;CD29 的表达率为99.67%;CD49d 的表达率为99.36%;CD73 的表达率为99.12%; 以DPBS 代替抗体的对照组结果呈阴性表达(图4)。 结果表明,P3 代rAMSCs 低表达CD34、CD45 和HLA-DR,高表达CD29、CD49d 和CD73。
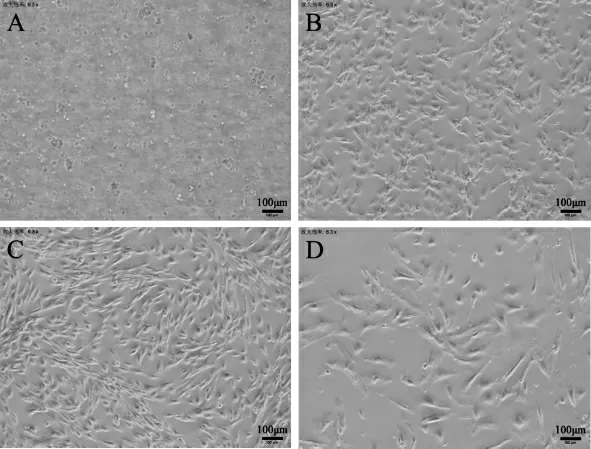
图1 rAMSCs 的细胞形态Figure 1 Cell morphology of rAMSCs
2.5 成脂肪细胞诱导分化结果
试验组rAMSCs 细胞经成脂诱导培养21d 后,细胞形态由长梭形逐渐变为卵圆形或多角形, 细胞体积增大, 油红O 染色可发现细胞质中存在大量砖红色脂肪滴(图5A)。对照组的细胞形态始终为长梭形,油红O 染色的结果呈阴性(图5B)。
2.6 成骨细胞诱导分化结果
试验组rAMSCs 细胞经成骨诱导培养28d,细胞形态由长梭形逐渐转变成多角形,部分细胞出现堆积生长,出现细胞团块,碱性磷酸酶染色可将成骨细胞染成紫色(图6A),茜素红染色将沉积的钙盐染色成深红色(图6B);对照组的细胞形态始终为长梭形,碱性磷酸酶染色结果均为阴性(图6C)茜素红染色也未见钙盐沉积(图6)。
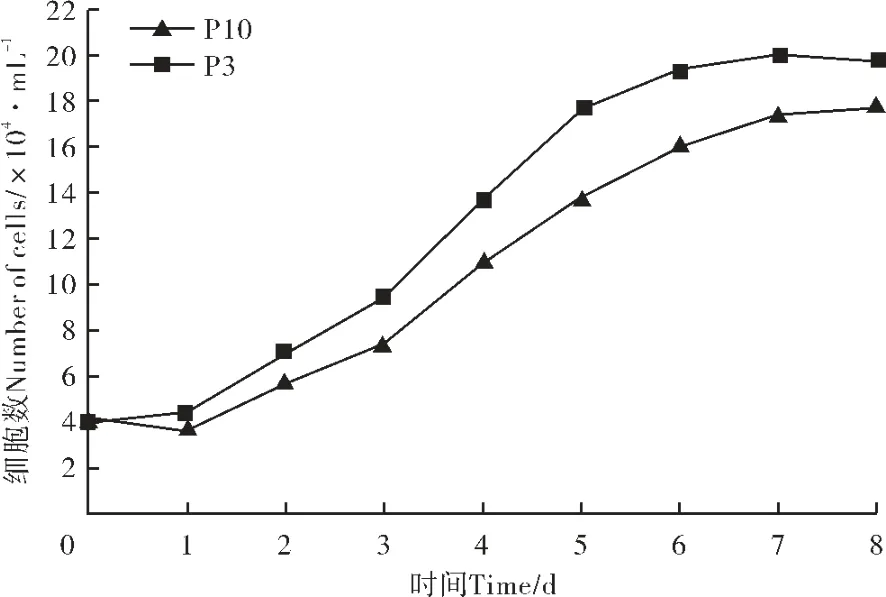
图2 rAMSCs 的生长曲线Figure 2 Growth curve of rAMSCs

图3 免疫荧光检测OCT4、SOX2 和NANOG 的表达Figure 3 Expression of OCT4, SOX2 and NANOG on rAMSCs detected by immunofluorescence
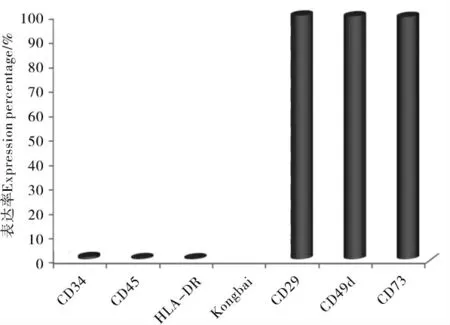
图4 rAMSCs 细胞表型表达率Figure 4 Expression of cell surface markers on rAMSCs detected by flow cytometry

图5 成脂诱导分化Figure 5 Adipogenic differentiation of rAMSCs
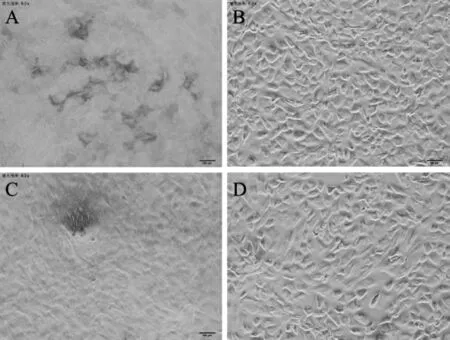
图6 成骨诱导分化Figure 6 Osteogenic differentiation of rAMSCs
3 讨论与结论
MSCs 来源于组织发育早期的中胚层与外胚层,是干细胞的一种,具有多向分化潜能、自我复制和免疫调控等特点,在组织工程领域具有重要的应用前景[10]。 MSCs 主要来源于骨髓,但是骨髓源MSCs 具有一些缺点:(1)供体年龄越大,细胞增殖能力下降;(2)采集过程中可能受到病毒感染;(3)采集过程较痛苦。这些缺点大大限制了骨髓源MSCs 的发展。因此,需要寻找新的细胞来源[11]。AMSCs 是提取自新鲜羊膜组织的细胞,同样具有自我复制和多向分化潜能,来源广泛可塑性高,是组织工程的理想种子细胞。
胎盘是母亲与胎儿之间提供物质交换的器官,在妊娠期间可以为胎儿提供必须的各种营养和氧气,胎盘组织从内到外依次由羊膜、绒毛膜和底蜕膜3 层膜结构组成,胎盘的羊膜层位于最内层,是一层薄而透明的膜,表面光滑,没有神经、淋巴管和血管分布,由表层的单层上皮和内部基质层两层结构构成[12]。 研究表明,胎盘组织含有多种干细胞,已从多种动物胎盘的不同部位分离出间充质干细胞,如脐带、脐带血、羊水、羊膜和绒毛膜等,从这些组织分离出的干细胞具有共同特点:(1)非侵入性、取材简单;(2)无伦理限制;(3)细胞纯度高;(4)分离得到的细胞量大[13]。 经鉴定,这些细胞都具有干细胞的特征,包括自我更新能力和多向分化潜能[14]。 近年来,兔间充质干细胞已经应用于临床研究,但其来源较单一,大部分是从骨髓与脂肪组织中获取,因此,有必要为其提供新的干细胞来源。
羊膜由最内层的单层上皮、中间的基底层与致密层和外面的间质层构成。 这3 层结构均不含神经、血管和淋巴管,组织细胞所需的营养均来自羊水。 rAMSCs 存在于间质层,因此在分离细胞时,需要通过胰蛋白酶除去上皮细胞,再使用胶原酶消化剩余的组织,最后将羊膜组织分散为单个rAMSCs 细胞或小细胞团。 但是在实际操作中,酶对羊膜组织的消化作用不可能受到精准控制。 因此,原代培养的rAMSCs 中可能混含有羊膜上皮细胞。 由于羊膜上皮细胞贴壁牢固不易被消化掉,因此,经过多次换液和传代培养后,羊膜上皮细胞逐渐清除,剩下的是增殖迅速的rAMSCs。
本研究通过酶消化法分离获得的rAMSCs 呈典型的BMSCs 样,P3 代细胞形态均一, 呈长梭形, 旋涡状生长,纯度较高,生长旺盛,优与P10 代细胞。 P3 代细胞经过冻存复苏后,复苏率较高,达到70%以上,复苏的P3代细胞与冻存前细胞形态基本一致,并且生长良好,都可以进行连续传代培养,说明本研究分离培养的rAMSCs 可以进行冷冻保存。 OCT4、SOX2 及NANOG 是维持和调节胚胎干细胞自我更新能力和多向分化潜能的调控因子,是干细胞的标志基因,三者存在密切的协同作用,共同维持着细胞的“干性”[15]。本研究通过免疫荧光发现,OCT4、SOX2 及NANOG 在rAMSCs 呈阳性表达,说明分离得到的rAMSCs 存在较强的自我更新能力。
通常使用含有3-异丁基-1-甲基黄嘌呤、地塞米松、胰岛素、吲哚美辛和胎牛血清的LG-DMEM 培养液对MSCs 进行成脂诱导分化[16]。 浓度为1μmol·L-1的地塞米松能够将MSCs 细胞膜上的糖皮质激素受体激活,促进MSCs 分化为脂肪细胞;吲哚美辛可以激活MSCs 中的PPARγ 通路,提高脂肪诱导剂cAMP 在细胞内的表达;胰岛素能够激活细胞中的ERK1/ERK2 信号通路,提高PPARγ 的表达,从而促进向脂肪细胞的分化。油红O 是一种具有脂溶性特性的染料,能够与脂肪细胞中油脂发生颜色反应,可用于成脂诱导分化的鉴定[17]。 本研究使用以上几种成分的培养液对rAMSCs 进行成脂诱导分化,经过21d 后可以发现,细胞形态由长梭形逐渐变为卵圆形或多角形,细胞体积增大,油红O 染色可发现细胞质中存在大量砖红色脂肪滴,染色结果呈阳性,说明成功将rAMSCs 诱导分化为脂肪细胞。
体外诱导MSCs 分化为成骨细胞时,必须的物质有维生素C、地塞米松和甘油磷酸钠。 地塞米松是一种糖皮质激素,对成骨诱导分化具有促进作用,但有时也有抑制作用,这与地塞米松的作用浓度、对细胞的作用时间和细胞种类有关;甘油磷酸钠与地塞米松具有协同作用,能够提供磷离子给碱性磷酸酶,将有机磷处理成无机磷离子,加速成骨诱导分化过程中的钙盐沉积并促进新骨形成与细胞钙化,该过程是MSCs 成骨诱导分化的必要条件;维生素C 能够使胶原中的脯氨酸或赖氨酸末端发生羟基化,从而提高碱性磷酸酶活性,加速钙盐沉积;碱性磷酸酶是成骨诱导分化鉴定的标志性酶,碱性磷酸酶染色能够鉴定这种酶的存在;茜素红能够与钙离子发生络合反应生成一种红色物质,可以用于鉴定成骨细胞中的钙离子。 因此,这两种染色方法都可以用于鉴定成骨诱导分化[18]。本研究在LG-DMEM 培养液加入维生素C、地塞米松和β-磷酸甘油对rAMSCs 进行成骨诱导分化,经过28d 的诱导培养以后,细胞形态由长梭形逐渐转变成多角形,部分细胞出现堆积生长,出现细胞团块。 对诱导后细胞进行碱性磷酸酶染色,可见大量成片紫色,染色结果阳性;茜素红染色后可见部分细胞团块处有深红色。染色结果表明诱导后细胞表达成骨细胞的标志性酶且有钙离子的沉积,说明成功将rAMSCs 诱导分化为成骨细胞。
对rMSCs 进行体外分离培养和鉴定是将rMSCs 应用于临床治疗的前提。鉴定rMSCs 主要依赖其形态特征和细胞表型的鉴定,以及经体外诱导能够分化成骨细胞和脂肪细胞等。 目前,rMSCs 的表面标记尚无统一的鉴定标准,普遍认为rMSCs 表达表面标记CD29, CD44, CD73, CD90 和CD105 等,不表达表面标记CD14, CD19,CD34,CD45 和HLA-DR 等[19]。 本研究通过流式细胞术检测rAMSCs 细胞表型,结果表明,P3 代rAMSCs 低表达CD34、CD45 和HLA-DR,高表达CD29、CD49d 和CD73,符合以上鉴定标准。

