光谱法研究阿维菌素与溶菌酶的相互作用
孙丽莉, 张朝, 彭晓萌, 徐冰霞, 陈刚
光谱法研究阿维菌素与溶菌酶的相互作用
孙丽莉, 张朝, 彭晓萌, 徐冰霞, 陈刚
(烟草化学安徽省重点实验室, 安徽 合肥, 230088)
为研究阿维菌素残留被生物体吸收后, 在生物体内的作用机理, 在模拟生理条件下, 应用荧光光谱、圆二色谱和同步荧光研究阿维菌素与溶菌酶相互作用的活性机理。研究表明, 阿维菌素与溶菌酶的作用机理为荧光静态猝灭; 两者通过氢键和范德华力形成1︰1结合, 结合距离为4.55 nm; 298、303和308 K时的结合常数分别为1.10×105、1.08×105和0.38×105L·mol-1, 结合强度紧密; 同步荧光和圆二色谱证实阿维菌素影响溶菌酶的二级结构, 使溶菌酶分子–螺旋结构含量减小。本文为农药残留在生物体内中代谢过程、解毒和指导科学使用农药提供理论依据。
溶菌酶; 阿维菌素; 荧光光谱; 圆二色谱; 同步荧光
农业生产中, 由于安全意识淡薄, 农药时有被过量使用, 导致农药残留风险增加。残留的农药可通过空气和食物链等被生物体吸收, 与生物体中蛋白质反应引起急性中毒, 严重的可导致死亡[1]。目前, 农药残留检测和降解方法研究较多, 对农药在生物体内的转运、代谢和中毒机制研究较少。因此, 研究农药与生物体中蛋白质的相互作用非常重要。
阿维菌素(Avermectin, AVM)是一种广泛用在农业和畜牧业的新型抗生素, 具有结构新颖、残效期长等优点。由于其在动物体内残留的时间较长, 动物组织中残留的阿维菌素会对人体健康造成严重危害。溶菌酶(Lysozyme, lys)是一种广泛分布于生物体内的小分子碱性蛋白, 也是生物体内不可或缺的非特异性体液免疫因子, 能够与很多的外源和内源性物质结合, 常被用作蛋白质模型, 研究蛋白质的空间构象、酶动力学以及分子进化与分子免疫间的关系, 发挥其抗菌、消炎、抗病毒等诸多的生物功能[2–4]。
本文以溶菌酶作为蛋白质模型, 用荧光光谱法研究阿维菌素猝灭溶菌酶内源荧光的机理, 同步荧光和圆二色谱研究阿维菌素对溶菌酶结构的影响, 以期从分子角度分析研判阿维菌素在生物体内的活性机制, 为研制低毒高效农药、解毒方法和安全使用农药提供理论参考。
1 材料与方法
1.1 实验试剂
阿维菌素(纯度98%, 浓度0.1 mmol/L, 阿拉丁); 溶菌酶(纯度99%, 浓度0.01 mmol/L, 上海生物制品有限公司); NaCl(0.1 mol/L); pH=7.4 Na2HPO4-KH2PO4缓冲溶液; 无水乙醇; 水为二次蒸馏水。
1.2 实验仪器
F-4500荧光分光光度计(日立公司); UV-757CRT紫外可见分光光度计(上海精密科学仪器有限公司); Jasco-20c圆二色谱仪(日本岛津公司)。KQ-500DE 超声波发生器(昆山市超声仪器有限公司); AL-204-IC电子天平(感量0.000 1 g, 瑞士Mettler Toledo公司)。
1.3 实验方法
1.3.1 荧光光谱分析
准确移取1 mL溶菌酶溶液(0.01 mmol/L)、1 ml Na2HPO4-KH2PO4缓冲溶液、1 ml NaCl溶液(0.1 mol/L)于10 mL比色管中, 阿维菌素溶液(0.1 mmol/L)依次取0, 0.5, 1.0, 1.5, 2.0、2.5、3.0、3.5和4.0 mL, 用二次蒸馏水定容, 分别在298、303、308 K下水浴反应15 min, 立即进行荧光测定。
荧光光谱: 在280 nm激发波长下, 扫描溶液300–500 nm的荧光发射光谱。调狭缝宽5 nm, 光电管负高压为400 V, 响应速度2.0 s, 扫描速度1 200 nm/min。
1.3.2 同步荧光
固定发射波长与激发波长差Δ分别为60 nm和15 nm, 调节仪器参数:波长范围240~360 nm, 光电管负高压400 V, 狭缝宽度5 nm, 扫描速度1 200 nm/min。
1.3.3 圆二色谱分析
将待测液置于1 mm石英吸收池中, 步幅1 nm, 扫描速度200 nm·min-1, 扫描200~350 nm范围内阿维菌素与溶菌酶作用前后的CD光谱。
2 结果与讨论
2.1 AVM与Lys相互作用的荧光光谱
Lys的内源荧光由色氨酸、酪氨酸和苯丙氨酸三种荧光团组成, 但Lys的荧光强度主要来源于色氨酸残基[5]。AVM与Lys相互作用发生的荧光变化见图1。随着AVM浓度的逐渐增加, Lys的最大荧光强度规律性减小, 且最大发射峰发生明显红移, 表明AVM与Lys发生相互作用, Lys的内源荧光被猝灭。

图1 AVM与Lys相互作用荧光光谱
2.2 AVM对Lys荧光猝灭机理
2.2.1 AVM-Lys的动态猝灭常数(SV)
AVM对Lys的内源荧光猝灭可能是动态猝灭或静态猝灭[6]。为明确AVM对Lys的猝灭类型, 研究298、303和308 K下AVM-Lys反应体系。假设体系是动态猝灭, 遵循Stern-Volmer[7]方程:0/= 1+SV[] = 1+qτ[], 式中0是Lys的荧光强度,为AVM-Lys体系的荧光强度; [Q]是AVM的摩尔浓度;SV是AVM-Lys体系的动态猝灭常数;q为猝灭速率常数;0为Lys的荧光寿命(一般取生物大分子荧光寿命的平均值10-8s[5])。
图2是298、303、308 K下, 由Stern-Volmer方程做出的AVM对Lys的猝灭图, 斜率(SV)和截距(q)见表1。

图2 AVM-Lys的Stern-Volmer图
若AVM-Lys体系为动态猝灭, 则动态猝灭常数随温度的升高而不断增大[8]。但由表1数据可知sv随温度的升高反而降低, 且298、303、308 K时的q均大于猝灭剂对生物大分子最大扩散碰撞猝灭速率常数, 由此判断AVM-Lys体系不属于动态猝灭, 该体系为静态猝灭, 即AVM与Lys作用生成不发荧光的复合物, 导致Lys的荧光猝灭[8]。

表1 不同温度下AVM与Lys的动态猝灭常数
2.2.2 静态结合常数(A)和结合位点数()
AVM与Lys发生静态猝灭作用时可能存在n个相同且独立的结合位点[6], 根据公式[9]: lg(0-)/= lgA+ nlg[], 由lg(0-)/~lg[]作图(图3), 斜率为AVM与Lys的结合位点数(n), 截距为两者的结合常数A[6], 结果见表2。
由表2可知, AVM–Lys的结合常数达到105L·mol-1以上, 说明两者结合较强; 结合位点数近似为1, 说明一个Lys分子有一个AVM结合位点; AVM–Lys的结合常数随温度的升高而减小, 说明该过程是静态猝灭过程, 反应生成的复合物受温度影响较大, 温度升高复合物稳定性降低[6]。

图3 lg(F0-F)/F与lg[Q]的关系

表2 AVM-Lys的静态猝灭常数
2.2.3 热力学参数及作用力类型
AVM与Lys结合的作用力可能有氢键、范德华力、静电引力和疏水力等[5]。根据Van’t-Hoff方程[10]: ln= -Δ/+ Δ/, Δ= Δ-Δ[11]。
以ln对1作图, 由斜率-Δ/和截距Δ/求得Δ和Δ, 得到AVM–Lys结合的热力学参数。根据前人的实验经验总结得出:Δ和Δ均大于0时的作用力为疏水作用, ΔHΔ均小于0时的作用力为氢键和范德华力, 当Δ<0, Δ>0, 作用力为静电引力[12]。298、303和308K下, AVM与Lys体系的热力学参数见表3。

表3 AVM–Lys结合的热力学参数
表3中, ΔG、Δ、Δ均小于0, 表明AVM–Lys体系是一个自发的放热过程, 作用力主要是氢键和范德华力; 温度升高时, AVM–Lys复合物的稳定性减弱, 复合物可能发生分解, 导致AVM–Lys的结合常数减小[6], 更进一步证实AVM–Lys为静态猝灭。
2.2.4 结合距离
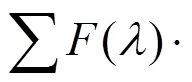
为AVM︰Lys = 1∶1时的复合物荧光强度,是荧光光谱(Lys)与吸收光谱(AVM)的重叠积分,为荧光量子产率(Lys),()为Lys在波数为时的荧光强度,ε()为AVM在波数为时的摩尔吸光系数[6]。对于AVM, 取向因子取给体受体各向随机分布的平均值2= 2/3 , 量子产率= 015, n折射指数取水和有机物平均值= 1.336[6]。
根据公式计算得出AVM与Lys的结合距离()为4.55 nm, 结合距离小于7 nm, 符合Förster非辐射能量转移条件, Lys的能量通过形成复合物转移给AVM, 再一次验证AVM与Lys相互作用为静态猝灭。

图4 AVM吸收光谱(1)与Lys荧光光谱(2)的重叠光谱
2.3 AVM对Lys二级结构的影响
2.3.1 同步荧光
AVM能猝灭Lys的内源荧光, 我们推测Lys的构象可能发生变化。酪氨酸、色氨酸和苯丙氨酸是Lys主要的荧光发色团, 但色氨酸对微环境的变化最敏感[5]。Δ= 15 nm主要提供酪氨酸残基的微环境变化信息, Δ= 60 nm主要提供色氨酸残基的微环境变化信息[14], 见图5。

图5 Δλ = 16 nm (a) 和60 nm (b) 的同步荧光光谱
由图5(a)和(b)可知, AVM对Lys中酪氨酸残基和色氨酸残基均有猝灭作用, 且荧光强度均随AVM浓度的增加而降低, 但色氨酸残基(Δ= 60 nm)最大发射峰明显红移, 酪氨酸残基(Δ= 15 nm)最大荧光峰位移不明显, 说明色氨酸残基微环境发生变化, 色氨酸残基对环境变化更敏感, 由此推断AVM对Lys的荧光猝灭, 主要是Lys分子中色氨酸残基的荧光猝灭, 色氨酸残基所处微环境的疏水性减弱, AVM与Lys可能在疏水空腔外结合。
2.3.2 圆二色谱
AVM对Lys二级结构的影响还可以应用CD法研究。图6是AVM加入前、后的CD谱图。由图6(a)可知, Lys在207 nm和216nm处有负的吸收峰, 加入AVM后(图6(b))Lys两个负峰向低波数移动, 吸收强度也减弱, 说明AVM使Lys的二级结构稳定性减弱。
根据公式:% = [(-[θ]208- 4000)/(33000 - 4000)] × 100%[15]
计算得出Lys的-螺旋结构含量由47.10%降低到33.28%, 表明AVM改变Lys的二级结构, AVM通过氢键和范德华力与Lys分子的肽键形成配位键, 使Lys分子肽链伸展。
3 结论
通过荧光光谱研究得知AVM与Lys的猝灭机理为静态猝灭, 该反应是一个自发过程; AVM主要通过氢键和范德华力与Lys分子形成1︰1的较强结合, 结合常数达到105L·mol-1以上, 结合距离是4.55 nm。同步荧光和CD的研究结果表明AVM使Lys分子中色氨酸残基的疏水性减弱, Lys分子的-螺旋结构含量由47.10%降低到33.28%, 证实AVM影响Lys的构象。

图6 AVM-Lys的圆二色谱
本研究详细阐述了阿维菌素农药残留被生物体吸收后, 与体内蛋白质相互作用的机理, 这对揭示农药残留在生物体内代谢过程、解毒和安全科学使用农药提供理论依据。
[1] 赵雪. 作物农残危害及预防措施[J]. 农业与技术, 2019, 39(12): 16–17.
[2] 林翠花, 肖素荣, 孟庆国. 溶菌酶结构特点及其应用[J]. 潍坊学院学报, 2005, 5(2): 108–110.
[3] 吴晓英, 林影, 陈慧英. 溶菌酶的研究进展[J]. 工业微生物, 2002, 32(4): 55–58.
[4] 李鹤, 马力, 王维香. 溶菌酶的研究现状[J]. 食品研究与开发, 2008, 29(1): 182–185.
[5] 黄朝波, 徐晗, 杨明冠, 等. 光谱法和分子对接研究红斑红曲胺与牛血清白蛋白相互作用[J]. 光谱学与光谱分析, 2019, 39(10): 3 102–3 107.
[6] 孙丽莉, 陈宁生, 夏雪文. 噻嗪酮与牛血清白蛋白相互作用的光谱法研究[J]. 分析科学学报, 2011, 27(2): 222–225.
[7] Luo X, Du C, Wei J R, et al. Study of the interaction between sodium salts of (2e) -3- (4’-halophenyl) prop-2-enoyl sulfachloropyrazine and bovine serum albumin by fluorescence spectroscopy [J]. Luminescence: the journal of biological and chemical luminescence , 2013, 28(11): 202–210.
[8] 陈国珍. 荧光分析法[M]. 北京: 科学出版社, 1990: 201.
[9] Tarlok S. Banipal, Amandeep Kaur, Parampaul K. Banipal.Physicochemical aspects of the energetics of binding of sulphanilic acid with bovine serum albumin [J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2017, 170(5): 214–225.
[10] Chaturvedi S K, Ahmad E, Khan J M, et al. Elucidating the interaction of limonene with bovine serum albumin: a multi-technique approach [J]. Molecular Biosystems, 2015, 11(1): 307–316.
[11] Bhogale A, Patel N, Mariam J, et al. Comprehensive studies on the interaction of copper nanoparticles with bovine serum albumin using various spectroscopies [J]. Colloids Surfaces B Biointerfaces, 2013, 9(21): 276–284.
[12] Ross P D. Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability [J]. Biochemistry, 1981, 20(11): 3 096–3 099.
[13] 杨频, 高飞, 马贵斌. 生物无机化学导论[M]. 西安: 西安交通大学出版社, 1991: 152.
[14] Chengbin Xu, Jiali Gu, Xiping Ma, et al. Investigation on the interaction of pyrene with bovine serum albumin using spectroscopic methods [J]. Spectrochimica Acta Part A Molecular &Biomolecular Spectroscopy, 2014, 1(132): 391–395.
[15] 孙荣梅, 于丽燕, 陈昌云. 曲克芦丁与牛血清白蛋白相互作用的光谱研究[J]. 江苏大学学报(医学版), 2009, 19(5): 387–390.
Spectrctroscopic studies on the interaction betweenavermectin and Lysozyme
Sun Lili, Zhang Zhao, Peng Xiaomeng, Ge Shaolin, Xu Bingxia ,Chen Gang
(Anhui Key Laboratory of Tobacco Chemistry, Hefei 230088, China)
To investigate interactions between avermectin pesticide residues with protein, the interaction between avermectin and Lysozyme is studied in physiological conditions by spectroscopic methods. It is shown that fluorescence quenching mechanism of avermectin with Lysozyme is a static quenching procedure, the interaction are mainly the hydrogen bond and Van der Waals force; The distance between them is 4.55 nm by Förster non-radiative energy transfer theory and the apparent binding constants (A) are 1.10×105(298 K)、1.08×105(303 K) and 0.38×105(308 K) L·mol-1, the binding sites () is 1; The results of CD spectra and the synchronous fluorescence indicated that the secondary structure of Lysozyme is changed when avermectin bound to Lysozyme, the content of-helical structure decreased. This study provides theoretical reference for the transport, metabolism and poisoning mechanism of residual pesticides, and provide guidance for the scientific and effective use of pesticides.
lysozyme; avermectin; fluorescence spectroscopy; CD spectroscopy; synchronous fluorescence
10.3969/j.issn.1672–6146.2021.01.019
0657
A
1672–6146(2021)01–0090–05
陈刚, 358444884@qq.com; 孙丽莉, 18756997517@126.com。
2020–4–20
安徽中烟工业有限责任公司科技项目(2017122)。
(责任编校: 郭冬生)

