宫颈癌发生发展相关的LncRNA筛选及功能研究
董君伟,贾海生
作为全球女性中第三大最常见的癌症和恶性肿瘤相关死亡率的第四大突出原因,宫颈癌在全世界每年发生530 000例病例,近27.5万例死亡,高于其他妇科肿瘤[1]。近年来,由于宫颈细胞学和宫颈活检的进展,已经通过更好的检测方法诊断出早期和局部晚期宫颈癌[2]。宫颈癌的筛查和先进的医疗手段使宫颈癌的发病率降低了40%~50%。在许多发达国家,死亡率降低了60%,预后良好率也有所提高[3]。然而,宫颈癌仍然是主要的公共卫生问题,尤其是在晚期病例中[4]。过去的研究主要集中在识别可预测生物学行为的肿瘤特异性标志物上,主要是由于细胞运动的重要性和宫颈癌进展中的侵袭性[5]。为了进一步研究宫颈癌的治疗,需要开展更多研究以研究宫颈癌的分子机制[6]。非编码RNA(ncRNA)是基因调控的关键因素,影响正常细胞和癌细胞的表型[7]。 这些ncRNA被认为在肿瘤发生的起始中起着重要的调节作用[8]。最近,一类新的转录本,长链非编码RNA(LncRNA),已在真核基因组中广泛转录[9]。LncRNA的长度约为200 nt至100 kb,是功能性非编码RNA分子之一[10]。 据报道,宫颈癌中涉及几种LncRNA[11]。到目前为止,仅对一小部分LncRNA进行了详细表征[12]。一些LncRNA调控重要的癌症过程,包括增殖、凋亡、转移和耐药性[13]。仍需要鉴定更多影响癌症相关基因表达的LncRNA。
1 材料与方法
1.1 细胞及材料试剂
本研究中宫颈癌细胞Hela购于美国ATCC细胞库。胎牛血清FBS、DMEM培养基、胰蛋白酶购自美国Thermo Fisher;Trizol试剂、脂质体2000购自美国Invitrogen;siRNA购自广州市锐博生物科技有限公司;逆转录试剂及荧光定量PCR试剂购自翊圣(上海)有限公司;细胞增殖实验反应MTS购于abcam公司; BCA蛋白浓度检测试剂盒购自上海碧云天;兔抗人MYC多克隆抗体、抗β-Actin抗体及HRP偶联二抗购自英国Abcam。基因序列来源于NCBI数据库,通过Primer 3.0软件设计RT-PCR检测引物,由上海生工生物工程有限公司合成,引物序列见表1。
1.2 研究方法
1.2.1 细胞培养 人宫颈癌细胞Hela细胞购于美国ATCC细胞库,培养在含10%胎牛血清的DMEM培养基中,并加入100 μg/mL链霉素和100 IU/mL青霉素。细胞培养瓶置于含5%的CO2和95%湿度的37°C培养箱中。

表1 RT-PCR引物序列
1.2.2 临床数据筛选 在临床数据库GEPIA( Gene Expression Profiling Interactive Analysis)[14]中,tumor/normal>2找到在宫颈癌中高表达的基因,并通过GEPIA数据库找到与宫颈癌临床预后密切相关的基因,进一步筛选LncRNA作为目的基因进行研究。
1.2.3 实时荧光定量PCR实验(RT-qPCR) 反转录的cDNA用灭菌纯水稀释适当的浓度,一般稀释20倍,按照qPCR mix 5 μL,primer 1 μL, cDNA 4 μL的配方加入到96孔PCR板中;贴膜,以2 500 rpm离心1 min,将样品放入qPCR仪器中进行实验,反应完成后,拷贝数据,进行分析。
1.2.4 转染 以6孔板转染siRNA为例: 将1 μL siRNA与250 μL Opti-MEM混匀,1 μL lipo 2000与250 μL Opti-MEM混匀,室温放置5 min,然后将两部分合并,混匀,静置15 min,之后逐滴、均匀加入6孔板中的1个孔中。
1.2.5 细胞增殖实验 消化长满的10 cm盘细胞,重悬于1 mL新鲜培养基中,用20 μL可铺1个96孔板的密度铺细胞,每个实验组需3个实验副孔,铺好所需的实验孔数。在5%的CO2,37℃条件下孵育。细胞贴壁后即可转染siRNA,48 h后,开始测量吸光度。配制MTS反应液,按照MTS:培养液=1∶20的比例配制反应液。每孔加入100 μL MTS反应溶液,37℃继续培养。每隔半小时检测一次吸光度。将培养皿置摇床上低速振荡10 s以充分溶解结晶物。在490 nm处测量各孔的吸光值。将每天的吸光值转换成代表每日细胞生长的参数,并绘制细胞增殖曲线。
1.2.6 克隆形成实验 以6孔板细胞为例:每孔铺2 000个细胞,细胞贴壁后即可转染siRNA。每个样品做3个生物重复,待6~14 d之后出现肉眼可见的克隆,收集细胞,用常温的PBS洗涤两次,用甲醇、乙酸比为3∶1的固定液进行常温固定5 min,用含0.5%结晶紫的甲醇溶液常温固定15 min,水洗,直至背景紫色洗掉,室温晾干进行扫描。
1.2.7 HallMark信号通路分析 将与CLIC 3共表达的基因在metascape数据库[15]中进行分析,找到其参与的HallMark信号通路,为后续的研究提供理论基础。
1.2.8 蛋白免疫印迹实验 收细胞进行蛋白定量并制样,准备电泳、电转装置,电泳液以及电转液,装样品加入在凝胶中,100 V进行电泳,待蓝色条带跑出即进行电转,100 V电转2 h,将蛋白膜放在牛奶中封闭1 h,4℃孵育一抗过夜,洗膜4次,每次5 min,室温孵育二抗1 h,洗膜4次,每次5 min,暗房显影。
1.3 统计学分析
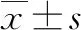
2 结果
2.1 宫颈癌目的LncRNA筛选及确定
通过GEPIA数据库[14],将在宫颈癌中高表达的有1 851个基因,和在宫颈癌中具有明显临床预后相关性的500个基因(P<0.05)进行重合性分析,共找到78个既在宫颈癌中高表达又具有显著临床意义的基因。通过将78个宫颈癌中高表达又具有显著临床意义的基因与人类基因组中14 871个LncRNA进行重合性分析,共找到3个可能在宫颈癌发生发展中具有明显作用的LncRNA:ATP 2A 1-AS1、SOX 21-AS1和DLEU1。研究发现3种LncRNA在宫颈癌组织中相比于宫颈正常组织显著高表达,详见图1.1。其中ATP 2A 1-AS1和SOX 21-AS1在宫颈癌中呈现显著的高表达预后好特征(P=0.0042、P=0.0023),而DLEU1宫颈癌中呈现显著的高表达预后差特征(P=0.0023),详见图1.2(见彩插2),根据致癌因子属性(高表达预后差),因此我们选择DLEU1作为研究目的LncRNA。
2.2 DLEU1在Hela细胞中的敲低效率
RT-qPCR检测转染无义序列、两条siDLEU1后的Hela细胞中DLEU1的表达水平。结果显示:敲低DLEU1组的DLEU1的相对表达量与对照组相比有显著降低(P=0.001、0.001),详见下页图2。该结果同时证明si DLEU1的有效性和脂质体转染系统的可靠性。
2.3 敲低DLEU1对Hela细胞的生长速率影响
在转染无义序列和siDLEU1后的Hela细胞中通过细胞增殖实验和克隆形成实验进一步评估DLEU1对Hela细胞生长速率的影响。细胞增殖实验结果显示:与对照组相比,敲低DLEU1表达的细胞增殖速率显著减慢,提示DLEU1促进宫颈癌细胞生长的作用(P<0.05,P<0.01)详见下页图3.1。克隆形成实验结果显示:与对照组相比,敲低DLEU1表达的细胞克隆形成速率显著减慢,进一步验证了DLEU1促进宫颈癌细胞生长的作用,详见下页图3.2。
2.4 DLEU1主要定位于细胞核中发生作用
通过核质分离实验,用经典位于细胞核中的标志LncRNA NEAT1和经典位于细胞质中的标志LncRNA DANCR作为对照,RT-qPCR实验结果显示DLEU1主要定位于细胞核中,详见下页图4,为后续进一步探讨DLEU1在宫颈癌中发挥作用的方式提供参考。
2.5 DLEU1可能参与调控MYC从而促进宫颈癌细胞的生长
通过将与DLEU1共表达基因在metascape数据库[15]中参与的信号通路进行分析,探索DLEU1促进宫颈癌细胞生长的潜在分子机制。发现DLEU1显著参与经典致癌基因MYC的调控,详见下页图5。

图1.1 GEPIA数据库显示3个LncRNA在宫颈癌中的表达情况
2.6 DLEU1正调控MYC的表达
转染无义序列和siDLEU1后的Hela细胞中通过RT-qPCR实验和蛋白免疫印迹实验进一步评估DLEU1对MYC基因的表达调控。RT-qPCR结果显示:与对照组相比,敲低DLEU1表达的Hela细胞中MYC基因的RNA水平表达显著降低(P=0.001、0.002),详见图6.1。蛋白免疫印迹结果显示:与对照组相比,敲低DLEU1表达的Hela细胞中MYC基因的蛋白水平表达显著降低,详见图6.2。由此提示了在宫颈癌细胞中DLEU1正调控经典致癌基因MYC的表达。

图2 DLEU1在Hela细胞中的敲低效率

图3.1 敲低DLEU1对Hela细胞增殖速率影响

图3.2 敲低DLEU1对Hela细胞克隆形成速率影响

图4 DLEU1主要定位于细胞核中

图5 DLEU1可能参与调控MYC信号通路

图6.1 RT-qPCR实验验证DLEU1正调控MYC的表达

图6.2 蛋白免疫印迹实验验证DLEU1正调控MYC的表达
3 讨论
宫颈癌是全球女性因妇科恶性肿瘤死亡的第四大死因,它需要新的潜在生物标记物进行诊断、治疗和预后,以改善治疗癌症的临床策略。近年来,LncRNA受到越来越多的关注。许多报告指出,LncRNA在生物学上对癌症的发病机制很重要。有证据表明,LncRNA紊乱会导致一系列生物学功能,从而导致进行性肿瘤和不受限制的肿瘤生长。LncRNA已被用作生物标志物和预后指标[16]。人类基因组和转录组测序的进步表明,大多数人类基因组都可以转录,但是只有一小部分的转录本可以编码蛋白质[17]。LncRNA通常调控不佳,现在已知在基因表达和各种生物学过程中起着越来越重要的作用,并且可以为宫颈癌提供一种新颖的治疗方法[18]。研究表明,LncRNA已在包括宫颈癌在内的多种肿瘤中异常表达[19],例如LncRNA NORAD[20],TPT1-AS1[21]和NEAT 1[22]可以促进宫颈癌细胞的生长和转移。HOXD-AS1激发宫颈癌中的阿霉素抗性[23]。HOTAIR和CCHE 1在宫颈癌组织中过表达,HOTAIR和CCHE 1的高表达是宫颈癌的阴性预后因素[24]。在本文中,我们通过GEPIA数据库将宫颈癌中高表达的基因和具有显著临床预后相关性的基因进行重合性分析,共筛选到78个在宫颈癌中既高表达又具有显著宫颈癌临床预后相关性的基因,进一步将这78个基因进行分类,筛选到3个LncRNA:ATP 2A 1-AS1、SOX 21-AS1和DLEU1,最后根据高表达预后差原则确定DLEU1作为研究目的LncRNA。
据报道,位于13q14.3染色体上的LncRNA DLEU1在慢性淋巴细胞性白血病,多发性骨髓瘤,乳腺癌,胃癌和卵巢癌中失调[25]。DLEU1的高表达与胃癌的预后不良有关,并有助于细胞增殖。 显示DLEU1通过与miR-490-3p相互作用来促进卵巢癌细胞增殖和侵袭[26]。迄今为止,研究表明DLEU1在几种肿瘤中起着致癌LncRNA的作用[27]。但是,关于DLEU1在宫颈癌中的作用和上游调节机制知之甚少。在本文中,利用细胞增殖实验及克隆形成实验,我们同样发现在宫颈癌细胞中敲低DLEU1的表达,会显著减慢宫颈癌细胞增殖和克隆形成速率,说明DLEU1在宫颈癌发生发展中的致癌因子属性。为了进一步探讨DLEU1在宫颈癌发生发展中发挥功能的潜在分子机制,作为LncRNA,我们首先研究了DLEU1的核质定位,发现DLEU1主要分布在细胞核中,而在细胞核中,一般都是通过调控发挥功能,因此我们便将与DLEU1共表达的基因在metascape中进行分析,发现DLEU1可能参与调控经典的致癌因子MYC。MYC是一种多功能转录因子,可调节包括发育和分化在内的各种过程。它的调控功能之一涉及基因转录,在该基因转录中,它与位于基因启动子区域的E-box序列(CANNTG)结合。据估计,MYC靶基因网络构成了从苍蝇到人类的所有基因的约15%。MYC基因敲除对小鼠具有致死性,可导致较小的胚胎和发育迟缓[28]。MYC还是细胞周期的重要调节剂,其敲除或敲低会严重影响细胞增殖[29]。 它还在细胞分化中起作用。MYC是由长期造血干细胞分化诱导的,并平衡干细胞的自我更新和分化。在小鼠胚胎干细胞中,MYC通过诱导miRNA表达来抑制分化标记基因的表达并影响干细胞的分化[30]。由此可见MYC在细胞进程中的重要性,为了证明DLEU1对MYC的调控作用,我们在敲低DLEU1表达的宫颈癌细胞中进行验证,发现敲低DLEU1的表达,不管是从RNA水平还是蛋白水平,MYC的表达都被降低,说明在宫颈癌细胞中DLEU1确实正调控经典致癌因子MYC的表达。
综上所述,宫颈癌中DLEU1可能通过高表达导致经典致癌因子MYC的高表达,因此促进宫颈癌细胞的增殖。

