超声-微波协同提取柚子皮多糖工艺优化及单糖组成、结构和抗氧化活性分析
江飞凤,谭晓辉,胡鹏刚*,潘雪梅,闫锦
1(贵州大学 酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳, 550025)2(荔波昌辉食业有限公司,贵州 荔波, 558400)
柚子是芸香科植物柚的成熟果实,产于广东、福建、贵州等地区。柚子皮是柚子经人们食用或加工后剩下的表皮,约占整个柚子质量的30%以上。据研究报道柚子皮中含有多种生理活性成分[1],如黄酮、多糖、香精油、类柠檬苦素、膳食纤维等[2],提取的活性成分可用于制药品及保健食品的开发[3-4]。据文献报道,柚子皮中多糖含量较高[5],许其亮[6]利用水提法提取柚子皮多糖,多糖得率为8.30%。然而,目前对柚子皮多糖的研究报道比较少,缺少对柚子皮多糖单糖组成、形态结构和抗氧化活性等方面研究分析。
多糖是指10个或10个以上单糖通过糖苷键缩聚而成的聚合物[7],主要存在于动植物的体内和微生物的细胞壁中,分为植物多糖、动物多糖和微生物多糖[8]。随着工业的发展,多糖被广泛应用于食品[9]、医药[10]、材料领域[11]。近年来,多糖成了新的研究热点,主要集中在多糖提取[12]、分离纯化[13]、结构分析[14]、抗氧化[15]、免疫活性[16]等方面研究。多糖提取是基于相似相溶原理将多糖从生物体里分离出来的过程。多糖提取方法主要有溶剂提取[17]、超声波辅助提取[18]、酶解、酸碱提取等方法,但这些提取方法较单一,存在提取率低、耗时长等缺点。超声-微波协同提取技术是利用微波的电磁能结合超声波的机械振荡效果,可大幅度缩短提取时间,节约能源并提高得率,目前已经得到广泛的应用。如梁茜茜[19]采用超声微波协同提取燕麦麸皮多糖,与传统水提法相比,燕麦麸多糖得率从4.3%提高到8.45%;王胜男等[20]采用超声-微波协同提取大豆种皮多糖性质及微观结构;蒋新龙等[21]采用超声波-微波协同提取棠梨籽油。
本试验采用超声-微波协同提取柚子皮多糖,通过响应面优化最佳提取工艺条件,并对其单糖组成、结构和抗氧化活性进行研究分析,为柚子皮多糖进一步纯化、结构鉴定、活性研究及综合开发利用提供理论参考。
1 材料与方法
1.1 材料与试剂
柚子:2019年11月15日采购于贵州省荔波县。
无水乙醇,西陇科学股份公司;NaOH、H2O2,正丁醇,西陇科学股份公司;氯仿,广州化学试剂厂;以上试剂均为分析纯。
1.2 仪器设备
Waters e2695高效液相色谱仪,美国沃特世公司;TENSOR27傅里叶变换红外光谱仪、CW-2000型超声-微波协同萃取仪,上海新拓微波溶样测试技术有限公司;FDU-2100型冷冻干燥机,埃朗科技国际贸易(上海)有限公司;UV-5500PC紫外可见分光光度计,上海元析仪器有限公司。
1.3 试验方法
1.3.1 超声-微波协同提取柚子皮多糖单因素及响应面实验设计
1.3.1.1 多糖提取试验步骤
多糖提取步骤如下:
柚子皮→烘干→粉碎→过40目筛→称取10 g柚子皮→超声微波协同提取→离心(6 000 r/min、10 min)→浓缩(20 mL左右)→醇沉(4倍体积无水乙醇)→静置(4 ℃下静置12 h)→离心(6 000 r/min、5 min)→沉淀冷冻干燥→柚子皮多糖
1.3.1.2 多糖得率的计算
多糖得率计算如公式(1)所示:
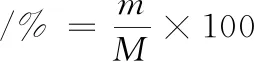
(1)
式中:m为冻干柚子皮多糖质量,g;M为柚子皮质量,g。
1.3.1.3 多糖提取单因素试验
试验探究微波功率(100、200、300、400、500、600 W)、提取液pH(7.5、8.0、8.5、9.0、9.5、10.0)、提取时间(5、10、20、30、40、50 min)、液料比(10∶1、20∶1、30∶1、40∶1、50∶1、60∶1,mL∶g)对柚子皮多糖得率的影响。重复3次平行试验,取其平均值。固定单因素条件为微波功率300 W、提取时间30 min、提取液pH 9.0、液料比40∶1(mL∶g)。
1.3.1.4 响应面试验设计
在单因素试验基础上,选择影响较显著的3个单因素:微波功率、提取时间、液料比为响应因子,多糖得率为响应值,采用Design-Expert 8.0.6软件,通过Box-Behnken实验设计,进行3因素3水平试验分析。试验因素及水平见表1。
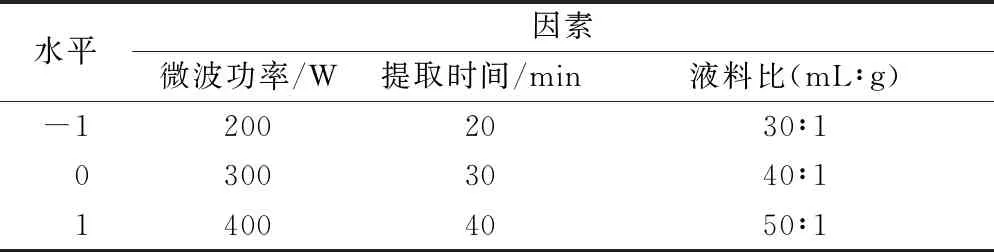
表1 实验自变量因素与水平
1.3.2 柚子皮多糖的脱色、脱蛋白
称取0.5 g的柚子皮多糖,蒸馏水溶解并定容至200 mL,加入30% H2O210 mL,0.1 mol/L NaOH溶液调节pH至9,在40 ℃下加热搅拌1 h,6 000 r/min离心5 min[22]。上清液中加入100 mL Sevage试剂[V(氯仿)∶V(正丁醇)=4∶1],剧烈振荡20 min,移入分液漏斗中静置20 min,弃去中间与下层物质,重复上述操作4次[23]。脱色脱蛋白后的溶液浓缩,透析48 h除盐及小分子杂质,每12 h更换一次蒸馏水,冻干即可获得柚子皮多糖。
1.3.3 紫外光谱分析
取2 mL脱色脱蛋白后的多糖浓缩液,稀释6倍,0.22 μm微滤膜过滤处理,以水为空白对照,在200~400 nm范围内紫外光谱扫描,确定多糖样品特征吸收峰,同时检测多糖样品是否存在蛋白质及核酸残留。
1.3.4 分子质量测定
将柚子皮多糖配制成质量浓度为1 mg/mL的溶液,0.22 μm微滤膜过滤处理。采用凝胶渗透色谱法测定柚子皮多糖分子质量[24]。
1.3.5 单糖组成测定
单糖组成采用1-苯-3-甲-5-吡唑咔柱前衍生化和液相色谱-质谱联用仪检测,通过与标准单糖保留时间的比较,确定单糖组成。
(1)多糖水解(多糖中单糖成分):称取10 mg多糖样品于20 mL的钳口瓶中中,加入5 mL的2 mol/L三氟乙酸,充N2封管(10 L/min,1 min),100 ℃烘箱中水解2 h;冷却后打开盖,取1 mL出来加入1 mL甲醇后,70 ℃水浴下用N2吹干,如此重复加甲醇并用N2吹干2次,以去除三氟乙酸;加入1 mL 0.3 mol/L NaOH溶液充分溶解残渣,为多糖水解液,一定稀释后衍生测定。(2)游离单糖的提取:称取干样约0.4 g、湿样1.5 g于具塞刻度管中,加入10 mL乙醇(80%),在70 ℃水浴超声提取30 min;10 000 r/min离心,取滤液用80%乙醇定容至10 mL,然后取2 mL加入试管用氮气吹干,之后加入1 mL NaOH(0.3 mol/L)溶液充分溶解残渣,分别取400 μL的混合单糖标准液或多糖水解液于5 mL的具塞试管中,加400 μL 1-苯-3-甲-5-吡唑咔甲醇溶液,漩涡混匀;于70 ℃水浴中反应2 h;取出放置冷却至室温;加400 μL HCl(0.3 mol/L)中和至pH 6~7;加水1 200 μL,加入等体积的氯仿,涡旋混匀振摇,静置,弃去氯仿相,如此萃取2次。将水相用0.45 μm微孔膜(水系)过滤后供HPLC进样分析。
色谱条件:色谱柱AGILENT EC-C18(2.7 μm, 2.1 mm×50 mm);流动相A:20 mmol/L 乙酸铵缓冲液(pH=7.0);流动相B:乙腈;流速0.4 mL/min;
质谱扫描条件:特征离子扫描模式;ESI+喷雾电压2.0 kV;锥孔电压30 V;离子源温度150 ℃;脱溶剂温度500 ℃;脱溶剂气(N2)1 000 L/h;SIR模式检测离子:481.09,495.1,510.1,511.08,525.06。
1.3.6 扫描电镜分析
称取1 mg柚子皮多糖,粘在粘有导电胶布的载物台上,用吹尘球吹掉多余样品,喷金,观察多糖样品形态结构。
1.3.7 红外光谱分析
采用傅里叶变换红外光谱仪测定多糖的有机官能团。称取1 mg柚子皮多糖,采用KBr压片法进行红外光谱扫描分析[25]。样品测试前进行背景扫描去除干扰,500~4 000 cm-1范围内进行空白扫描。
1.3.8 抗氧化活性分析
将柚子皮多糖配制成0、0.2、0.4、0.6、0.8、1 mg/mL的多糖溶液,参考ZENG等[26]的方法,测定柚子皮多糖对DPPH自由基的清除率;参考王新等[27]的方法,测定柚子皮多糖对羟自由基的清除率;参考GOPALAKRISHNAN等[28]的方法,测定柚子皮多糖对2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]自由基的清除率;以上实验均以VC为阳性对照。
2 结果与讨论
2.1 柚子皮多糖提取单因素实验结果
由图1-A可知,微波功率为100~300 W时,柚子皮多糖得率随着微波功率的增大而增大,当微波功率为300 W时,多糖得率达到最大。随着功率的进一步增大,多糖得率呈现下降趋势,原因可能是超声波本身具有一定的空化作用,空化作用会产生高温高压,这时微波功率过高会引起压力过大,破坏多糖结构,同时微波功率过高会使溶剂温度迅速上升,溶剂发生挥发,导致多糖不能充分的溶于溶剂中,出现得率降低[29-30]。试验微波功率选择为300 W。

A-微波功率;B-提取液pH;C-提取时间;D-液料比
由图1-B可知,提取液pH在7.5~9.0时,多糖得率随着pH的增大而增大,在pH 9.0时,多糖得率达到最大,随后呈现平缓状态。试验提取液pH选择为9.0。
由图1-C可知,提取时间在10~30 min时,多糖得率随着时间的延长而增大;时间在30~50 min时,多糖得率出现轻微增大,随后呈下降趋势,原因可能是长时间在高温高压状态下,少部分多糖出现降解。其次随着时间延长提取液黏度增大,导致多糖溶出受黏度影响溶出速度减慢[31]。试验提取时间选择30 min。
由图1-D可知,液料比在10∶1~40∶1 (mL∶g)时,多糖得率随着液料比增大而增大,在液料比为40∶1时,多糖得率达到最大。随着液料比的进一步增大,多糖得率出现轻微下降。原因可能是溶剂的增加导致溶液离心次数增加,增加了多糖的挂壁几率,出现损耗增加,从而影响多糖得率。试验液料比选择为40∶1 (mL∶g)。
2.2 响应面优化试验结果
2.2.1 回归模型的建立和方差分析
在柚子皮多糖提取单因素实验基础上,选择影响较显著的单因素:微波功率、提取时间、液料比为响应因子,多糖得率为响应值,采用Design-Expert 8.0.6软件对表2、表3中的试验结果进行响应曲面分析,得到回归方程:
Y=10.29+0.10A+0.26B-0.28C+0.21AB+0.087AC-0.070BC-0.078A2-0.56B2-0.97C2

表2 超声-微波协同提取柚子皮多糖工艺优化响应面试验结果与分析
根据实验结果进行方差分析,由表3可知,该模型中F值为97.52,P<0.000 1,达到极显著水平。失拟项的P>0.05,失拟项差异不显著,表明该回归方程对试验拟合程度较好。对回归方程的显著性进行检验分析表明,超声-微波协同提取柚子皮多糖工艺条件中微波功率A、提取时间B、液料比C及二次项B2、C2分别对柚子皮多糖得率影响显著;交互项AB对柚子皮多糖得率影响较显著(P<0.01)。结果表明,模型回归系数R2=0.992 1,校正决定系数R2=0.981 9。因此该模型对超声-微波协同提取柚子皮多糖得率的分析和预测是可靠的。

表3 回归方程方差分析及结果
2.2.2 响应面分析及优化
响应面图是运用图形技术将函数关系显示出来,便于直接观察各个变量试验值与响应值之间的关系以及两两变量间的交互作用。由图2可以看出,各因素交互作用对柚子皮多糖得率的影响。响应面值Y随着各因素的增加先达到最高点再逐渐减小,若曲线越陡峭,表明响应值对于操作条件的改变越敏感,此因素的交互作用对柚子皮多糖得率的影响越大;反之曲面坡度越平缓,操作条件的改变对响应值的影响就越小。由图2可知提取时间和液料比对柚子皮多糖得率的影响最大,表3回归分析结果也与此相吻合,提取时间和液料比的P<0.000 1,均达到极显著水平。由回归方程中得到超声-微波协同提取柚子皮多糖的最佳工艺条件为:微波功率400 W、提取时间34.32 min、液料比38.82∶1 (mL∶g),在此条件下理论最大得率为10.43%。
2.2.3 验证试验
根据操作可行性调整为:微波功率400 W,提取时间34 min,液料比39∶1 (mL∶g)。进行3次重复试验,测得实际得率为10.41%。实际值与理论值较为接近。表明该回归模型能够很好地反映微波功率、提取时间、液料比对柚子皮多糖得率的影响,证明了该方法研究超声-微波协同提取柚子皮多糖的可行性。此试验结果比许其亮[6]柚子皮多糖提取得率较高,其多糖得率提高了2.11%,比较明显的优点是本试验很大程度地缩短了提取时间、增加了多糖得率。

A-提取时间与微波功率交互作用;B-液料比与微波功率交互作用;C-液料比与提取时间交互作用
2.3 柚子皮多糖的脱色、脱蛋白
柚子皮多糖经30%H2O2脱色,Sevage法脱蛋白,得到澄清透明多糖溶液,浓缩、透析、冻干得柚子皮多糖。
2.4 紫外光谱分析
由图3可知,柚子皮多糖在200 nm附近有显著的紫外吸收,表明柚子皮多糖在200 nm附近件有吸收峰,而在260 nm、280 nm处无明显吸收峰,表明不存在蛋白质及核酸残留,是一种较纯的多糖[32]。

图3 柚子皮多糖紫外吸收光谱图
2.5 柚子皮多糖的分子质量测定
分子质量是多糖的重要结构指标,影响多糖的理化和生物学性质。采用凝胶渗透色谱法对柚子皮多糖分子质量进行检测,测试数据表明,柚子皮多糖平均分子质量为2.4×104Da。
2.6 单糖组成分析
采用液相色谱-质谱联用方法,通过与标准单糖保留时间的比较分析确定单糖组成。柚子皮多糖单糖组成结果如表4、图4所示。由图4、表4可知,柚子皮多糖是一种酸性杂多糖,由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖组成,摩尔比为0.502∶0.960∶0.295∶6.331∶40.673∶10.732∶7.923,其中葡萄糖含量最高。

表4 柚子皮多糖的单糖组成

A-混合标准品;B-柚子皮多糖
2.7 扫描电镜分析
柚子皮多糖的微观结构见图5。由图5可见,柚子皮多糖主要为不规则碎片结构,伴有小的不规则颗粒,碎片表面粗糙,呈片状,结构紧密,相互紧靠。所得多糖呈不规则形状,表明柚子皮多糖具有非晶态结构。扫描电镜图表明,在超声-微波协同提取情况下,柚子皮多糖结构保持完整。
2.8 红外光谱分析
红外光谱图在多糖结构分析方面主要用于官能团的确定、吡喃糖和呋喃糖的区别,以及主要取代基的鉴定等。根据红外光谱图的特征峰的出峰位置和形状可以推测多糖结构的一些特征[16]。由图6可知,柚子皮多糖在4 000~500 cm-1区有多糖类物质的一般特征吸收。在3 422 cm-1处出现的宽而强的吸收峰是—OH的O—H伸缩振动吸收峰[33];在2 926 cm-1左右的吸收峰是由于CH3或CH2的弱C—H键的伸缩振动所致[34];在1 619 cm-1处的弱吸收峰为结合水的多糖水合振动吸收峰;1 419 cm-1处的弱吸收峰为烷基的C—H变角度振动吸收峰;1 074 cm-1处的弱吸收峰为吡喃糖苷环骨架的C—O可变角度振动吸收峰,说明分子中存在C—O—H和C—O—C结构[35];在772 cm-1处出现的微弱吸收峰推测其含有吡喃糖环结构[36]。

图6 柚子皮多糖的红外吸收光谱图
2.9 抗氧化活性分析
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基是为数不多的稳定的有机氮自由基之一,它可以接受电子或氢自由基成为稳定的分子[37]。清除稳定DPPH自由基的模型被广泛用于评估天然化合物的自由基清除能力[38]。由图7可知,柚子皮多糖对DPPH自由基、羟自由基、ABTS自由基的清除能力具有剂量依赖关系,随着柚子皮多糖质量浓度的增大而逐渐增大。其中,柚子皮多糖对DPPH自由基、羟自由基、ABTS自由基半抑制浓度IC50分别为0.34、1.57、1.86 mg/mL;VC对DPPH自由基、羟自由基、ABTS自由基的半抑制浓度IC50分别为0.11、0.12、0.10 mg/mL。图7-A中,DPPH自由基清除率在柚子皮多糖质量浓度为0.0~0.4 mg/mL时明显上升,当多糖质量浓度为1.0 mg/mL时,清除率达到最大值55.58%,而标准品VC对DPPH自由基的清除率高达92.60%。
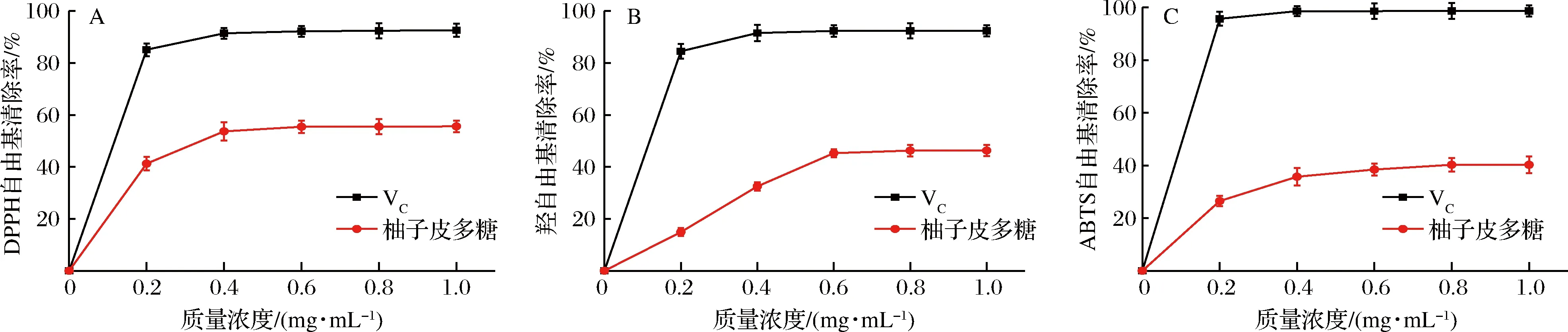
A-DPPH自由基;B-羟自由基;C-ABTS自由基
羟自由基是一种反应性极强的化学分子,在各种自由基物种中具有最强的损伤作用,能很容易地穿过细胞膜,与多种生物分子发生反应,导致组织损伤或细胞死亡,是造成氧化伤害的主要原因。一般来说,在这3种活性氧分子中,DPPH自由基和ABTS自由基是室温下稳定的自由基,而羟自由基被认为是最具活性的自由基。羟自由基也被认为是最有害的自由基,因此,清除羟自由基对保护生命系统非常重要[39]。如图7-B所示,在质量浓度达到0.6 mg/mL后,增长趋势较为平缓,在1 mg/mL时标准品VC对羟自由基的清除率高达92.35%,柚子皮多糖对羟自由基清除率达到最大值46.32%。在植物多糖清除羟自由基实验中,浓度为21.1 mg/mL的槐根多糖清除羟自由基的活性为74.02%[39],2.5 mg/mL铁皮石斛多糖清除羟自由基的活性为75.34%[14],0.3 mg/mL苦瓜多糖清除羟自由基的活性为63.92%[40],均表明植物多糖具有开发作为天然抗氧化剂的前景。
ABTS自由基测定法也是一种快速评估多糖抗氧化能力的方法,多糖可向不稳定的ABTS阳离子自由基提供一个电子和氢原子以形成稳定的ABTS自由基,且在734 nm处可检测到蓝绿色ABTS自由基溶液的颜色还原[41]。如图7-C所示,在质量浓度0.8 mg/mL的柚子皮多糖中,清除ABTS自由基的活性最大值为40.25%。标准品VC对羟自由基的清除率达98.70%。可见,柚子皮多糖对DPPH自由基的清除能力均强于对羟自由基和ABTS自由基的清除能力。其清除自由基能力的差异可能是由于其特殊的结构,其抗氧化机理与多糖结构的关系尚需进一步研究。
3 结论
超声-微波协同提取柚子皮多糖,在单因素试验基础上,利用响应面优化最佳工艺为:微波功率400 W,提取时间34 min,液料比39∶1(mL∶g),提取液pH 9.0,多糖得率为10.41%。柚子皮多糖平均分子质量为2.4×104Da,由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖组成的酸性杂多糖,摩尔比为0.502∶0.960∶0.295∶6.331∶40.673∶10.732∶7.923,主要为不规则碎片结构,伴有小的不规则颗粒,碎片表面粗糙,所得多糖呈不规则形状,表明柚子皮多糖具有非晶态结构,为吡喃型糖苷环骨架,具有较好的自由基清除能力,对DPPH自由基、羟自由基和ABTS自由基的半抑制浓度IC50分别为0.34、1.57、1.86 mg/mL。

