典型化学加工条件对不溶性蚕蛹蛋白凝胶特性影响
黎重阳,谢盛莉,马良,,侯勇,付余,张宇昊,*
1(西南大学 食品科学学院,重庆, 400715)2(西南大学 前沿交叉学科研究院,生物学研究中心,重庆, 400715)
蚕蛹(silkworm pupa,SP)是蚕蛾科家蚕蛾的蛹,属于蚕茧抽丝后的副产物,其于1998年被卫生部批准为“可作为普通食品管理的新资源食品”,是第一个被认定的昆虫类食品。我国作为养蚕大国,近年来全国年产蚕蛹量在30万t以上,约占全世界总产量的80%[1]。蚕蛹蛋白在蚕蛹中占比极高,几乎是蚕蛹干基中的主要营养物质,因此大多研究以蚕蛹蛋白为主体研究对象。吕汶骏等[2]研究发现蚕蛹蛋白中8种必需氨基酸含量占比为49.09%,必需氨基酸与非必需氨基酸之比为96.43%,高于WHO/FAO提出的参考蛋白模式(8种必需氨基酸含量占比为40%,必需氨基酸与非必需氨基酸之比为60%);由此可见,蚕蛹蛋白是一种高营养价值的蛋白资源,但由于其含有潜在过敏原,如30K家族蛋白、几丁质酶、卵黄原蛋白、丙糖磷酸异构酶等[3],部分人食用蚕蛹相关产品后会出现头晕、恶心、呕吐等过敏反应,从而限制了蚕蛹在实际生产过程中的应用。因此,在食品安全的前提下充分开发利用蚕蛹资源,必须解决蚕蛹蛋白过敏问题。谢盛莉等[4]按照溶解性对蚕蛹蛋白进行分级提取,包括水溶性、醇溶性、盐溶性、碱溶性蛋白和不溶性蛋白,并检测其中存在的潜在过敏原,结果发现蚕蛹蛋白中不溶性蛋白含量高达53%,在不同种类蚕蛹蛋白中所占比例最高,且过敏原分布显示,其中仅检测出3种过敏原,仅占不溶性蛋白9.87%,含量较低,且经过多次碱洗处理后理论上可以降低其致敏性,使不溶性蚕蛹蛋白有直接开发为蛋白产品或者作为改善食品功能性质的添加物的可能。
蛋白质的功能特性在食品原料的加工利用或储存过程中起着极其重要的作用,穆利霞等[5]研究表明缫丝后蚕蛹蛋白的乳化活性(25.52 m2/g)和溶解性(氮溶解指数60.17%)最好;练钊等[6]使用Osborn法分级提取缫丝后的蚕蛹水溶性、盐溶性、醇溶性以及碱溶性蛋白,并对其功能特性进行测定,结果表明水溶性蛋白的溶解性和保水性最强,盐溶性蛋白具有良好的持油性,醇溶性蛋白具有良好的乳化活性。由此可见,蚕蛹蛋白具备一定功能特性,且按照溶解性对其进行分级提取后可根据不同功能特性而应用于更加广泛的食品加工领域。
一般动物性不溶性蛋白研究较多集中在凝胶特性方面,在食品加工过程中常见的条件如pH、离子强度、添加谷氨酰胺转氨酶(transglutaminase,TG酶)等会对蛋白质的功能特性产生一定影响,但目前关于蚕蛹中不溶性蛋白的研究报道较少,且其凝胶特性尚无报道。因此,为明确典型食品加工条件对蚕蛹蛋白凝胶特性的影响规律,实验以鲜蚕蛹为原料提取不溶性蛋白,对其氨基酸组成进行测定,采用不同的pH、离子强度处理蛋白,并添加TG酶,进行流变学以及拉曼光谱学的分析,以期为进一步的蚕蛹蛋白产品开发提供理论参考。
1 材料与方法
1.1 材料与仪器
鲜蚕蛹(家蚕实验品种“夏芳”,25 ℃,桑叶饲养,化蛹后第3天放置于-20 ℃冻存备用)、无水乙醇(99.9%)、HCl、NaCl、十二烷基硫酸钠、二甲基硅油。所有试剂均为分析纯,所有水均为二次蒸馏水。
JA3003B电子天平,上海精天电子仪器有限公司;DW-3型数显电动搅拌器,昆山市超声仪器有限公司;HH-4数显恒温搅拌水浴锅,上海新诺仪器设备有限公司;Multifuge X3R高速冷冻离心机,赛默飞世尔科技有限公司;L8900全自动氨基酸分析仪,日本日立公司;DHR-1流变仪,美国TA公司;DXR2拉曼光谱仪,赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 蚕蛹不溶性蛋白提取
蚕蛹预处理:蚕蛹解冻,沸水漂洗5 min,料理机粉碎。70%(体积分数)乙醇脱脂,除醇溶蛋白(2 h,2次),10 g/L NaOH除去碱溶性蛋白(2 h,3次),200目滤布过滤除蛹壳,滤液离心(10 000 r/min,10 min),用纯水多次洗涤蛋白至离心液中性,得到不溶性蛋白。
1.2.2 氨基酸分析
参照国标GB 5009.124—2016测定氨基酸。
1.2.3 不同条件处理对蚕蛹不溶性蛋白流变性能以及结构的影响
1.2.3.1 流变性能测定
不同的前处理方式:(1)不同pH处理对蚕蛹不溶性蛋白流变性能的影响(频率及温度扫描):取10 g不溶性蛋白分别置于pH 5.0~8.0的溶液中,4 ℃过夜,离心,室温平衡30 min后进行流变测试。(2)不同盐浓度对蚕蛹不溶性蛋白流变性能影响(频率及温度扫描):取10 g不溶性蛋白分别加入NaCl,使得盐质量浓度分别为0、10、20、25、35 g/L,搅拌均匀,4 ℃过夜,室温平衡30 min后进行流变测试。(3)TG酶添加对蚕蛹不溶性蛋白流变性能的影响(频率及温度扫描):取10 g不溶性蛋白,加入5% TG酶40 ℃反应2 h,4 ℃过夜,次日取出室温平衡30 min后进行流变测试。
参照文献[7]方法测定蛋白流变性能,并略做修改。测定指标为储能模量(G′)、损失模量(G″)和tanδ值。频率扫描参数:温度25 ℃,应变为1%,频率范围为0.01~10 Hz。温度扫描参数:将样品从25 ℃开始以2 ℃/min的升温速率升温至80 ℃,5 ℃/min的降温速率降温至25 ℃。频率为0.1 Hz,应变1%。
1.2.3.2 拉曼光谱分析
不同前处理方式:(1)不同pH前处理:取10 g不溶性蛋白分别置于pH 5.0~8.0的溶液中,4 ℃过夜,离心,室温平衡30 min后进行拉曼光谱测试。(2)不同盐浓度前处理:取10 g不溶性蛋白分别加入NaCl,使得盐质量浓度分别为0、10、20、25、35 g/L,搅拌均匀,4 ℃过夜,室温平衡30 min后进行拉曼光谱测试。使用拉曼光谱仪记录凝胶样品400~3 050 cm-1的拉曼光谱。测量参数:激发波长785 nm;物镜20×焦距;光阑50 μm狭缝;曝光时间10 s;样品曝光15次。
1.3 数据处理
用SPSS 19.0进行显著性分析,使用单因素方差分析(ANOVA)方法分析数据,当P<0.05时判定组间存在显著差异,并使用Origin 9.0软件作图。拉曼图谱处理:拉曼图谱基线校正、归属采用OMINIC软件,归一化处理以苯丙氨酸作为内标,谱图的拟合采用Peakfit软件。
2 结果与分析
2.1 氨基酸分析
由表1可以得出,不溶性蛋白质氨基酸种类齐全,必需氨基酸/总氨基酸(essential amino acids/total amino acids,E/T)达到40.27%,符合FAO/WHO推荐模式40%,也符合高质量的蛋白质E/T比值36%;谷物[8]中的限制性氨基酸赖氨酸含量约为2.5~3.7 g/100g,大豆等[9]油料作物蛋白的限制性氨基酸蛋氨酸含量约为5.5 g/100g。因此,不溶性蚕蛹蛋白是一种营养价值较高的蛋白资源,可作为一种重要的营养强化剂,添加到谷物制品、大豆蛋白制品中,弥补其限制性氨基酸造成的营养缺陷。
蛋白凝胶作用与本身的氨基酸分布有关,蛋白凝胶的形成与疏水性氨基酸有关,氨基酸中的非极性片段之间的疏水相互作用可以让蛋白之间结合紧密。蛋白质中疏水氨基酸的比率会影响凝胶的形成,当蛋白中的疏水性氨基酸超过31.5%时,有可能形成不透明的凝结型凝胶,非极性氨基酸残基低于31.5%时的蛋白质则形成半透明或透明型凝胶。疏水相互作用对凝胶形成有重要作用。由表1可得蚕蛹不溶性蛋白中的疏水性氨基酸比例约为40%,理论上在一定条件下有可能形成不透明的凝结凝胶[10-11]。

表1 不溶性蛋白氨基酸分析
2.2 不同pH处理对蚕蛹不溶性蛋白流变性能的影响
储能模量G′也称弹性模量,反映蛋白凝胶网络结构的形成情况,代表样品的弹性特征;耗能模量G″也称黏性模量,代表样品的黏性特征[12]。损耗角正切tanδ是G″与G′模量的比值,黏性模量(G″)小于弹性模量(G′),tanδ<1,表明凝胶体系中弹性占主导地位[13],反之则表示黏性占主导地位。tanδ值越高则表明样品组分越黏稠或弹性越低,tanδ值越小,表明样品弹性越高[14];当G′值明显大于G″值时,tanδ越小,表明该体系属于弱凝胶体系[15]。
蛋白在加工过程中其凝胶特性受外界条件温度、pH、离子强度等影响,pH的变化会引起蛋白分子内部结构及分子间作用力发生变化。食品中体系一般为弱酸性或弱碱性,故选择pH 5.0~8.0为模拟加工体系,对蚕蛹蛋白处理后对其流变性能进行测定。由图1-a、图1-b可以看出,在pH 5.0~8.0,随着频率的增加,G′和G″模量出现上升趋势,这表明频率的增加导致了蛋白分子内作用力增强。在相同的振荡频率下,pH 6.0时G′和G″值相对最高,表明pH 6.0时蛋白分子间的相互作用较强,有利于蛋白凝胶网络形成,凝胶性能较好;pH 8.0时G′和G″值相对最低,表明此条件下蛋白相互作用相对较弱,凝胶性能较差。与WESTPHALEN等[16]研究结果类似,随着pH值的增加猪肉肌球蛋白的G′值逐渐减小,其原因可能是随着pH的变化,蛋白质分子间的作用力发生了变化,导致凝胶性能发生变化。图1-c显示,随着频率的增加,tanδ值出现下降趋势,这表明蛋白凝胶体系弹性进一步增强,tanδ值的变化与蛋白键间的弛豫行为有关[17],在频率0~1 Hz tanδ出现极大值可能是与初始凝胶网络结构的部分松散[10]以及蛋白键持续作用时间相对较短有关[18]。在1~10 Hz频率范围内,pH 8.0时tanδ最小,此时体系弹性最好,但在该扫描模式下蛋白样品的tanδ<1,蛋白的弹性模量(G′)明显大于黏性模量(G″),表明蚕蛹不溶性蛋白凝胶体系在pH 5.0~8.0是一种弱凝胶。
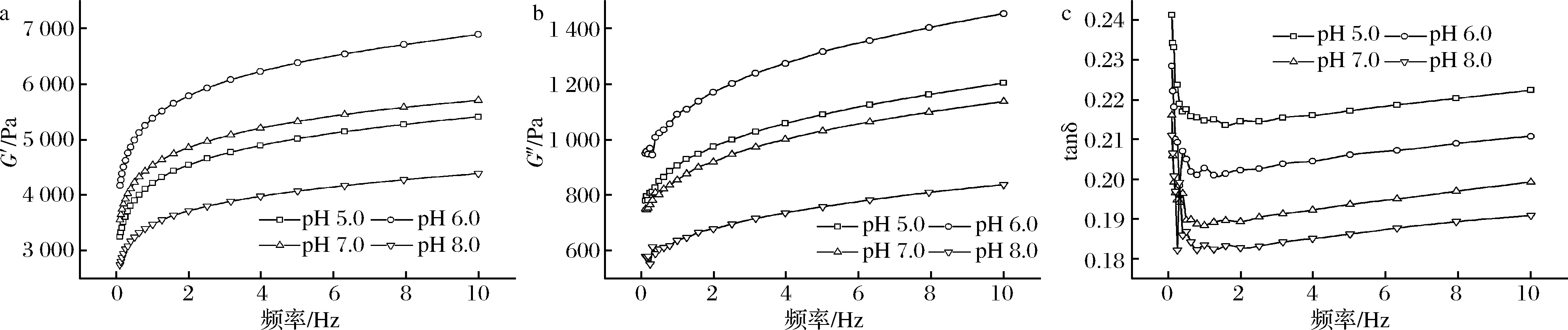
a-G′;b-G″;c-tanδ
由图2-a、图2-b可以看出,随着温度的升高,蛋白质的G′和G″值总体呈现下降趋势。温度升高导致蛋白模量急剧下降,可能是由以下原因引起的[19]:(1)随着温度的升高,部分蛋白分子间作用受到破坏,凝胶网状结构缺少支撑而变得松散;(2)蛋白质的构象转变可能使得凝胶网络的完整性受到破坏,导致蛋白的黏弹性下降。而出现平台期的原因可能是高温下的蛋白凝胶之间的作用力达到了短暂的平衡。tanδ值下降,说明总体而言高温下更有利于体现蚕蛹蛋白的弹性,原因是高温下构象转变,蛋白分子黏性受到的破坏更强。tanδ值出现快速下降趋势,表明随着温度升高固体性质增强以及流体性质减弱。整个凝胶体系tanδ<1,表明该模式下蚕蛹不溶性蛋白凝胶体系仍为弱凝胶体系。
G′和G″值在不同pH下发生变化的原因是pH变化会引起蛋白质结构变化,导致蛋白分子内部网络结构的作用力受到了影响,从而引起了蛋白凝胶性能发生变化。可以根据在不同的pH下蛋白结构是否发生变化来推测流变学特性发生改变的原因。

a-G′;b-G″;c-tanδ
2.3 不同pH处理对蚕蛹不溶性蛋白结构的影响


图3 不同pH条件下的拉曼谱图
酰胺I带拉曼特征峰的结构普遍归属[23]分为:α-螺旋结构对应范围为1 645~1 658 cm-1;β-折叠结构对应范围为1 665~1 680 cm-1;β-转角结构对应范围为1 640~1 644 cm-1与1 681~1 690 cm-1;无规卷曲结构对应范围为1 659~1 664 cm-1。通常利用酰胺Ⅰ带或者酰胺Ⅲ带检测蛋白质的主链结构,根据拉曼原始数据拟合蛋白质二级结构的相对含量,本研究利用酰胺Ⅰ带并根据ALIX等[24]的方法分析不同pH处理后蛋白质样品中的α-螺旋,β-折叠,β-转角和无规卷曲的含量。
如图4所示,α-螺旋相对含量在pH 5.0~8.0随着pH的增大而增大,而β-转角和无规则状态的相对含量在此范围内减少,表明蛋白质的二级结构随着pH的增大有序化度增加[25]。根据以上流变学结果显示,无论是频率扫描还是温度扫描,pH 8.0时样品的G′和G″模量相对较低,可能说明不溶性蚕蛹蛋白结构有序化不利于凝胶网络的形成。凝胶网络的形成和蛋白质间的相互作用有关,进一步通过微环境分析蛋白质间相互作用变化趋势。
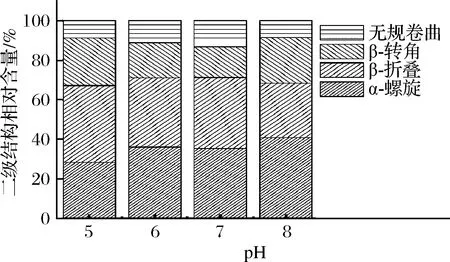
图4 不同pH条件下的二级结构相对含量
760 cm-1附近的拉曼光谱带归属为色氨酸侧链,可用于研究色氨酸残基的疏水性微环境的变化,当色氨酸残基从被包埋态疏水微环境变成被暴露态极性环境时,760 cm-1附近的峰强度可能下降[26]。如图5所示,在pH 6.0时的I760归一化强度达到一个极大值,说明更多的色氨酸残基没有暴露在表面,可能是蛋白质内部更多的疏水作用形成而导致的疏水基团包埋,结合流变学结果,pH 6.0时G′和G″模量较高,可能说明分子内部疏水作用的形成,更有利于蚕蛹蛋白凝胶网络的形成。当色氨酸残基趋于暴露时,可能导致蛋白内部疏水相互作用降低,不利于蚕蛹蛋白凝胶网络的形成,G′和G″值出现降低趋势。
酪氨酸的特征双峰(850/830)是酪氨酸残基上对位取代苯环的振动引起的[27],其双峰比值(I850/I830)可作为微环境及酚羟基上氢键的探针以及酪氨酸组分埋藏和暴露的程度[28],当I850/I830的比值为1.25~1.40时,表明此时酪氨酸残基完全暴露于分子表面;当比值为0.3~0.5时,酪氨酸残基完全包埋而藏于分子内部;当比值为0.7时,酪氨酸残基此时处于电离状态[29]。由图5可得,在pH 5.0~6.0,I850/I830比值均大于1,pH 6.0时I850/I830比值相对最低,此时酪氨酸暴露最少。酪氨酸作为氢键的供体[30],酪氨酸暴露减少说明分子间氢键作用减少,结合流变学结果,pH 6.0时G′和G″模量较高,此时氢键作用较弱,因此推测过多的氢键形成可能不利于不溶性蚕蛹蛋白凝胶网络体系的形成。
在动物性蛋白中,肌原纤维蛋白的热诱导凝胶过程中疏水作用和二硫键的形成起到重要作用[15],而胶原蛋白类凝胶形成过程中氢键起到更重要的作用[31],维系不溶性蚕蛹蛋白凝胶特性的可能主要是疏水作用,由此可见,其凝胶维系方式可能与肌原纤维蛋白更加接近。
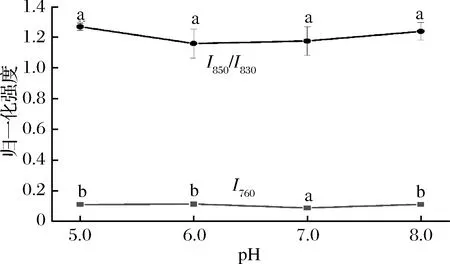
图5 不同pH条件下的归一化强度
2.4 不同盐浓度处理对蚕蛹不溶性蛋白流变性能的影响
除了pH的影响外,离子强度会引起蛋白分子内部结构及分子间作用力发生变化,从而引起蛋白凝胶性质发生变化。依据肉糜蛋白类制品加工过程中常用盐浓度,探究不同盐浓度处理后蛋白质的G′、G″值和tanδ值的变化情况,进行频率扫描后的变化如上图所示。由图6-a、图6-b可以看出,随着频率的增加,不同盐浓度条件下的G′和G″值呈现增加趋势,在相同的振荡频率下,低盐质量浓度(10~20 g/L)的G′值小于对照组,与BERGROS等[32]类似,盐的加入影响了罗非鱼蛋白凝胶的G′值,盐处理后的蛋白G′值明显低于未加盐处理的蛋白;中高盐浓度(25~35 g/L)的G′值高于对照组,可能是盐影响了蛋白分子间的作用,导致蛋白质凝胶网络的稳定性发生变化。在盐质量浓度为35 g/L时,体系的G′和G″值相对最高,表明此条件下蛋白质分子间的相互作用较强,此时有利于蛋白凝胶网络的形成,流变性能较好。由图6-c可以看出,tanδ值随着频率的增加出现下降趋势,tanδ值的下降表明样品弹性增强。在1~10 Hz,对照组的tanδ最小,此时体系弹性最好,经过盐处理后蛋白体系弹性下降。在盐质量浓度为0~35 g/L时,所有体系的G′值明显大于G″值,tanδ值分布在0.12~0.24,表明蚕蛹不溶性蛋白凝胶体系属于弱凝胶体系。
由图7-a、图7-b可以看出,随着温度的升高,不同盐质量浓度(0~35 g/L)处理后蛋白的G′和G″值总体呈现下降趋势,G′值在25~70 ℃出现快速下降的趋势,70 ℃后出现一个相对平稳的平台期;G″值在25~70 ℃出现快速下降的趋势,70 ℃后出现一个较小的下降趋势;在相同扫描温度下,在盐质量浓度为35 g/L时的G′和G″值最高,此条件下蛋白质分子间的相互作用较强,有利于蛋白质凝胶网络的形成,流变性能较好;由图7-c可以看出,tanδ值总体呈现下降趋势,随着温度的升高,tanδ值在25~40 ℃时呈现先缓慢下降趋势,40 ℃之后出现快速下降的趋势。该扫描模式下tanδ值曲线分布密集,tanδ值总体分布范围在0.12~0.24,G′明显大于G″值,表明蚕蛹不溶性蛋白凝胶体系属于弱凝胶体系。
G′和G″值在不同盐浓度下发生变化的原因是离子浓度的变化可能会引起蛋白结构变化,导致蛋白内部分子间维持凝胶网络结构的作用力受到影响,从而引起了蛋白凝胶性能发生变化。可以根据在不同的盐浓度下蛋白结构是否发生变化来推测流变学特性发生改变的原因。

a-G′;b-G″;c-tanδ
2.5 不同盐浓度处理对蚕蛹不溶性蛋白结构的影响
图8为不同盐质量浓度(0~35 g/L)处理后蛋白样品的拉曼光谱曲线。不同盐浓度处理后的拉曼光谱图基本一致,利用酰胺Ⅰ带并根据ALIX等[24]的方法分析不同盐浓度处理后蛋白样品中的α-螺旋,β-折叠,β-转角和无规卷曲的含量。

图8 不同盐浓度条件下的拉曼谱图
如图9所示,在盐质量浓度为0~35 g/L时,α-螺旋和β-折叠的相对含量变化不明显,α-螺旋和β-折叠的相对含量均分布在65%~75%,表明此条件下的蛋白质内部结构比较稳定有序。

图9 不同盐浓度条件下的二级结构相对含量
如图10所示,在盐质量浓度范围为0~35 g/L,盐质量浓度为35 g/L时,I760强度达到一个极大值,色氨酸趋于包埋,说明此时更多的色氨酸残基没有暴露在表面,可能是蛋白内部更多的疏水作用形成而导致的疏水基团包埋,结合流变学结果,盐质量浓度35 g/L时G′和G″模量较高,可能说明分子内部疏水作用的形成,更有利于蚕蛹蛋白质凝胶网络的形成。当色氨酸残基趋于暴露时,可能导致蛋白质内部疏水相互作用降低,不利于蚕蛹蛋白凝胶网络的形成,G′和G″值出现降低趋势。
由图10可得,在盐质量浓度范围0~35 g/L内,盐质量浓度为35 g/L时I850/I830比值最小,此时酪氨酸暴露最少,酪氨酸作为氢键的供体,酪氨酸暴露减少说明分子间氢键作用减少,结合流变学结果,此时G′和G″模量较高,氢键作用较弱,因此推测过多的氢键形成可能不利于不溶性蚕蛹蛋白质凝胶网络体系的形成。当酪氨酸暴露增多时,不利于蛋白质凝胶网络体系的形成,可能导致流变学特性变差,G′和G″值出现降低趋势。

图10 不同盐浓度条件下的归一化强度
2.6 TG酶处理对蚕蛹不溶性蛋白流变性能的影响
TG酶是一种催化蛋白质分子侧链中谷氨胺残基与赖氨酸之间形成ε-(γ-谷氨酰基)赖氨酸共价键的蛋白酶,通常用于蛋白质凝胶特性的改善[33]。由图11-a~图11-c可以看出,随着频率增大,蛋白体系的G′和G″值总体呈现上升趋势;由图11-d~图11-f可以看出,随着温度的升高,蛋白体系的G′和G″值总体呈现下降趋势。无论是频率扫描还是温度扫描,蛋白凝胶体系的黏性模量(G″)始终小于弹性模量(G′),tanδ值<1,表明蚕蛹不溶性蛋白质凝胶仍是弹性占主导地位的弱凝胶体系。加入TG酶处理后的蛋白体系的G′和G″模量明显增大,黏弹性增强,表明TG酶的添加可有效改善蚕蛹不溶性蛋白的凝胶特性。
在典型加工条件下,不溶性蚕蛹蛋白呈现弱凝胶特性,而TG酶可以显著增强其凝胶特性,这表明在TG酶交联条件下,不溶性蚕蛹蛋白具有开发凝胶类蛋白质制品或作为在其中添加使用的可行性。

a-G′;b-G″;c-tanδ
3 结论
(1)不溶性蚕蛹蛋白中必需氨基酸含量40%,是一种营养价值较高的蛋白质资源,且疏水性氨基酸比例达到40%,有蛋白质分子间通过疏水作用力形成不透明凝胶的可能。
(2)不溶性蚕蛹蛋白经过不同的pH和不同盐浓度处理后,经过流变学频率扫描和温度扫描显示,在pH 6.0、盐质量浓度为35 g/L时,不溶性蛋白体系的G′值和G″值最高,黏弹性最好;在pH 5.0~8.0、盐质量浓度为0~35 g/L时,不溶性蛋白质凝胶体系的G′值明显大于G″值,tanδ<1,表明不溶性蛋白质凝胶是一种弱凝胶。拉曼光谱学显示,pH增大会引起蛋白质结构有序化增多,但不利于蛋白质网络的形成,不溶性蛋白体系的G′值和G″值在pH 8.0时最低。色氨酸的暴露与疏水相互作用有关,色氨酸在pH 6.0及盐质量浓度35 g/L时趋于包埋态,分子内部疏水作用的形成,更有利于蚕蛹蛋白质凝胶网络的形成,此时G′值和G″值最高。当色氨酸残基趋于暴露时,可能导致蛋白质内部疏水相互作用降低,不利于蚕蛹蛋白质凝胶网络的形成。酪氨酸的暴露与氢键作用力有关,酪氨酸在pH 6.0时及盐质量浓度35 g/L暴露最少,说明分子间氢键作用减少,结合流变学结果,推测过多的氢键形成可能不利于不溶性蚕蛹蛋白凝胶网络体系的形成。疏水相互作用和氢键可能是影响蛋白质凝胶网络的的关键作用力,蛋白微环境发生变化时,维持蛋白质凝胶网络结构的作用力也会发生变化,流变学特征的G′值和G″值发生变化。
(3)加入TG酶处理后的蛋白体系的G′和G″模量明显增大,黏弹性增强,表明TG酶的添加可改善不溶性蛋白的凝胶特性。实验结果可为不溶性蚕蛹蛋白质的加工提供一定的理论参考。

