牦牛胃溶菌酶在解脂耶氏酵母中的重组表达及性质研究
冉 嫆 刘毓均 夏 果 江明锋
(1.西南民族大学青藏高原研究院,四川成都610041;2.西南民族大学畜牧兽医学院,四川成都610041)
近年来,消化型溶菌酶(digestive lysozyme)是一种从反刍动物胃中分离出的新型溶菌酶。该酶能抵抗胃蛋白酶的降解,可以在酸性条件下发挥溶菌活性,因此能够对反刍动物胃中的微生物进行消化分解,并将分解产物作为营养成分加以吸收[1]。反刍动物前胃和真胃的胃黏膜组织均可分泌,其在皱胃组织中表达水平最高[2-3]。
与传统溶菌酶相比,为适应胃中的蛋白酶及酸性的环境,反刍动物胃溶菌酶发生了许多适应性进化,表现出具有抗菌、耐酸、耐热及抗胃蛋白酶等优点[4-5],但在严峻的胃环境下保持其溶菌酶活性的机制尚不十分清楚。由于该酶活性和鸡蛋清溶菌酶(egg lysozyme, eLYZ)相当,因此可考虑用反刍动物胃溶菌酶代替传统溶菌酶作为饲料添加剂,减少胃蛋白酶和胃酸对其活性的影响,达到更好的饲喂效果。
据报道,黄牛胃消化溶菌酶2在胃中的高稳定性可能与其胃蛋白酶抗性和胃溶菌酶本身的适应性变化有关[6]。目前,研究人员主要对人溶菌酶(human Lysozyme, hLYZ)和eLYZ的重组表达进行研究[7-9],反刍动物胃溶菌酶异源表达的研究报道较少。Jiang等[10]克隆并表达了牦牛胃中编码溶菌酶的cDNA。江伟华等[11]克隆了藏绵羊胃溶菌酶基因并对其进行原核表达,其生物活性为400 U/mL。任洪辉等[12]利用毕赤酵母表达系统对牦牛胃溶菌酶基因进行分泌表达,获得上清液酶学活性为875.14 U/mg。刘毓均等[13]成功利用毕赤酵母对其进行了分泌表达。从目前的研究结果看,重组胃溶菌酶的表达量较低。为得到表达水平较高的产反刍动物胃溶菌酶的重组菌株,有必要尝试利用新的表达系统进行表达。解脂耶氏酵母可用于表达各种异源蛋白质,其优点是:外源基因易整合到酵母基因组,蛋白表达量高,能进行翻译后加工,重组菌可进行高密度发酵以及所表达蛋白质的低糖基化等[14]。因此常利用解脂耶氏酵母表达一些难表达或表达量低的异源蛋白。
目前,暂未见利用解脂耶氏酵母表达牦牛等高原反刍动物胃溶菌酶的报道。鉴于此,实验拟用该表达系统构建重组酵母菌株。为rysLYZ 在畜牧、医药卫生等领域的应用及其规模化生产奠定基础,进而推动溶菌酶在生产中的应用。
1 材料与方法
1.1 实验材料
ysLYZ 序列参考NCBI 牦牛胃溶菌酶基因序列(GenBank 检索号:AMR70500.1),解脂耶式酵母菌株(Y. lipolyticaPo1h)及表达载体pINA1297为青藏高原动物遗传资源保护与利用教育部重点实验室保存。限制性内切酶BglⅠ、BamHⅠ、NotⅠ及Premix Taq™等购自TaKaRa 公司,胃蛋白酶、hLYZ 购自Sigma 公司,eLYZ 购自Biotopped 公司,CM-Sepharose FF 预装柱(1 mL)购自GE 公司,胶回收试剂盒购自Omega 公司,BCA蛋白定量试剂盒购自天根生化科技(北京)有限公司。
1.2 实验方法
1.2.1 基因序列优化与重组表达载体构建
ysLYZ 基因序列送上海生工合成,通过网站http://www.jcat.de/Start.jsp、DNAMAN 等进行密码子优化,目的基因两端分别引入BglⅠ和BamHⅠ限制性酶切位点并连接至pINA1297表达载体信号肽的下游。重组表达载体pINA1297-ysLYZ在大肠杆菌TOP10中进行扩增,并进行双酶切验证。
1.2.2 重组菌株的筛选及验证
用限制性内切酶NotⅠ对质粒pINA1297-ysLYZ进行酶切并线性化。酶切反应液于37 ℃水浴酶切反应1 h,酶切产物进行电泳检测。按胶回收试剂盒(Omega 公司)说明书步骤对线性化目的条带进行切胶回收。回收含目的基因的大片段,在室温下按照试剂盒(Frozen-EZ Yeast Transformation II ™)转化至Polh 酵母细胞。转化子在MD 平板上生长4~7 d 后,长出白色的转化子并随机挑取5 个转化子接种至YPD培养基中培养过夜。提取基因组,用PCR验证引物对转化子进行验证(引物序列:ysLYZ-F:5'-CTGGCAAGACCTTCGAGCGATG- 3'/ysLYZ- R:5'- AGCAGGGCGGAACAGGAGAC-3')。
1.2.3 重组菌株的诱导表达及分离纯化
将筛选到的单菌落接种到5 mL的YPD液体培养基中,30 ℃、200 r/min 条件下培养24 h,将初培养液转接至50 mL 的BMSY 液体培养基中,与上述同样条件下培养。每24 h 收集1 mL 发酵上清,经TCA 法浓缩后进行SDS-PAGE 电泳检测重组蛋白表达情况。培养96 h 后,发酵液10 000 r/min 离心10 min 收集上清液并测定rysLYZ活性。用硫酸铵进行分级沉淀,在35%饱和度收集上清液,硫酸铵饱和度到80%收集沉淀并溶解于透析缓冲液中。将蛋白样品溶液在4 ℃透析48 h。透析结束后,蛋白样品于4 ℃、7 000 r/min条件下离心45 min,收集上清液。将透析后浓缩的蛋白样品以1 mL/min的流速上样;用5倍柱体积的平衡液以1 mL/min 的流速平衡层析柱至UV 基线及电导率稳定。用洗脱液以1 mL/min 的流速对层析柱进行梯度洗脱,根据层析图谱对所有出峰洗脱液进行收集,并保存于4 ℃冰箱。
1.2.4 rysLYZ浓度、活性测定及抗菌机理
采用天根生化科技(北京)有限公司生产的蛋白定量试剂盒(BCA 法)方法测定rysLYZ 蛋白浓度。按照溶菌酶检测试剂盒(南京建成生物工程研究所)方法配置相关试剂;采用溶菌酶检测试剂盒附录Ⅱ方法配制反应体系(如表1)并测定反刍动物胃溶菌酶活性。

表1 空白对照法测定溶菌酶活性的反应体系(mL)
反刍动物胃溶菌酶活性计算公式:
溶菌酶活性(U/mL)=

金黄色葡萄球菌培养至菌密度约108~1010CFU/mL,向其中一份菌液中加入纯化的rysLYZ,另一方加入相同体积的无菌水作为对照;37 ℃水浴处理4 h 以上。上述样品经处理后送至成都里来生物科技有限公司进行电镜检测。
1.2.5 rysLYZ稳定性分析
配制模拟猪胃液,分别用去离子水或10 mmol/L醋酸铵缓冲液调节hLYZ、eLYZ 及rysLYZ 浓度为1.0 mg/mL,分别加入100 μL模拟胃液,置于37 ℃水浴处理。按时间梯度0、1、2、3、4 h分别各取一组反应液,并用5×上样缓冲液终止反应,样品置于-20 ℃保存备用。将各时间点获得的样品用SDS-PAGE电泳检测,观察溶菌酶在模拟猪胃液中的降解情况。
2 结果
2.1 重组ysLYZ载体的构建及验证

图1 重组表达载体pINA1297-ysLYZ的构建、验证
ysLYZ 全长390 bp。将扩增培养后重组质粒pINA1297-ysLYZ(图1A)经双酶切鉴定,酶切条带约400 bp,大小与理论相符(图1B泳道2)。重组表达质粒pINA1297-ysLYZ经NotⅠ酶切,成功获得线性化条带(图1B泳道4)。
2.2 ysLYZ重组解脂耶式酵母菌株的筛选及诱导表达
挑选固体平板中生长快且菌落形态好的重组酵母菌株进行诱导表达,发酵上清经TCA 浓缩后进行SDS-PAGE 电泳。结果如图2 所示,rysLYZ 分子量大小约15 kDa,与理论值相符。上述结果表明,ysLYZ在解脂耶氏酵母中实现了分泌表达,在控制重组酵母菌种接种量、培养体积及诱导剂浓度等因素不变的条件下,rysLYZ 随培养时间增加而增加,培养72 h 时表达量最高。
2.3 重组菌株分离纯化蛋白的比较结果
随着不同硫酸铵浓度的加入,发酵上清中蛋白逐渐被析出,SDS-PAGE 如图3A 所示。测得发酵上清酶活性为578.3 U/mL,折算成上清粗酶活性(按mg)为1 156.6 U/mg。当硫酸铵浓度为80%时,沉淀中含有较多的目的蛋白,而对应的上清液中无目的蛋白存在。故将二次沉淀时硫酸浓度设定为80%。rysLYZ样品经硫酸铵沉淀、透析等步骤初纯化,经CM-Sepharose FF 层析柱进行梯度洗脱后如图3B,整个纯化过程出现两个蛋白吸收峰并分别收集蛋白样品;其中吸收峰1 为CM-Sepharose FF 柱平衡液洗脱峰;吸收峰2为CM-Sepharose FF柱洗脱液洗脱峰。
将经各步分离纯化所获得的rysLYZ 样品进行SDS-PAGE,结果如图4 所示。其中经CM-Sepharose FF柱洗脱液洗脱收集的rysLYZ样品显示为一条蛋白条带(图4 泳道6),表明该洗脱样品已经达到电泳纯。与标准蛋白质分子量(Marker)比较,rysLYZ分子量约为15 kDa。
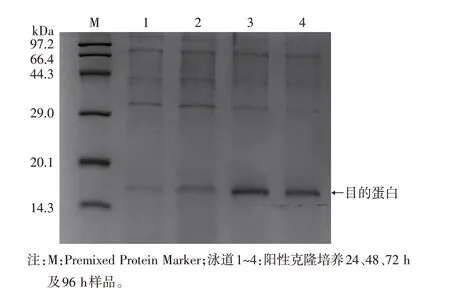
图2 阳性克隆发酵上清SDS-PAGE

图3 硫酸铵分级沉淀SDS-PAGE电泳、CM-Sepharose FF柱层析
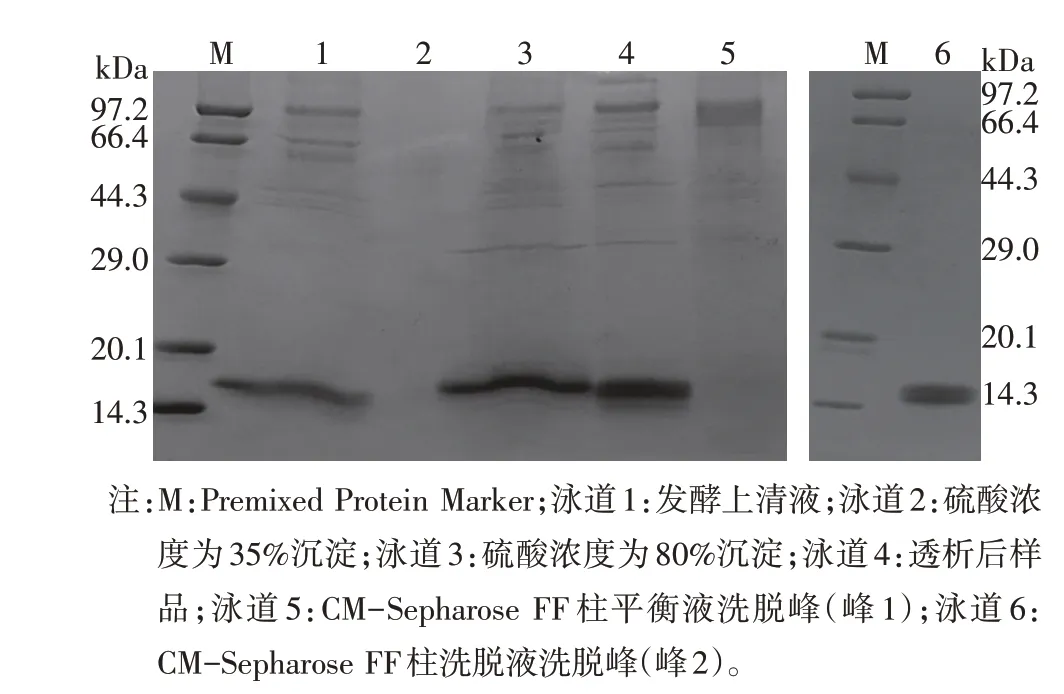
图4 rysLYZ纯化样品SDS-PAGE电泳
上述CM-Sepharose FF 柱洗脱液洗脱样品经超滤浓缩、透析脱盐等步骤后,分别检测rysLYZ 活性及蛋白质浓度,并计算其比活力为1 855.42 U/mg。
2.4 rysLYZ的抗菌作用
将经过rysLYZ 作用后的金黄色葡萄球菌在扫描电镜下观察菌体表面轮廓的变化。电镜下未经rys-LYZ 处理的金黄色葡萄球菌表面光滑,轮廓清晰(图5A)。而与rysLYZ一起孵育的金黄色葡萄球菌,其细胞表面轮廓模糊,部分菌体凸起,出现孔洞,最终崩解(图5B和图5C)。
2.5 rysLYZ抗胃蛋白酶能力检测
消化性胃溶菌酶需要具有蛋白酶抗性才能维持其在胃中的溶菌酶活性。如图6 所示,rysLYZ 对胃蛋白酶的抵抗力比人(或鸡蛋清)溶菌酶高。在模拟猪胃液中,rysLYZ 在作用4 h 后仍有部分保持完整;而人(或鸡蛋清)溶菌酶在作用1 h后已无完整的蛋白结构。

图5 金黄色葡萄球菌的扫描电镜分析

图6 胃蛋白酶处理后样品SDS-PAGE电泳
3 讨论
江伟华[15]提取牦牛、藏黄牛、藏绵羊皱胃黏膜中胃溶菌酶的含量分别为0.126、0.078、0.016 mg/g,与其他溶菌酶相比,反刍动物胃溶菌酶能在其他溶菌酶无活性或活性较低的胃中(含有胃蛋白酶和胃酸)保持较高的溶菌能力以及保持结构稳定;具有抗双乙酰化、抗菌、在酸性环境下稳定发挥功能以及耐受胃蛋白酶降解等性质。本研究中主要看重反刍动物胃溶菌酶能够在富含蛋白酶和胃酸的环境中保持生物学活性[16-18]。近年来,越来越多的研究者关注通过物理或化学的相互作用来修饰溶菌酶以提高其对革兰氏阴性菌株的敏感性[19]。在CM-Sepharose FF 柱层析时,出现两个吸收峰(图3B);其中峰1 为平衡液穿透峰且无重组蛋白,分析可能是样品中色素穿过CMSepharose FF 层析柱时形成的吸收峰。将纯化的rys-LYZ与金黄色葡萄球菌一起孵育,发现rysLYZ主要通过破坏金黄色葡萄球菌细胞壁而发挥抑菌作用,该实验结果与天然胃溶菌酶相似[20]。重组溶菌酶对金黄色葡萄球菌的抑菌作用为溶菌酶可能参与牦牛胃的消化和抑菌活性提供了强有力的证据。
胃溶菌酶对胃中环境的适应性进化也引起了人们的兴趣[21],胃溶菌酶基因的编码区域以一种协调的方式进化,反刍动物胃溶菌酶基因编码外显子的协同进化可能有助于溶菌酶在胃中发挥新的功能[22],通过对黄牛、绵羊、鹿、叶猴等胃溶菌酶序列与已知序列的溶菌酶进行比较,发现有一些共同的物理化学和催化性质,使其适应在胃液中的功能[23]。在猪的模拟胃液中,rysLYZ能够在酸性环境中稳定存在并对胃蛋白酶的消化作用具有明显的抗性,这一独特的性质可能与其蛋白高级结构的构象稳定性和Asp-Pro 键缺失有关[24-25]。研究表明胃溶菌酶蛋白结构中含有复合盐桥、表面净电荷较低等因素,与蛋清溶菌酶相比,胃溶菌酶具有更高的构象稳定性即其结构刚性更大。该结构有效规避了部分胃蛋白酶水解位点,可以防止胃蛋白酶的消化[26-27]。因此,可利用反刍动物胃溶菌酶抗胃蛋白酶的能力制作饲料添加剂。以利于溶菌酶直达肠道,发挥消炎功能。
在畜牧养殖业中,已经采用溶菌酶作为抗生素替代品添加在饲料中。例如:徐小波等[28]采用添加溶菌酶的饲料喂养仔猪和仔鸡,发现溶菌酶在抑制家畜腹泻和预防肠胃炎症等方面发挥明显作用。溶菌酶可溶性粉剂治疗仔猪腹泻效果优于传统用药,腹泻率显著降低,对引起仔猪腹泻的埃希氏大肠杆菌和轮状病毒有较强的抑制作用[29]。这些研究结果表明溶菌酶可在养殖业中发挥广泛作用。另外,溶菌酶肠溶片在人类肠炎、扁平疣、小儿疱疹性口腔炎等人类疾病上均发挥了重要作用。但是,eLYZ及hLYZ等普通溶菌酶缺乏抗胃蛋白酶的能力,难以抵抗胃中蛋白酶的降解并到达肠道发挥抗菌作用。因此,在作为药物或饲料添加剂时,需通过特殊处理或加量的方法维持其功效。若能解决产量问题,反刍动物胃溶菌酶的新的特性使得其在饲料工业上应用前景更为光明,更具商业价值。从另一角度看,也可在对反刍动物胃溶菌酶性质形成机理充分研究的基础上,对hLYZ或eLYZ进行改造使之具备抗胃蛋白能力并应用于医疗或工业生产中。
4 小结
本文采用解脂耶氏酵母菌株(Polh)利用多整合表达载体(pINA1297)实现了ysLYZ的分泌表达,发酵上清液经CM-Sepharose FF柱层析等纯化后获得了电泳纯级rysLYZ,该重组酶可破坏金黄色葡萄球菌的细胞壁并具有抗胃蛋白酶及耐胃酸的能力。

