强化生物堆法修复多环芳烃污染土壤的初步研究
谢林培,祝冲之,2,张晓东,2,余 冉①,展漫军,孙丽伟
(1.东南大学能源与环境学院,江苏 南京 210096;2.生态环境部南京环境科学研究所,江苏 南京 210042;3.南京市环境保护科学研究院,江苏 南京 210013)
多环芳烃(polycyclic aromatic hydrocarbon,PAHs)是由2个或多个苯环以直接连接、弯曲连接或聚集方式构成的特殊化合物。PAHs具有熔点和沸点较高、低水溶性、蒸汽压小、热稳定以及难降解等特点[1],主要产生于有机物质不完全燃烧过程以及石油开采、运输、生产和使用过程中发生的溢油事件[2]。PAHs对生物体具有致癌、致畸和致突变的“三致作用”,是环境中普遍存在的有毒污染物[3]。PAHs可通过沉降和迁移进入土壤和水体,并可通过直接接触和食物链进入人体而危害公共健康[4]。2014年《全国土壤污染状况调查公报》中明确指出有机污染物主要在工业废弃地、工业园区、采油区、采矿区、污水灌溉区和干线公路两侧累积[5]。目前,GB 36600—2018《土壤环境质量 建设用地土壤污染风险管控标准(试行)》中有限值的PAHs(最低限值)有8种,分别为萘(25 mg·kg-1)、苯并[a]蒽(5.5 mg·kg-1)、苯并[a]芘(0.55 mg·kg-1)、(490 mg·kg-1)、苯并[b]荧蒽(5.5mg·kg-1)、苯并[k]荧蒽(55 mg·kg-1)、茚并[1,2,3-cd]芘(5.5 mg·kg-1)和二苯并[a,h]蒽(0.55 mg·kg-1)[6]。在产或退役农药厂场地土壤中除检出农药类特征污染物外,同时还检测出一定数量的PAHs[7]。因此修复PAHs污染土壤是紧迫和棘手的热点研究问题之一。
污染土壤中PAHs可以采用物理、化学和生物修复法中的一种或多种联合去除。传统物理修复技术有客土法、填埋法、焚烧法、隔离法和换土法等[3],化学修复技术有化学淋洗法、萃取法、化学氧化法和光催化降解技术等[8]。但是物理和化学修复法存在处理成本高、去除不彻底、易导致二次污染等缺点。生物修复法指利用特定生物降解土壤中污染物,或将其转化为无害物质[9]。微生物修复技术具有使用成本低、无二次污染、可以大面积普及使用等优点,被认为是具有广泛应用潜力的有效措施。相关研究[10]已发现微生物降解是污染土壤和沉积物中PAHs的主要自然去除途径。
微生物经过自然驯化,能以PAHs作为碳源用于生长繁殖[10]。但目前已发现的多种微生物仅能降解单一PAHs,而PAHs污染土壤通常具有复合污染特性。同时,微生物由于代谢通路限制,无法降解所有类型PAHs,或将其完全降解,并极有可能产生有毒降解副产物[11]。因此,需要利用混合菌群协同作用,如共代谢作用等,并通过改善微生物作用环境以刺激微生物活性增强,如曝气、添加必要营养物质等。鉴于PAHs的水溶性差,生物可获得性低,原位PAHs生物修复效果无法保证,有研究者尝试添加表面活性剂改善土壤中PAHs溶解性,增加它们的生物利用度[12-13]。表面活性剂可分成离子型和非离子型2大类。非离子表面活性剂,如Tween 80,基团之间排斥力较弱,对PAHs的溶解能力比离子型表面活性剂高,并且具有可生物降解、在固体表面不易吸附和环境友好的优点,常应用于土壤修复中[14-16]。生物堆处理技术是一种新型异位生物修复技术,是将大量污染土壤混合堆积成堆体,并通过调节氧气、水分和养分以最大程度促进微生物好氧降解污染物[17]。
通过生物堆反应模拟装置,对采用生物堆修复技术处置PAHs污染土壤的工艺条件进行优化并探讨其影响因素,筛选富集PAHs的高效降解混菌,研究投加降解菌对生物堆技术处理PAHs污染土壤的强化效果,同时研究非离子表面活性剂Tween 80对改善PAHs生物可获得性、提高PAHs生物降解效率的影响机制,研究可为PAHs污染工业场地土壤修复提供理论基础和技术支持。
1 材料与方法
1.1 实验材料与装置
PAHs污染土壤取自江苏南京某化工厂退役场地,其pH值为8.33±0.39,含水率为(20.8±1.3)%,有机质含量为(32.6±2.9) g·kg-1,全氮含量为(84.93±31.10) mg·kg-1,全磷含量为(18.13±0.53) mg·kg-1。土壤中含有16种美国环保署优先控制PAHs,其平均含量为479.9~1 337.4 mg·kg-1,其中低分子质量PAHs(2~3环)质量占总PAHs质量的75.1%,中分子质量PAHs(4环)占17.8%,高分子质量PAHs(5~6环)占9.1%。
这16种PAHs的混合标准品选择EPA610(美国o2si标准品公司)。
1.2 PAHs降解混菌的筛选富集
采用尿素和磷酸二氢钾将污染土壤m(C)∶m(N)∶m(P)调节为100∶20∶1后,称取100 g土壤悬浮于装有0.5 L超纯水的1 L烧杯中,以150 r·min-1搅拌2 h后取悬浮液以转速为6 755 r·min-1(离心半径为9.8 cm)离心10 min,取上清液经0.45 μm滤膜过滤、高压蒸汽灭菌(121 ℃,30 min),获得作为PAHs降解混菌富集培养所用的培养液。
将10 g PAHs污染土壤接种到100 mL培养液中于室温条件下培养8 h,过中速定量滤纸,取上清液10 mL接种到90 mL新鲜培养液中,再加入10 mL PAHs混合标准品溶液(16种PAHs质量浓度均为5 mg·L-1)。在25 ℃、遮光条件下以150 r·min-1振荡培养16 d。采用分光光度计监测菌液在600 nm波长处的吸光度(D600)。取菌液D600值最大时的混菌菌液用于后续生物堆实验研究,以验证其实际PAHs降解效能。
1.3 生物堆降解实验设计
生物堆降解实验在自制反应器(图1)中进行。反应器主体为圆柱体不锈钢容器,加带密封圈的盖子以确保密闭性。下层底部铺设不锈钢曝气穿孔管,同时用三脚架支撑不锈钢穿孔板,上铺纱布,用于承载污染土壤。曝气管与空气泵相连接,气泵启停由定时器控制,曝气管连接转子流量计以控制曝气流量。反应器顶部盖子开一小孔,以连接装有活性炭的废气吸收装置。
向PAHs污染土壤中混入w为1%的短稻草(长度为0.5~1.0 cm)和w为25%的沙子(粒径为0.150~0.250 mm),以改善土壤透气性。加入尿素和磷酸二氢钾调节m(C)∶m(N)∶m(P)为100∶20∶1,混合均匀后分装到4个平行反应器中。试验设置4个处理:1#为对照;2#添加1 000 mg·kg-1的Tween 80;3#以30 mL·min-1通气速率进行通气;4#添加1 000 mg·kg-1Tween 80并以30 mL·min-1通气速率通气(表1)。通风方式采用间歇通风,每隔4 h通风4 h。试验31 d时,采用喷瓶向3#和4#处理反应器喷洒10 mL·kg-1已筛选富集的PAHs降解菌剂,边喷洒边搅拌,使菌液与土壤均匀混合。
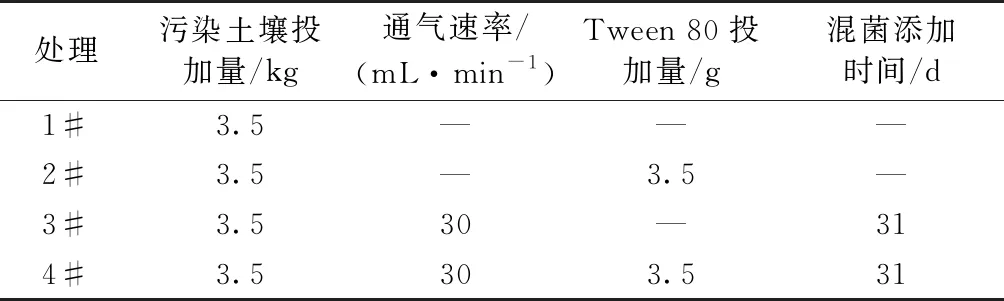
表1 实验条件设置
以预处理后分装到反应器前的土壤为0 d时样品,分别在9、16、23、31、41和80 d时于反应器上、中和下层分别随机取3个样混合,共约150 g。取样后向通风的3#和4#处理反应器加入适量水,保持土壤含水率稳定在20%~30%。
1.4 分析方法
1.4.1PAHs的分析方法
采用气相色谱-质谱法测定土壤中PAHs含量。称取土壤样品10 g(精确至0.1 g),与适量硅藻土混合研磨后,采用戴安ASE300加速溶剂萃取仪进行提取。提取剂为丙酮和二氯甲烷(体积比为1∶1),提取温度为100 ℃,提取时间为10 min。提取液用KD浓缩器浓缩至约1 mL,加入1 mL正己烷后继续浓缩,再用正己烷定容至1 mL后采用安捷伦7890-5977B气质联用仪测定。仪器条件参照HJ 834—2017《土壤和沉积物 半挥发性有机物的测定 气相色谱-质谱法》。
试验质量控制采用空白加标、基质加标、样品平行和添加替代物方式。空白加标16种PAHs标准样品的回收率为74.0%~100.0%,基质加标的平均回收率为76.0%~90.0%。2-氟苯酚、苯酚-d6、硝基苯-d5、2-氟联苯、2,4,6-三溴苯酚和对-三联苯-d14这6种替代物的回收率为70%~110%。
1.4.2脱氢酶活性的分析方法
土壤脱氢酶活性测定采用三苯基四氮唑氯化物(TTC)法。在含有1.00 g土壤样品的25 mL试管中加入2.5 mL Tris-TTC溶液(ρ为10 g·L-1,pH值为7.6),振荡试管使土壤颗粒与溶液充分混合,于37 ℃暗处孵育24 h。取出后加入10 mL乙醇溶液,涡旋1 min后静置,过0.45 μm滤膜过滤,将滤液在1 h内于485 nm波长下测吸光度。同时设置无土壤的对照组和以1% Tris溶液代替1% Tris-TTC溶液的对照组。
2 结果与讨论
2.1 PAHs降解混菌的筛选富集
在一定范围内,菌液中微生物细胞浓度与D600值呈正比。在添加外源PAHs的土壤渗滤液中进行PAHs降解混菌的富集筛选培养,并监测培养液D600变化以指示生物量变化。经过4 d的生长适应期后,降解混菌进入对数增长期,其D600从0.029增长到8 d时的0.331,之后进入稳定衰亡期(图2)。因此收集培养8 d时处于快速增长期的混菌菌液用于后续生物堆实验。
2.2 土壤PAHs含量变化
生物堆反应器运行期间,土壤pH和含水率基本保持稳定,含水率在20%~25%之间,pH值维持在8.4~9.0之间。由图3可知,1#~4#处理9 d时总PAHs降解率分别为84%、90%、86%和85%,各处理80 d时总PAHs降解率均在83%~85%之间。
由图4可知,不同分子质量PAHs降解速率存在明显差异,低分子质量PAHs在9 d内减少91%,反应9 d时平均降解速率为49 mg·kg-1·d-1;而中、高分子质量PAHs只有60%被降解,反应9 d时平均降解速率分别仅为8.4和4.2 mg·kg-1·d-1。已有研究表明,低分子质量的萘在土壤中半衰期约为2 d[18],菲的半衰期约为17 d[19],而4~6环的中高分子质量PAHs半衰期大于100 d[20]。因此,低分子质量PAHs较容易被污染土壤中土著微生物代谢降解,PAHs环数越高,降解难度越大。此外,土壤受污染时间也影响其对污染物的生物降解能力。有研究[21]表明污染200 d的土壤中PAHs降解速率高于污染50 d的土壤。MACLEOD等[22]研究了芘在牧地和林地2种土壤中的降解,发现随着芘与土壤接触时间的增加,其降解滞后期显著减少,降解速率提高。RHODES等[23]研究结果表明,菲与土壤接触84 d时的降解速率比接触1 d时更快。因此,研究区土壤由于长期受到PAHs污染,其中的PAHs,尤其是低分子质量PAHs有极强的降解能力,而中高分子质量PAHs降解则需更长时间。
高分子质量PAHs主要以共代谢方式进行生物降解[2],目前对其降解机制的研究主要集中在5环的苯并[a]芘的厌氧降解。在厌氧条件下,苯并[a]芘首先通过甲基化和还原反应使苯环断裂,随后在脱甲基作用下形成苯并[a]蒽和,最终经过甲基化反应形成蒽和菲[24-25]。由图4可知,生物堆土壤中低、中和高分子质量PAHs含量在41 d时有所提高,这可能是由于高环数PAHs经过一系列生化反应转化为低环数PAHs[24,26]。
投加Tween 80在试验期内对生物堆PAHs降解率没有显著影响(P>0.05)。添加Tween 80的2#处理PAHs降解率与1#对照相比没有明显提高。在通风条件下,与3#处理相比,添加Tween 80的4#处理PAHs降解率也没有明显提高(P>0.05)。PAHs水溶性低,微生物只能利用其进入水相的部分,表面活性剂能够促使PAHs由土壤吸附态或非水相向水相转移,从而提高PAHs的生物可利用性,促进PAHs生物降解[16]。但笔者试验中Tween 80的添加对生物堆降解PAHs没有起到积极作用,这可能是由于9 d时易降解PAHs已基本都被利用,难降解PAHs则需更长的生物反应时间。
同时,经过9 d的生物堆反应,85%以上的PAHs均已被去除,故以30 mL·min-1通风的3#处理PAHs降解效率与1#对照相比没有明显差异(P>0.05)。PAHs的微生物降解以好氧降解为主[27-28]。笔者试验中氧气可能不是PAHs生物降解速率的限制因素。在生物堆反应31 d后添加10 mL·kg-1PAHs降解混菌的3#和4#处理,总PAHs降解效率与加入菌液前没有明显提高,说明土壤中残留的难降解PAHs需要更长的生物降解时间,同时所投加混菌对难降解PAHs的降解能力还需进一步筛选优化。
2.3 土壤脱氢酶活性变化
由图5可知,各处理土壤脱氢酶活性在反应前41 d随反应时间延长缓慢增加,到80 d时,除1#对照外,其他处理土壤脱氢酶活性大幅增加。2#、3#和4#处理80 d时土壤脱氢酶活性较41 d时分别增加3倍、7倍和9倍。脱氢酶能催化有机物脱氢反应,作为氢的中间传递体,对有机物氧化还原反应起着重要作用。土壤脱氢酶活性可间接反映土壤微生物对PAHs的降解活性和对土壤有机质的代谢能力[29]。反应0~41 d时,与1#对照相比,2#~4#处理土壤脱氢酶活性均没有显著提高。反应41 d后,1#对照土壤脱氢酶活性基本不变,而其他各处理土壤脱氢酶活性显著提高。各处理80 d时土壤脱氢酶活性由大到小依次为4#(10 740 μg·g-1·h-1)>3#(7 300 μg·g-1·h-1)>2#(3 340 μg·g-1·h-1)>1#(986 μg·g-1·h-1)。而与0 d时相比,各处理9 d时PAHs降解率没有明显提高,这说明虽然PAHs尤其是低分子质量PAHs能够快速降解,但其并未完全矿化,而是转化为其他中间产物,并在反应41~80 d时被继续降解。
好氧条件下,PAHs首先在加氧酶催化下转化为顺式或反式二氢二醇化合物,然后在脱氢酶作用下转化为相应的醇后再进行下一步水解[30]。在厌氧条件下,PAHs首先经历一系列的甲基化、羟基化反应开环转化为甲酚,然后在脱氢酶作用下进一步水解[31]。Cycloclasticussp.Strain P1在降解菲和芘的过程中编码二氢二醇脱氢酶的基因高度表达,在降解萘的过程中编码二氢二醇脱氢酶的基因和水杨醛脱氢酶的基因特异性上调[32]。Rhodococcussp.P14在PAHs降解过程中脱氢酶基因表达增加,脱氢酶是PAHs降解过程中的限速酶[33]。
在厌氧条件下,菲和芘是Microbacteriumsp. strain M.CSW3和Pseudomonassp.JP1降解苯并[a]芘的中间产物[24,26],菲和芘的进一步降解也需要脱氢酶参与。笔者研究中,各处理可能对PAHs降解的中间产物降解有显著促进作用,其中2#处理促进作用较小,3#处理促进作用较明显,而4#处理促进作用最大。值得注意的是,3#和4#处理土壤脱氢酶活性在41 d后大幅提高,这说明31 d时添加的菌液在经过适应期后发挥了降解作用,虽然投加的混菌不具备降解土壤残留难降解PAHs的能力,但对降解中间产物的进一步矿化可能有显著促进作用。
3 结论
采用微生物修复法处理PAHs污染土壤,通过模拟生物堆实验运行80 d后,各处理PAHs污染土壤总PAHs降解率均在83%~85%之间,表明添加1 000 mg·kg-1的Tween 80、以30 mL·min-1通风和投加10 mL·kg-1降解混菌的生物堆处理可以应用于PAHs污染场地土壤修复。

