一种基于R语言的大孔吸附树脂预测模型的构建
孙艳艳,刘宝乾,刘建飞,魏鉴腾*,邸多隆*
(1.甘肃中医药大学 药学院,甘肃 兰州 730000;2.中国科学院兰州化学物理研究所 中国科学院西北特色 植物资源化学重点实验室和甘肃省天然药物重点实验室,甘肃 兰州 730000)
多糖是中药中重要的一类有效成分,在免疫调节、抗氧化、抗病毒、抗衰老、抗肿瘤、降血糖、降血脂等[1]方面展示出显著而独特的生理、药理活性,已成为中药研究的重要方向之一。多糖的分离纯化是开展多糖研究与开发的重要基础,目前用于大分子分离纯化的色谱填料和层析介质主要是天然多糖类和高分子聚合物类。基于吸附和解吸附分离纯化机制的大孔吸附树脂(Macroporous adsorption resin,MAR)是一类重要的高分子聚合物分离材料,已在分离纯化中药中小分子有效成分方面取得重要进展,但在分离纯化中药多糖方面尚处于起步阶段。近年来,MAR在多糖分离中的研究与应用逐渐引起国内外研究者的关注。
MAR是一种不含交换基团、具有孔结构的有机高聚物,具有不溶于酸、碱及各种有机溶剂,比表面积大、吸附容量大、选择性好、吸附速度快、解吸条件温和、再生处理方便、使用周期长、节省费用等诸多优点[2-4]。孙伟等[5]采用MAR技术富集纯化桑白皮中的多糖成分,桑白皮多糖的纯度提高了4.6倍,为桑白皮多糖的工业化生产提供了技术参考。Yang等[6]采用MAR技术分离纯化南瓜渣中的多糖成分,色素和蛋白质的吸附率分别为84.3%和75.9%,多糖的回收率为84.7%,为高效利用南瓜多糖资源提供了理论依据。Hu等[7]采用MAR技术和DEAE-52纤维素联用技术从苔草中分离出单一的酸性多糖和中性多糖。Liang等[8]利用AB-8树脂、Sephadex G75凝胶和Sephadex G200凝胶联用技术从石斛中分离纯化出2种单一多糖,并表征了多糖的结构特征。MAR技术由于其独特的吸附性质和物理化学性质,已在分离纯化中药有效成分方面被广泛应用,但由于在MAR与目标分子的构效关系及其分离规律的基础研究方面比较薄弱,导致无法在理论指导下进行MAR精准选择。面对种类繁多的MAR,在预测和筛选对多糖具有最佳分离效能的MAR时,工作量巨大,且往往出现漏筛、误筛。
R语言由Robert Gentleman和Ross Ihaka在20世纪90年代开发而来,其作为一种开源软件,带有丰富的工具包[9],因统计与计算功能全面而深受国内外研究者的青睐,已广泛应用于经济学、医学、地球科学及农学等研究领域的数据挖掘分析[10-11]。本研究采用R语言构建MAR参数(如孔隙率、比表面积、孔容、孔径)、葡聚糖与吸附量之间的多源信息模型,利用多源信息模型预测和筛选对不同分子量多糖具有最佳吸附性能的MAR,以期为中药多糖的分离纯化提供理论支撑。经文献检索,未见相同文献报道。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1260液相色谱仪(美国Agilent Technologies),包括:G1312A恒流泵、2200蒸发光检测器、G1328B手动进样器和Agilent Chemstation software工作站;TSKgel G3000PWxl色谱柱(7.8 mm i.d.×30 cm,7 μm);KQ-250DE型数控超声清洗机(昆山超声仪器有限公司);BSA224S-CW型万分之一电子分析天平(北京赛多利斯仪器系统有限公司);DHG-9140A型电热恒温鼓风干燥箱、THZ-320台式恒温振荡器(上海精宏实验设备有限公司)。
无水乙醇(分析纯,利安隆博华医药化学有限公司);纯净水(杭州娃哈哈集团有限公司);葡聚糖系列对照品(分子量分别为1 000、5 000、10 000、40 000和100 000,上海麦克林生化科技有限公司);枸杞多糖(由中科院兰州化学物理研究所中科院西北特色植物资源化学重点实验室制备、提供);LX-1180、LX-20、LX-T81、LX-T19和D101型(西安蓝晓科技新材料股份有限公司),主要性能参数(由西安蓝晓科技新材料股份有限公司提供)见表1。

表1 MAR的主要性能参数Table 1 Main performance parameters of MAR
1.2 对照品溶液的制备
分别称取不同规格的葡聚糖对照品(分子量为1 000、5 000、10 000、40 000和100 000)40 mg,加水溶解并定容至10 mL,摇匀,即得质量浓度为4 mg·mL-1的系列对照品储备溶液,备用。
1.3 色谱条件
TSKgel G3000PWxl色谱柱(7.8 mm i.d.×30 cm,7 μm);流动相:100%水;流速:1 mL·min-1;检测器:蒸发光检测器;检测温度:80 ℃;进样量:20 μL。
1.4 方法学考察
1.4.1 线性关系分别称取不同规格的葡聚糖对照品(分子量为1 000、5 000、10 000、40 000和100 000)80 mg,加水溶解并定容至10 mL,即得质量浓度为8 mg·mL-1的对照品储备液,各加水稀释制备成0.125、0.25、0.5、1、2、4、8 mg·mL-1的葡聚糖对照品溶液,按照“1.3”色谱条件进行测定。以不同分子量葡聚糖的质量浓度为横坐标(x),峰面积为纵坐标(y)绘制标准曲线,得到上述5种葡聚糖的回归方程和线性范围(见表2)。由表2可知,同一种分子量的葡聚糖在0.125~8 mg·mL-1范围内,峰面积与葡聚糖的质量浓度呈线性关系。

表2 不同分子量葡聚糖的回归方程及线性范围Table 2 Regression equations and linear ranges of different molecular weight glucans
1.4.2 精密度实验取“1.2”制备的对照品溶液,按照“1.3”色谱条件测定多糖,重复进样6次,色谱峰面积的相对标准偏差(RSD)为0.95%~4.1%,表明仪器精密度良好。

表3 MAR静态吸附实验结果Table 3 Experimental results of MAR static adsorption
1.4.3 稳定性实验取“1.2”制备的对照品溶液,按照“1.3”色谱条件分别于0、3、6、9、12、24 h进样检测,色谱峰面积的RSD为3.2%~4.8%,表明不同分子量的葡聚糖溶液在24 h内稳定。
1.4.4 重复性实验精密称取不同分子量的葡聚糖40 mg各6份,按照“1.2”方法制备样品溶液6份,按照“1.3”色谱条件测定多糖,色谱峰面积的RSD为3.1%~4.8%,表明方法重复性良好。
1.5 吸附实验
1.5.1 静态吸附实验称取5种MAR(LX-1180、LX-20、LX-T81、LX-T19和D101) 各0.5 g,分别置于具塞锥形瓶中,加入4 mg·mL-1的多糖溶液40 mL,于30 ℃下恒温振荡吸附24 h后,测定滤液中的多糖,按公式(1)计算吸附量[12-14]。
(1)
式中,Q为吸附量(mg·g-1),C0为吸附前多糖的质量浓度(mg·mL-1),C1为吸附残液中多糖的质量浓度(mg·mL-1),V1为提取液体积(mL),W为树脂质量(g)。按照上式计算得到5种MAR对不同分子量葡聚糖的吸附量见表3。
1.5.2 吸附预测模型建立采用“1.5.1”静态吸附实验数据,以葡聚糖的分子量/孔隙率、分子量/比表面积、分子量/孔容、分子量/孔径为自变量参数,吸附量为因变量参数,利用Rstudio软件建立回归预测模型,并进行拟合性检验。
2 结果与讨论
2.1 葡聚糖含量的测定
葡聚糖含量的测定方法多采用比色法[15-16]。本研究建立了高效液相色谱(HPLC)测定葡聚糖含量的方法,经“1.4”方法学考察,表明该方法准确、可靠。不同分子量葡聚糖的HPLC色谱图见图1,可知分子量为1 000、5 000、10 000、40 000和100 000葡聚糖在色谱中的保留时间分别为9.68、8.78、8.49、7.52、6.73 min,说明葡聚糖分子量越小,越容易进入色谱填料的孔道,洗脱时所经过的路径越长,保留时间较长。不同分子量葡聚糖保留时间的规律符合凝胶色谱分离机理。


2.2 MAR主要性能参数与吸附量的相关性分析
影响多糖吸附效果的因素主要包括多糖分子量和MAR的孔隙率、比表面积、孔容、孔径,分别考察了分子量/孔隙率、分子量/比表面积、分子量/孔容、分子量/孔径对多糖吸附量的影响。如图2所示,随着上述4种比值的不断增加,不同MAR对葡聚糖的吸附量均表现为先增加后降低。推测是由于随着分子量的增加,葡聚糖无法进入MAR内部,导致吸附量下降。
2.3 多源信息融合预测模型的建立
2.3.1 数据处理分子量/孔隙率、分子量/比表面积、分子量/孔容、分子量/孔径和吸附量结果见表4。对采集的数据取自然对数,其特点归纳如下:数据集包含25组数据,每组数据包括4个自变量和1个因变量,其中因变量“吸附量”受其他4个自变量的影响。
2.3.2 模型架构中药多糖具有修复肝损伤、降血糖、抗凝血、抗肿瘤、抗氧化、抗病毒和免疫调节等多种生物活性,不同分子量范围的多糖,生物活性有所差异[17]。本研究以25组数据中的变量为基础,通过考察因变量受不同自变量之间的交互作用,构建MAR吸附多糖的多源信息融合模型。利用该模型预测MAR对中药多糖的吸附作用,可避免多糖分离过程中树脂选择的盲目性。



表4 MAR数据分析Table 4 Data analysis of macroporous adsorption resin
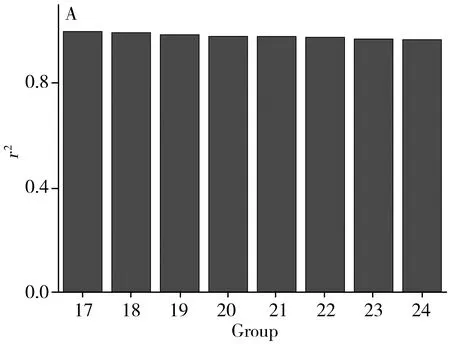
2.3.3 训练集与测试集划分利用Rstudio软件,采取随机不放回抽样模式,从25组数据中依次抽取17、18、19、20、21、22、23、24组数据作为训练集建立模型,其余数据作为测试集进行验证。随机重复25次,计算不同模型的r2和均方根误差(RMSE)(图3)。综合考虑r2和RMSE值,选取23组数据作为训练集所建立的模型拟合度和预测能力较好。
2.3.4 利用训练集建立模型利用Rstudio软件,采取随机不放回抽样模式,从25组数据中抽取23组数据作为训练集建立模型,依次重复20次,计算每次模型的拟合方程参数(见表5)。综合考虑P值和r2,选择表5中序号6的拟合方程作为预测模型方程(式2),其r2为0.901 2,P值为0.000 782,RMSE为19.89。
Y=5.94X1-25.15X2+6.93X3+17.91X4+5.03X1X2-23.13X1X3+25.68X2X3+8.81X1X4-15.55X2X4+11.1X3X4-18.89X1X2X3+1.97X1X2X4-10.93X1X3X4+14.23X2X3X4-6.96X1X2X3X4-8.04(r2=0.901 2)
(2)
式中,Y为MAR对多糖的吸附量(mg·g-1);X1、X2、X3、X4分别为多糖分子量与MAR孔隙率、比表面积、孔容和孔径的比值,并取自然对数。

表5 模型方程的参数Table 5 Parameters of model equation
2.3.5 利用测试集验证模型利用Rstudio软件以2组测试集数据对上述预测模型进行验证,模型预测吸附量分别为36、97.3 mg·g-1,RMSE值为19.89,测试集的吸附量数据分别为7.85、96.85 mg·g-1,表明模型预测效果准确。
2.3.6 模型验证实验枸杞多糖是枸杞中发挥功效的主要物质基础之一[18]。枸杞多糖LBP-009是本实验室筛选出具有修复和预防药物性肝损伤的枸杞多糖部位,根据枸杞多糖LBP-009的分子量,利用多源信息模型预测MAR对枸杞多糖的吸附效果。结果表明,LX-T19、LX-T81、LX-20、LX-1180和D101型树脂对枸杞多糖的吸附量分别为114.13、112.03、117.40、98.27、72.18 mg·g-1,其中吸附效果最好的MAR为LX-20。利用MAR静态吸附实验进行验证,发现LX-20型MAR对枸杞多糖LBP-009的吸附量为111.23 mg·g-1,其结果与预测值基本吻合。由此可见,利用Rstudio软件建立的多源信息融合模型是准确可靠的。
3 结 论
本研究以葡聚糖分子量与MAR的孔隙率、比表面积、孔容、孔径比值为变量函数,利用Rstudio软件构建MAR对中药多糖吸附量的多源信息预测模型,实现了从种类繁多的MAR中快速预测和筛选对多糖具有最佳分离效能的MAR。模型验证实验表明,所建立的预测模型准确性较高,可快速预测和筛选对中药多糖具有最佳吸附效果的MAR类型,显著地提高了工作效率,为MAR分离纯化中药多糖的研究提供了新思路。但该预测模型也存在一定的局限性:首先,本研究使用的目标分子和MAR样本量较少,可能造成预测模型的偏差。其次,本研究采集数据时,只考虑MAR对中药多糖的静态吸附实验,未结合静态解吸附实验和动态吸附/解吸附实验结果,可能导致预测模型的局限性。同时,MAR分离多糖的影响因素十分复杂,本文考察的影响因素还不够全面。
——谷物β-葡聚糖的最新研究进展

