RPUSD1基因在骨肉瘤中的表达及其预后价值分析△
李纯璞,张立清,侯存强,李红岩b,于 鑫,张开刚,郭冬梅c*
(1.泰安市中心医院a:骨科;b:麻醉科;c:血液内科;2.泰安市荣军医院;3解放军第960医院泰安院区;4.泰安市中医医院,泰安 271000)
骨肉瘤起源于间充质组织,是儿童和青少年中最常见的原发性恶性骨肿瘤[1,2]。骨肉瘤恶性度高,早期即可发生肺转移,危害性大。当前骨肉瘤的主要治疗方法包括手术、化学疗法和放射治疗[3]。随着治疗的不断改进,骨肉瘤患者5年生存率达到60%~70%,但对于复发、转移和化疗耐药的患者,生存时间明显缩短[4]。已有学者研究发现许多与骨肉瘤进展密切相关的基因,包括 CDC2[5],ANRIL[6],HER2和CD44[7]。然而,骨肉瘤发生和发展的分子机制仍不清楚[8-10]。RPUSD1(RNA pseudouridylate synthase domain containing 1)是一个蛋白质编码基因,目前研究显示其在多种肿瘤中发挥重要作用[11-13]。然而,RPUSD1在骨肉瘤发生发展中的作用及其潜在的分子机制尚不清楚。本研究通过Gene Expression Omnibus(GEO)公共数据库,利用生物信息学的方法研究骨肉瘤中基因表达谱芯片数据[14],分析RPUSD1在骨肉瘤中的表达及对预后的影响,并采用基因集富集分析(gene set enrichment analysis,GSEA)和基因集变异分析(gene set variation analysis,GSVA)方法探索RPUSD1 可能参与的肿瘤相关生物学通路[15,16],为明确RPUSD1在骨肉瘤中预后预测价值及在骨肉瘤发生发展中的作用奠定基础。
1 材料与方法
1.1 芯片数据
利用美国国立生物技术信息中心(NCBI)的GEO 芯片数据库 (http://www.ncbi.nlm.nih.gov/geo/),以“osteosarcoma,Homo”为关键词搜索相关芯片。筛选后,获取3组转录组基因芯片数据:基于GPL13376芯片分析平台(Illumina HumanWG-6 v2.0 expression beadchip)的 GSE28424数据集、基于GPL10295芯片分析平台(Illumina HumanWG-6 v2.0 expression beadchip)的 GSE42352与 GSE21257数据集。GSE28424包括19例骨肉瘤细胞样本和4例正常对照骨样本。GSE42352包括19例骨肉瘤细胞样本和12例对照间充质干细胞样本。GSE21257包括53例具有临床特征及相关病理学参数的骨肉瘤样本。
1.2 数据处理及相关临床病理资料研究
采用各数据集已标准化的表达矩阵数据,基于R语言软件(3.6.3版本)进行统计学分析。在GSE28424和GSE42352数据集中,采用Wilcoxon rank-sum检验分析RPUSD1基因在骨肉瘤与对照组中的差异表达。在GSE21257数据集中,剔除临床相关病理学参数缺失的样本后,根据RPUSD1的表达量,按照中位值将数据集分为高表达组和低表达组,采用Kaplan-Meier方法进行生存分析。随后利用单因素和多因素Cox风险回归方法对临床特征及相关病理学参数进行预后分析。P<0.05认为差异有统计学意义。
1.3 GSEA与GSVA分析
采用GSEA软件(https://software.broadinstitute.org/gsea/index.jsp)进行富集分析。在GSE21257数据集中,根据RPUSD1表达水平将骨肉瘤样本分为高表达组和低表达组。从MsigDB数据库获得生物信号基因集作为参照基因集,通过GSEA进行信号通路富集分析。GSEA分析不同RPUSD1表达组骨肉瘤的信号通路富集情况。将P<0.05的基因集作为显著富集基因集。并通过R软件GSVA包分析高、低表达组富集信号通路的变异情况。
2 结 果
2.1 骨肉瘤细胞和正常细胞中RPUSD1的表达情况
首先比较RPUSD1在骨肉瘤细胞和对照细胞中的表达情况。在GSE28424中(图1a),骨肉瘤细胞样本(19例)RPUSD1的表达水平明显高于正常骨样本(4例)(P<0.05)。进一步在GSE42352中进行验证(图1b),作者发现骨肉瘤细胞样本(19例)RPUSD1的表达水平明显高于对照间充质干细胞(12例)(P<0.05)。结果提示,RPUSD1在骨肉瘤细胞中显著高表达。

图1 RPUSD1 mRNA在对照细胞和骨肉瘤细胞中的表达 1a:GSE28424数据集(正常骨样本和骨肉瘤细胞样本) 1b:GSE42352数据集(对照间充质干细胞和骨肉瘤细胞样本)
2.2 RPUSD1表达与骨肉瘤临床Huvos分级的关系
Huvos肿瘤坏死率分级系统包括4个等级。I级:很少或没有坏死的证据;II级:坏死50%~90%;III级:坏死在90%~99%之间;IV级:100%坏死。Huvos分级广泛用于骨肉瘤的化疗评估。根据化疗后肿瘤坏死的百分比,患者可归类为不良反应者或良好反应者。该分级指标是预测长期预后的重要参数。I级和II级被认为化疗疗效差,而III级和IV级被认为是治疗反应良好。在GSE21257数据集中(表1),作者进行RPUSD1表达水平与Huvos分级的相关性分析。结果发现,RPUSD1表达水平随着Huvos分级升高而降低(P<0.05)(图2)。说明化疗后肿瘤坏死组织率升高时,RPUSD1表达水平下降。提示RPUSD1可能成为预测骨肉瘤化疗疗效的指标。
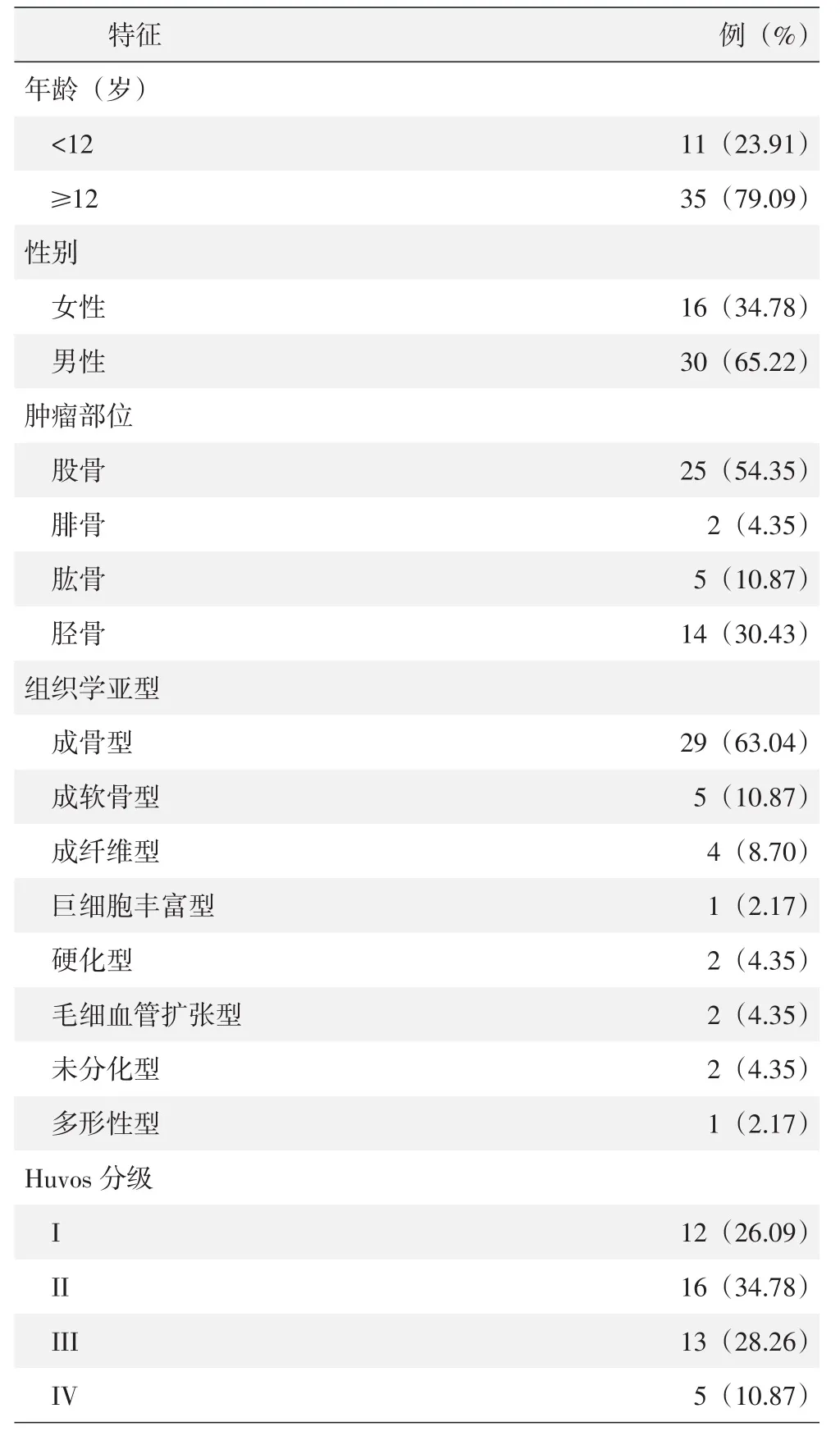
表1 GSE21257数据集骨肉瘤患者的临床特点
2.3 RPUSD1表达与骨肉瘤预后的相关性分析
在GSE21257中,对46名具有完整临床信息骨肉瘤患者进行分析。中位随访时间为71.2个月。生存分析结果显示RPUSD1高表达患者的总体生存率明显低于RPUSD1低表达组(P=0.011)。对各临床特征进行单因素Cox分析,发现RPUSD1高表达组患者总体生存率较低(P=0.003,HR=23.27,95%CI=3.02~179.49)。Huvos高等级患者总体生存率较高(P=0.025,HR=0.52、95%CI=0.30~0.92)。多因素分析结果显示 RPUSD1表达 (P=0.033,HR=4.41,95%CI=1.12~17.28) 和 Huvos分级 (P=0.020,HR=0.51,95%CI=0.29~0.90)分别是患者预后的独立预测因子。以上结果表明,RPUSD1是骨肉瘤生存的独立预后生物标志物。
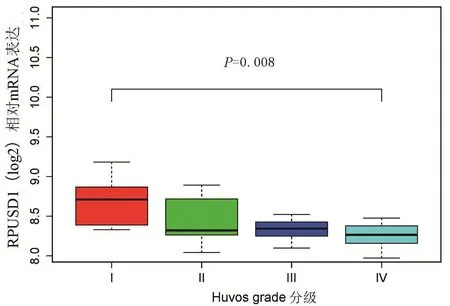
图2 在GSE21257中,骨肉瘤不同Huvos病理分级中RPUSD1的表达情况
2.4 RPUSD1相关的通路富集与变异分析
利用GSEA分析RPUSD1调控的相关信号通路。结果显示:在RPUSD1高表达的样本中,不饱和脂肪酸生物合成、氧化磷酸化、蛋白质组、嘧啶代谢以及RNA聚合酶信号通路高度富集(图3)。说明这些通路与RPUSD1高表达密切相关。随后,通过GSVA进一步证实氧化磷酸化、蛋白质组、嘧啶代谢以及RNA聚合酶通路在RPUSD1不同表达组存在显著差异(图4)。以上结果说明,RPUSD1通过影响氧化磷酸化、蛋白质组、嘧啶代谢以及RNA聚合酶通路,进而促进骨肉瘤的进展。
3 讨论
目前,骨肉瘤综合治疗包括假体置换手术辅以化学疗法,但患者的预后并不满意[17]。骨肉瘤的组织学异质性、遗传不稳定性、局部侵袭性强以及缺乏特定的生物标志物给骨肉瘤临床治疗带来很多困难[18]。RPUSD1在多种肿瘤中发挥重要作用,但在骨肉瘤发展中的扮演的角色并不清楚[10]。本研究通过生物信息学综合分析发现,RPUSD1在骨肉瘤中存在特异高表达,并且与预后不良相关。骨肉瘤中RPUSD1表达水平与临床病理Huvos分级显著相关。多因素分析表明RPUSD1是骨肉瘤预后的独立生物标志物。
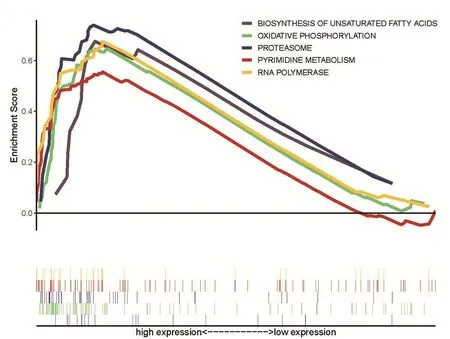
图3 GSEA基因集富集分析显示RPUSD1调控的信号通路

图4 GSVA基因集变异分析显示RPUSD1调控的信号通路
RPUSD1是一个蛋白质编码基因,其相关的疾病包括痣样基底细胞癌(NBCCS)[11]、恶性星形胶质细胞瘤[12]以及再生障碍性贫血[13]等。NBCCS综合征是一种罕见的常染色体显性遗传病,并具有复杂的遗传基础。全基因组关联研究发现RPUSD1是NBCCS潜在致病基因。在结直肠癌肝转移术后复发风险模型的研究中,包含RPUSD1基因的预后模型的敏感性为81.8%,特异性为66.7%[19]。Goh TS等使用高维Cox回归分析发现,高表达RPUSD1骨肉瘤患者预后不佳[20]。未来需要收集更多临床标本进行功能分析,以进一步阐明及验证RPUSD1的生物学功能。
作者发现RPUSD1通过影响氧化磷酸化、蛋白质组、嘧啶代谢以及RNA聚合酶通路,促进骨肉瘤的进展。这4个信号通路在多种肿瘤发生发展中发挥重要作用。氧化磷酸化在细胞能量代谢中发挥核心作用。Rao等[21]指出氧化磷酸化在肺癌进展中起关键作用。Shi等[22]证实新型氧化磷酸化抑制剂可抑制人类胶质母细胞瘤细胞的生长。泛素-蛋白酶体系统(UPS)在管理多种蛋白质的活动中具有核心功能,可抑制 UPS,是一种新的恶性肿瘤治疗方法[23]。RNA聚合酶指导合成核糖体,癌细胞可通过大量增加核糖体来驱动细胞代谢的上调[24]。嘧啶代谢是肿瘤细胞进行DNA复制重要的代谢过程,其与肿瘤发生发展密不可分,亦是有价值的诊断和治疗靶标[25,26]。本研究提示,干扰以上4个信号通路可能达到治疗骨肉瘤的目的。
综上所述,通过综合分析公共数据库中骨肉瘤相关数据,本研究发现RPUSD1是骨肉瘤的预后生物标志物,今后可探索其调控肿瘤进展的信号通路,进而为寻找骨肉瘤治疗靶点提供科学依据。

