胶红酵母分离鉴定及其对凡纳滨对虾幼体存活和变态的影响
宁为民,温崇庆,黄雪敏,柳敬旺,陈杰世,吕杰伟,梁华芳,薛 明
(广东海洋大学 水产学院,广东 湛江 524088 )
凡纳滨对虾(Litopenaeusvannamei)自引进我国以来创造了极大的经济价值。随着养殖规模的不断扩大,优质苗种的供应至关重要。凡纳滨对虾幼体培育期间极少甚至零换水,育苗水体环境相对封闭,加之饵料残骸、排泄和代谢废物积聚,易诱导水质恶化和菌群失衡,造成病害暴发和幼体大量死亡[1-2]。近年来利用有益微生物开展对虾微生态育苗的研究和应用日益增多,并取得了一定成效[3]。但常用水产益生菌如芽孢杆菌、光合细菌、乳酸菌和酵母菌等大多源自陆生环境,对海水的适应能力较差,作用效果短。
海洋红酵母泛指能适应海水环境并带粉红、红色或橙红色的酵母菌,大多属担子菌门、微球黑粉菌纲、锁掷酵母目、锁掷酵母科、红酵母属(Rhodotorula)。红冬孢酵母(Rhodosporidium)、锁掷孢酵母(Sporidiobolus)和囊担菌(Cystobasidium)等属中的某些种与红酵母属种类特征相近[4-5],可视为广义上的红酵母。海洋红酵母富含蛋白质、糖原和维生素等营养物质,以及不饱和脂肪酸、类胡萝卜素和葡聚糖等多种活性成分,悬浮性好,特别适宜作为海产动物幼体的开口饵料和整个幼体期的补充性饵料[6]。海洋红酵母还具有培养简单、培养周期短、适应能力强、成本低等优点,是一类较理想的水产益生菌[6-7]。海洋红酵母作为益生菌提高对虾生长、存活和免疫等方面的研究已有一些报道[8-13],商品化的海洋红酵母制剂在对虾育苗和养成期间也有一定程度的使用。但海洋红酵母在对虾幼体培育方面的研究报道较少[14],而投菌量和投菌频次对对虾幼体的影响尚未见报道。
笔者在从海产动物肠道分离鉴定红酵母的基础上,通过凡纳滨对虾幼体培育试验筛选最适菌株,进而研究目标菌投菌时间、剂量和频次对幼体存活和变态的影响,为海洋红酵母在对虾幼体培育中的合理应用提供科学依据。
1 材料与方法
1.1 分离用海产动物
凡纳滨对虾、斑节对虾(Penaeusmonodon)、翡翠贻贝(Pernaviridis)、华贵类栉孔扇贝(Mimachlamysnobilis)和褐蓝子鱼(Siganusfuscescens)等,均为湛江地区海鲜市场购买的鲜活海产品。
1.2 海洋红酵母的分离
将待分离动物体表洗净并按种类分组,75%酒精体表消毒后无菌操作取出各组动物肠道分别匀浆,各组匀浆液分别划线或稀释涂布于含有0.05%氯霉素的YPD培养基(葡萄糖2%,蛋白胨2%,酵母提取物1%,琼脂粉1.8%,陈海水配制),30 ℃培养5 d,每日观察,并挑取带有红色或橙红色的酵母单菌落于YPD平板划线纯化,纯化后转接到YPD斜面,4 ℃保存备用。
纯化的酵母菌再以YPD平板划线,30 ℃培养3 d,观察和记录菌落特征,期间挑取少量菌体与0.1%碱性美兰染液混匀,置于显微镜下观测细胞个体形态特征,并通过测微尺对每株菌10个以上细胞测量个体大小,以宽(范围)×长(范围)表示酵母菌大小。
1.3 碳源利用
参考文献[15]的方法,取各酵母菌1 mL新鲜细胞悬液(约107cfu/mL)分别与冷却至约42 ℃的碳源同化基础培养基混匀,凝固后用无菌小勺依次加入葡萄糖、乳糖、棉子糖、L-阿拉伯糖、鼠李糖、淀粉、蔗糖和肌醇作为碳源,30 ℃培养4 d。观察记录碳源周围是否出现生长圈。结合碳源利用谱和形态特征对分离酵母菌株进行分型。
1.4 酵母菌的分子鉴定
以酵母基因组DNA提取试剂盒(天根生化,DP307),按操作说明提取代表菌株的基因组DNA。参考Kopsahelis等方法[16],以基因组DNA为模板,使用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATA TGC-3′)扩增5.8S-ITS基因;使用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′- GGTCCGTGTTTCAAGACGG-3′)扩增26S rRNA基因。PCR反应体系:10×PCR buffer 5 μL;dNTPs(2.5 mmol/L)1 μL;正反向引物(20 pmol/μL)各0.5 μL;基因组DNA 5 μL(10~100 ng);Taq DNA聚合酶 0.2 μL(1 U/μL);补充ddH2O至体积为50 μL。PCR扩增程序:95 ℃ 5 min;95 ℃ 40 s,55 ℃ 40 s,72 ℃ 1 min,34个循环;72 ℃ 10 min。
将5.8S-ITS和26S rRNA基因扩增产物委托北京六合华大基因公司分别以ITS 1和NL1引物通过ABI 3730XL测序仪测序。将测得的序列通过美国国立生物技术信息中心(http:∥www.ncbi.nlm.nih.gov/)BLAST程序在GenBank数据库中进行核酸序列比对分析,进行菌种鉴定。调取代表菌株及其最相似参考菌株与模式菌株序列,通过MEGA 5.0软件采用邻接法进行聚类分析并构建系统进化树。
1.5 筛选试验
分离纯化后的代表菌株(RY1~RY6),分别通过YPD平板划线,30 ℃培养2 d后用无菌海水从平板上洗下细胞,3000 r/min 离心10 min,弃上清液,再用无菌海水漂洗和离心一次,悬于海水中。通过血球计数板计数酵母菌液含量,并调整各菌株使其母液细胞含量保持一致,即5×108个/mL,4 ℃存放,3 d内使用。
试验用凡纳滨对虾幼体取自湛江东海岛某对虾种苗场,由同池同批次受精卵孵化无特定病原的无节Ⅲ期幼体。幼体培育试验用海水为天然海水经砂滤后蓄于同一池,放幼体前加入体积分数20×10-6的甲醛消毒1 d,再曝气处理1 d。采用16 L塑料桶,每桶加海水(盐度29.5,pH 7.9)10 L和无节Ⅲ期幼体2000只,共设6个处理组和1个对照组,每组3个平行,处理组根据所加酵母菌设为RY1~RY6组。当幼体从无节Ⅵ期刚开始向溞状Ⅰ期变态时(90%以上幼体仍为无节Ⅵ期阶段),投喂螺旋藻粉(淯晖公司)和虾片(英联公司)作为饵料,同时处理组各桶分别加入对应的酵母细胞母液2 mL,即加入水体后的初始酵母菌,密度均为105个/mL,此后每隔12 h补加等密度的酵母细胞,共补加2次,对照组始终不投菌。试验期间不换水,水温保持在(31.5±1.0) ℃。各组按同样方式管理和饲喂,每隔4 h投饵一次。但当处理组补加酵母时,均停止投料,即补加酵母前后间隔8 h再投料,人为对幼体造成一定的间歇饥饿胁迫。定时观察幼体存活情况,当幼体完全变为溞状Ⅱ期时,计数存活幼体,统计存活率。
1.6 菌株RY4投菌方式试验
参照1.5方法,制备菌株RY4细胞母液(109个/mL),每桶加海水(盐度29.2,pH 8.05)10 L和无节幼体Ⅲ期凡纳滨对虾幼体2400只。试验共设5个处理组和1个对照组,每组设4个平行,各处理组编号、单次投菌量、投菌次数和投菌时的幼体期见表1。高剂量和低剂量多次投菌组即MH和ML组的两次投菌间隔时间为24 h。

表1 海洋红酵母RY4在凡纳滨对虾幼体培育时的投菌方式
参照1.5方法,试验期间不换水,水温保持在(31.5±1.0) ℃。幼体从无节Ⅵ期开始向溞状Ⅰ期变态时,每隔4 h投喂虾片和藻粉,各组投喂量保持一致。提前单次高剂量组在幼体无节Ⅳ期时就较其他组提前加入菌株RY4。其他处理组在初次投喂饵料(无节Ⅵ期)的同时开始加入菌株RY4。幼体发育至溞状Ⅰ~Ⅱ期和溞状Ⅱ~Ⅲ期时,分别从每桶分3次随机各取250 mL水样,结合肉眼和解剖镜观察计数存活幼体及其发育阶段,统计存活率和变态率。溞状Ⅱ~Ⅲ期后继续投喂虾片和藻粉,尚未开始投喂卤虫(Artemiasalina)幼体或其他饵料,造成营养受限胁迫。2 d后统计各组存活率,同时从各桶取水样,分别以水样原液及其10倍稀释液0.1 mL涂布于含0.05%氯霉素的YPD平板,每个梯度3个平板,30 ℃培养5 d,计算水体酵母菌含量,并通过Pearson积矩法分析其与幼体存活率的相关性。
1.7 数据分析
试验数据以平均值±标准差表示,对各组幼体存活和变态率进行反正弦平方根转换,采用SPSS 17.0软件进行单因素方差分析,若差异达显著水平时以Duncan′s多重比较进行不同处理间的显著性分析,检验标准α=0.05或0.01。
2 结果与分析
2.1 海洋红酵母的分离与形态特征
从不同海产动物肠道中共分离得到19株红酵母,根据菌落和细胞形态特征并结合碳源利用谱将其划分为6个类型。各类型菌落特征、细胞大小、分离源及代表菌株见表2,其中类型1、2、6分别只从翡翠贻贝、斑节对虾和褐蓝子鱼肠道中分离;而类型3、4、5则从2种或2种以上动物肠道中分离到。6个类型红酵母在YPD培养基上的菌落均呈圆形,凸起,边缘整齐,不透明,除类型6菌落直径较小外,其余类型菌落直径大小相近;类型2、3、5的菌落表面均为光滑或较光滑,橙红色;类型4的菌落表面略显干燥,粉红色;类型1 和类型6菌落分别呈红色和淡橙红色,两者细胞大小较其他类型相对偏小。
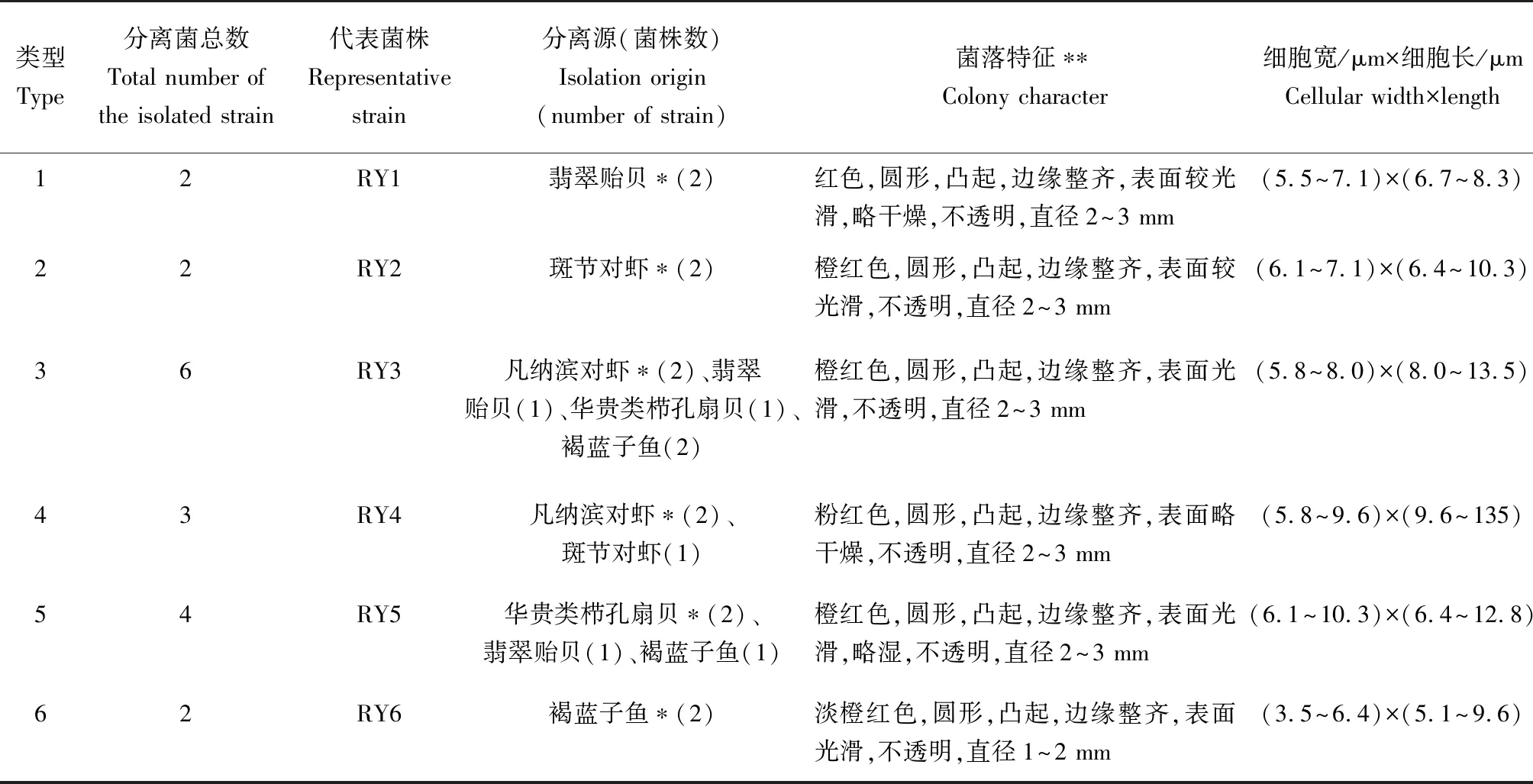
表2 6个类型海洋红酵母菌分离来源及形态特征
2.2 碳源利用结果
6个类型酵母菌对8种碳源的同化测试结果见表3。所有19株菌均能利用葡萄糖和蔗糖,但对肌醇、鼠李糖、乳糖和淀粉均不能利用。类型2和3菌株碳源谱一致,均能利用棉子糖;类型4和5菌株碳源谱一致,对L-阿拉伯糖也能利用;而类型1和6酵母无法利用所测其他糖类。
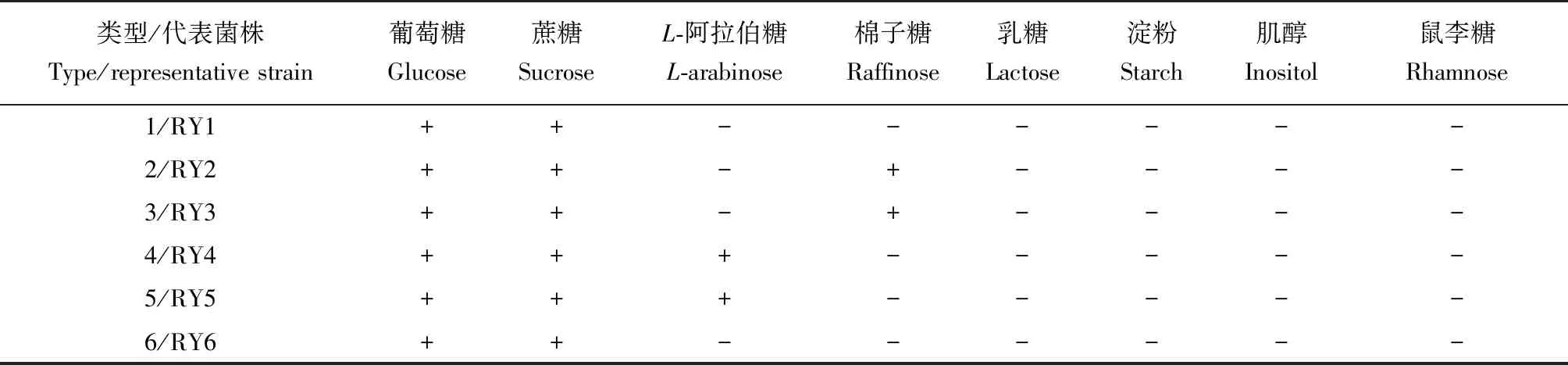
表3 海洋红酵母分离菌株的碳源谱
2.3 酵母菌分子鉴定
6株代表菌的5.8S-ITS和26S rRNA基因测序后,美国国立生物技术信息中心数据库比对分析显示菌株RY2~RY5均与胶红酵母(R.mucilaginosa)同源性最高,与其模式菌株的ITS和26S rRNA基因序列相似度均超99%。菌株RY1和菌株RY6分别与双倒卵形红酵母(R.diobovata)和斯鲁菲亚囊担菌(Cystobasidiumslooffiae)的同源性最高,菌株RY1与双倒卵形红酵母模式菌株的ITS和26S rRNA基因序列相似性分别为98.81%和99.65%;菌株RY6与斯鲁菲亚囊担菌模式菌株的ITS和26S rRNA基因序列相似性分别为98.03%和99.66%。6株代表菌与参考菌株的5.8S-ITS和26S rRNA基因系统发育树分别见图1、图2。两个基因的发育树均分为3个分支,即RY2~RY5与胶红酵母归为一类分支;RY1和RY6分别与双倒卵形红酵母和斯鲁菲亚囊担菌聚为一类。因此,菌株RY2~RY5均鉴定为胶红酵母,RY1和RY6分别鉴定为双倒卵形红酵母和斯鲁菲亚囊担菌。

图1 基于5.8S-ITS基因序列的海洋红酵母系统发育树Fig.1 Phylogenetic tree of marine red yeasts based on 5.8S-ITS gene sequences GenBank序列登录号显示在括号内;标尺代表10%的序列差异. The sequences accession number in GenBank are shown in parentheses; the bar equals 10% sequence difference.

图2 基于26S rRNA基因序列的海洋红酵母系统发育树Fig.2 Phylogenetic tree of marine red yeasts based on 26S rRNA gene sequences GenBank序列登录号显示在括号内;标尺代表2%的序列差异. The sequence accession number in GenBank are shown in parentheses; the bar equals 2% sequence difference.
2.4 6株红酵母对幼体存活影响
间歇饥饿胁迫条件下,与对照组相比,6株海洋红酵母均能提高凡纳滨对虾溞状Ⅱ期幼体存活率(图3)。除胶红酵母RY6组存活率与对照组差异不显著(P>0.05)外,其余5个菌株组存活率均显著高于对照组(P<0.05)。双倒卵形红酵母RY1、胶红酵母RY2、胶红酵母RY3和胶红酵母RY5组间的存活率虽有一定波动,但差异不显著(P>0.05)。胶红酵母RY4组平均存活率76.11%,高出对照组约40%,同时也显著高于其他5个菌株处理组(P<0.05),效果最佳。因此,确定胶红酵母RY4作为进一步试验的目标菌。
2.5 胶红酵母RY4投菌方式对凡纳滨对虾幼体存活和变态影响
不同投菌方式下,胶红酵母RY4对凡纳滨对虾溞状Ⅰ~Ⅱ期和溞状Ⅱ~Ⅲ期幼体存活影响见图4。溞状Ⅰ~Ⅱ期,各组平均存活率均超过70%,且组间无显著差异(P>0.05);溞状Ⅱ~Ⅲ期,除多次低剂量和提前单次高剂量组存活率显著高于单次高剂量投菌组(P<0.05)外,各组存活率间仍无显著差异(P>0.05)。不同投菌方式下胶红酵母RY4对溞状幼体的变态影响见图5。提前单次高剂量、单次高剂量和多次高剂量投菌组溞状幼体的变态率均普遍高于其他各组。溞状Ⅰ~Ⅱ期阶段同一时间统计时,3个高剂量投菌组溞状Ⅱ期幼体平均变态率均超过80%,多次高剂量组变态率更是高达95%,极显著高于对照组(3.5%)(P<0.01);多次低剂量组变态率也显著高于对照组(P<0.05),但与单次低剂量组间差异不显著(P>0.05);而单次低剂量组与对照组间变态率差异不显著(P>0.05)。溞状Ⅱ~Ⅲ期阶段同一时间统计时,提前单次高剂量、多次高剂量和单次高剂量组溞状Ⅲ期变态率均显著高于对照组和单次低剂量组(P<0.05),其中多次高剂量组的变态率最高(53%);而单次低剂量、多次低剂量和对照组的变态率分别只有1.56%、4.46%和0,3组间差异不显著(P>0.05)。多次低剂量组对溞状幼体变态虽然也表现出一定的促进作用,但效果明显弱于3个高剂量组。可见,不同投菌方式下胶红酵母RY4对溞状幼体存活率总体上无明显影响,但无论在投饵料前如无节Ⅳ期单次高剂量投菌,还是初次投饵料开始(无节Ⅵ期)时单次高剂量或多次高剂量投菌,均能显著促进幼体变态。

图3 6株海洋红酵母对凡纳滨对虾溞状Ⅱ期幼体存活影响Fig.3 Effects of six strains of marine red yeast on survival of zoea Ⅱ of Pacific white shrimp L. vannamei CK.对照组; RY1~RY6.海洋红酵母菌株RY1~RY6处理组编号.柱状图上标不同字母表示差异显著(P<0.05,n=3). CK.control group; strains RY1—RY6.the numbers for treatment groups of marine red strains RY1—RY6. The different letters above the columns indicate significant differences (P<0.05, n=3).

图4 胶红酵母RY4对凡纳滨对虾溞状幼体存活影响Fig.4 Effect of R. mucilaginosa RY4 on survival of zoea larvae of Pacific white shrimp L. vannamei CK.对照组; ML.多次低剂量组; SL.单次低剂量组; SH.单次高剂量组; MH.多次高剂量组; ESH.提前单次高剂量组; 柱状图上标不同字母表示差异显著(P<0.05,n=4); 下同. CK.control group; ML.multiple low-dosage group; SL.single low-dosage group; SH.single high-dosage group; MH.multiple high-dosage group; ESH.early single high-dosage group; the different letters above the column indicate significant differences (P<0.05, n=4); et sequentia.

图5 胶红酵母RY4对凡纳滨对虾溞状幼体变态影响Fig.5 Effect of R. mucilaginosa RY4 on metamorphosis of zoea larvae of Pacific white shrimp L. vannamei
溞状Ⅲ期后,因营养受限胁迫,幼体陆续死亡,2 d后存活幼体均处于糠虾Ⅰ期,但存活率均明显下降(图6)。对照组与单次低剂量组差异不显著(P>0.05),平均存活率分别只有2.1%和3.8%;多次低剂量、单次高剂量、多次高剂量和提前单次高剂量组存活率均显著高于对照组(P<0.05),其中多次低剂量组平均存活率最高(16.67%),但4个处理组间差异不显著(P>0.05)。YPD平板计数糠虾Ⅰ期各组水体酵母菌含量的结果见表4。多次高剂量组酵母菌含量最高,并显著高于其他各组(P<0.05);提前单次高剂量和单次高剂量组次之;多次低剂量组含量较少,但仍显著高于对照组和单次低剂量组(P<0.05);对照组酵母菌含量最低,但与单次低剂量组无显著差异(P>0.05)。此外,YPD计数平板上,除对照组几乎全部以及单次低剂量组大多数菌落为乳黄或白色酵母样菌落外,其他各组平板上的酵母菌落绝大多数为粉红色如胶红酵母RY4样菌落。除单次低剂量组外,其他投菌方式下胶红酵母RY4均能以较高含量继续存活于育苗水体。Pearson相关性分析显示,糠虾Ⅰ期各组幼体存活率与其水体酵母菌含量间呈现强的正相关性(相关系数0.9023)。可见,在营养受限条件下,糠虾Ⅰ期幼体存活率主要取决于水体酵母菌尤其胶红酵母RY4的含量。

图6 胶红酵母RY4对凡纳滨对虾糠虾Ⅰ期幼体存活影响Fig.6 Effect of R. mucilaginosa RY4 on survivial of mysis Ⅰ larvae of Pacific white shrimp L. vannamei

表4 糠虾Ⅰ期育苗水体酵母菌含量
3 讨 论
3.1 对虾育苗用红酵母益生菌的鉴定与筛选
肠道微生物对水产动物营养、免疫和抗病起着重要作用[17-18]。自水产动物肠道中分离和筛选益生菌不仅能更好地适应养殖环境,也更容易定殖于宿主肠道[18-19]。红酵母是海洋酵母的主要类群之一,广泛分布于不同海洋和海产动物体表及肠道等环境[20-22]。虽然形态和生理生化特征常用于酵母菌的分类,但对其准确鉴定需要借助于核酸序列或脂肪酸图谱等信息[20]。笔者自湛江地区几种海产经济动物肠道分离到19株海洋红酵母,先根据形态和碳源利用特征将其分为6个类型,再进一步利用5.8S-ITS和26S rRNA 2种基因序列对代表菌株进行鉴定并获得一致结果。从分型和鉴定结果看,本试验鉴定的3种海洋红酵母中,胶红酵母最为优势,5种海产动物肠道中都能分离到。齐琼等[13,21-22]的研究也显示,从不同海产经济动物肠道中常分离到胶红酵母。
胶红酵母不仅在海产经济动物肠道中普遍存在,也是水产益生菌中报道较多的海洋红酵母[11,13,23],但其在对虾幼体培育中的应用报道很少,且不同菌株间可能存在差异,如本试验鉴定为胶红酵母的菌株,根据形态和碳源利用情况可分为4个类型。另外,尚未见双倒卵形红酵母和斯鲁菲亚囊担菌用作对虾益生菌的报道。笔者将4个类型胶红酵母及双倒卵形红酵母和斯鲁菲亚囊担菌代表菌株直接通过对虾幼体试验,筛选目标菌株,发现所有被测6株菌均能提高溞状Ⅱ期幼体存活率,且5株具有显著效应,其中源自凡纳滨对虾肠道的胶红酵母RY4表现最好。水产益生菌的筛选通常先根据待测菌的抑菌、胞外酶活性及对胃肠液耐受性等特征进行体外测试,再进一步通过饲养试验选择和评价目标菌株的益生效果[24],这种方式适合对大量菌株进行初筛。本试验则以溞状Ⅱ期幼体存活率作为指标,主要基于:(1)凡纳滨对虾溞状Ⅱ期幼体容易出问题而大量死亡,如经常发生的溞Ⅱ综合征[1,25];(2)体外测试结果用于体内试验时常未表现出相应效果,还可能遗漏真正有效的菌株,如有研究发现,蜡样芽孢杆菌(Bacilluscereus)在体外测试时虽不能拮抗病原弧菌,却能有效促进对虾幼体变态和存活[26-27];(3)尚未见海洋红酵母对对虾致病性的报道,通过对分离菌株分型去重后,笔者用于筛选的菌株只有6株。因此笔者直接以溞状Ⅱ期幼体存活效果为筛选依据,能更有效选出目标菌株。
3.2 投菌方式对胶红酵母RY4作用效果影响
水产益生菌的投菌方式与其作用效果密切相关,特别是投菌剂量颇受关注[28]。投菌量不足,密度不够,难以发挥作用,但盲目过量添加不仅增加使用成本,也可能适得其反,对水产动物造成负面影响[28-29]。因此研究和优化水产益生菌使用时的添加剂量、频率以及投菌时间等至关重要。笔者设置高剂量、低剂量,多次、单次和不同幼体期的组合投菌方式来评估胶红酵母RY4对凡纳滨对虾幼体影响。结果表明,投菌剂量直接关乎胶红酵母RY4在水体中的有效含量,最为关键的是,3个高剂量组均显著促进溞状幼体变态和营养受限时糠虾Ⅰ期幼体存活,多次低剂量组也能显著提高糠虾Ⅰ期幼体存活率,但其对幼体变态效应明显弱于高剂量组。其次是投菌时间,在即将开口摄食前(无节Ⅳ期)提前单次高剂量投菌组与无节Ⅵ期开始的多次高剂量投菌组效果相当。可见,适宜阶段投菌不仅可减少投菌频次,也可能有助于益生菌在水体和肠道中的定殖,特别是对虾幼体在无节后期由内源性营养供给转变为外源性营养摄入,开口时幼体肠道处于原生态状态,更易被加入的益生菌定殖,继而对幼体后期的生长发育发挥影响。
4 结 论
笔者自湛江地区海产经济动物肠道分离鉴定了3种海洋红酵母,其中胶红酵母最为优势;饥饿胁迫下胶红酵母RY2~RY5和双倒卵形红酵母RY1均能显著提高凡纳滨对虾幼体存活,其中胶红酵母RY4又明显优于其他菌株;应用胶红酵母RY4培育凡纳滨对虾幼体时,在早期幼体如无节Ⅳ期单次加入高剂量(5×105个/mL),或首次投饵料开始多次加入高剂量,可有效促进幼体变态与营养受限时的存活。
致 谢
感谢湛江市科壹水产养殖有限公司吴勇先生对本次幼体试验提供的帮助;感谢广东海洋大学水产学院刘嘉俊、谭勇宾、余玮旭和陈赐觥等同学对本试验前期工作的协助。

