灵芝提取物对4种人肿瘤细胞生长的抑制作用及机制研究①
刘星含 许玉君 厉 怡 赵树立 侯亚义
(南京大学医学院,南京 210093)
癌症是威胁人类生命健康的主要疾病,目前以西医治疗为主,但其治疗代价较高、副作用较大[1]。我国人口众多,且老龄化逐渐严重,导致癌症的发病率和死亡率上升[2]。尽管近年癌症筛查技术、治疗方式和预后护理等方面取得了重大进展,但癌症及其治疗措施所导致的负效应仍严重威胁人类健康、生活质量和心理健康。
中药在提高老年人群生活质量方面具有不可替代的作用,且随着中医药理研究的深入,其独特的功效不断被发现。灵芝是常用的肿瘤辅助治疗中药,属灵芝科,已被列入《美国草药药典》和《中国药典》。据《中国药典》记载,灵芝可治疗气虚、咳嗽和哮喘[3]。灵芝最具吸引力的特性是其不仅是一种与功能性食品同源的多用途植物药,还具有调节免疫力和抑制肿瘤活性的作用[4]。近年体内和体外研究表明,灵芝具有抗炎、抗氧化、降低血糖及抗溃疡等作用[5]。灵芝可用于肿瘤放化疗的辅助治疗,发挥其增效减毒作用,特别是减少放化疗的不良反应,已被多项临床研究初步证实[6]。灵芝水提物不仅能提高小鼠的免疫功能,还可抑制肿瘤转移[7]。灵芝的主要活性成分为灵芝多糖和灵芝三萜,分别是灵芝极性和非极性提取物的主要成分[8,9]。灵芝三萜类化合物是各类灵芝酸的总称,灵芝酸可影响肿瘤的多种信号通路,导致细胞凋亡和细胞周期改变,但具体作用机制尚未阐明[10]。本研究利用超临界二氧化碳结合乙醇提取灵芝提取物(ganoderma lucidum extracts,GLE),通过高压液相色谱分析表明其主要成分为灵芝酸,以4种人肿瘤细胞为研究对象,从细胞活力、细胞凋亡及周期等方面初步探讨GLE的抗肿瘤活性。
1 材料与方法
1.1材料
1.1.1药物及细胞株 GLE由南京中科集团股份有限公司提供,用乙醇配制为20 mg/ml储存液,4℃保存,实验时用培养基稀释成相应浓度。人非小细胞肺癌细胞株A549、人胃癌细胞株HGC27、人胰腺癌细胞株SW1990及人卵巢癌细胞株SKOV3购于江苏凯基生物有限公司。
1.1.2试剂 CCK8 试剂(南京福麦斯生物技术有限公司);Bax、Bcl2、caspase-3、cleaved caspase-3、PARP及cleaved PARP抗体(CST公司,5023S、15071S、9668S、9664S、9532S、5625S);DMEM培养基(GIBCO公司);McCoy′s 5A培养基(江苏凯基生物有限公司);胎牛血清(四季青公司);细胞凋亡检测试剂盒(东仁化学科技有限公司);细胞周期与细胞凋亡检测试剂盒(上海碧云天)。
1.1.3仪器 CO2培养箱(美国Thermo Forma公司);酶标仪(美国Bio-Tek公司);低温高速离心机(天美科技有限公司)。
1.2方法
1.2.1细胞培养 4种肿瘤细胞株分别用含5%胎牛血清、0.1%双抗的完全培养基、37℃、5% CO2培养,A549、SW1990及SKOV3细胞株采用DMEM培养基培养,HGC27采用McCoy′s 5A培养基培养。
1.2.2细胞活力实验 取对数生长期A549、SW1990、 SKOV3及HGC27细胞分别以2×103、2×103、1×103、2×103个/孔接种于96孔板,贴壁12~24 h。用不同浓度的GLE溶液(0、50、100、150、200 μg/ml)和顺铂(5 μg/ml,作为阳性对照)处理12、24和48 h,弃上清,加入100 μl CCK8工作液1∶10培养1.5 h后,酶标仪检测450 nm处各孔吸光度,计算细胞活力。
1.2.3流式细胞术检测细胞凋亡 4种肿瘤细胞分别以合适浓度接种于60 mm培养皿,用不同浓度的GLE溶液和顺铂(5 μg/ml)处理24、48 h,加入不含EDTA的胰酶消化细胞后离心弃上清,依次加入195 μl结合缓冲液,5 μl FITC标记的Annexin-V和10 μl碘化丙啶染色液室温避光染色20 min,加入200 μl结合缓冲液轻轻振荡混匀,流式细胞术检测。
1.2.4流式细胞术检测细胞周期 不同浓度的GLE和顺铂(5 μg/ml)处理4种肿瘤细胞24 h,收集上清和胰酶消化的细胞,PBS洗1次,加入70%乙醇混匀,4℃固定12~24 h。1 000 g 离心5 min,弃上清,PBS洗1次,加入500 μl碘化丙啶染色液(染色缓冲液、50倍浓度的RNaseA及20倍浓度的碘化丙啶染色液以500∶10∶25配制为碘化丙啶染色液),37℃避光染色30 min,流式细胞术检测。
1.2.5RT-PCR检测GLE对肿瘤细胞mRNA表达的影响 4种肿瘤细胞用不同浓度的GLE和顺铂(5 μg/ml)处理24 h后,TRIzol法提取总RNA,DEPC溶解,-80℃保存。将1 μg RNA、5倍HiScript Ⅱ qRT SuperMix 4 μl及适量水配制为总体积为20 μl的体系,逆转录为cDNA,稀释10倍置于-20℃备用。取适量cDNA进行PCR反应,各反应设3个复孔,40个循环,以GAPDH为内参,测定反应管荧光强度达到阈值时的Ct值,2-ΔΔCt法计算,引物序列见表1。
1.2.6Western blot检测GLE对肿瘤细胞蛋白表达的影响 不同浓度的GLE和顺铂(5 μg/ml)处理4种肿瘤细胞24 h,弃上清,PBS润洗1次,加入适量蛋白裂解液,4℃摇床裂解30 min,刮下细胞转移至1.5 ml EP管。4℃下12 000 r/min离心15 min,取上清。BCA法对蛋白进行定量后加入适量体积蛋白上样缓冲液,99℃加热10 min,-80℃保存待用。SDS-PAGE电泳法分离蛋白,转移至PVDF膜,4℃孵育过夜,洗涤后加入二抗室温孵育2 h,化学发光仪进行定量分析。
1.3统计学处理 采用Graph Pad Prism 6软件进行统计学分析,所有实验均重复3次,采用两样本t检验和单因素方差分析数据,以P<0.05表示差异有统计学意义。
2 结果
2.1GLE抑制肿瘤细胞增殖 不同浓度GLE(0、50、100、150、200 μg/ml)作用于A549、SW1990、SKOV3和HGC27细胞12、24和48 h后,4种肿瘤细胞的细胞活力均随给药浓度升高和干预时间延长而显著降低,呈浓度依赖性和时间依赖性(图1)。
2.2不同浓度GLE可促进肿瘤细胞凋亡 GLE作用于SW1990、SKOV3和HGC27细胞24、48 h时,与对照组相比,100、150、200 μg/ml GLE处理组细胞总凋亡率上升(P<0.05)。但A549细胞GLE作用24 h时仅200 μg/ml 干预组总凋亡率明显上升,干预48 h时,100、150、200 μg/ml GLE显著提高A549细胞凋亡率(图2)。
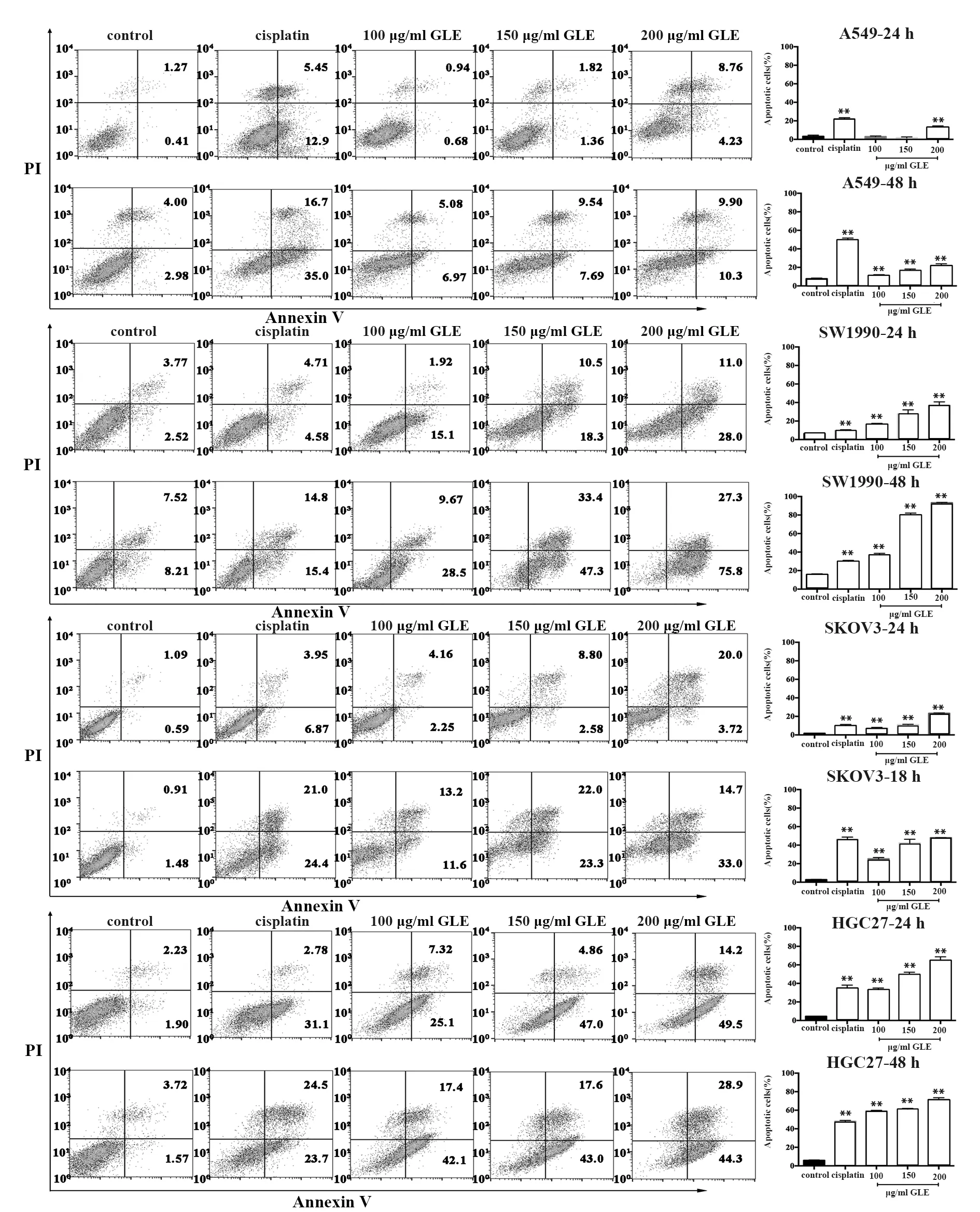
图2 GLE以时间和剂量依赖性诱导肿瘤细胞凋亡Fig.2 GLE induced apoptosis of tumor cells in a time and dose-dependent mannerNote:**.P<0.01 vs control group.
2.3GLE促进肿瘤细胞周期阻滞 GLE作用 24 h时,随药浓度升高,与对照组相比,A549、SW1990细胞处于G0/G1期细胞增加,HGC27细胞仅200 μg/ml干预组G0/G1期细胞数显著增加。SKOV3细胞100、150 μg/ml干预组G0/G1期细胞数显著增加,200 μg/ml干预组G2/M期细胞数显著增加(图3)。
2.4GLE在mRNA水平下调Bcl2/Bax比值,改变细胞周期相关基因表达 GLE干预4种肿瘤细胞24 h后,RT-PCR结果表明,与对照组相比,随着给药浓度增加,Bcl2/Bax比值下降(图4)。100、150、200 μg/ml GLE干预A549、SW1990、SKOV3细胞24 h后,细胞周期相关基因E2F-1、CDK2、CDK4、CDK6、CyclinA2、CyclinB1及CyclinE1表达不同程度地降低,p21表达上调(图3)。与流式结果相似,200 μg/ml GLE干预导致HGC27细胞细胞周期相关基因E2F-1、CDK2、CDK4、CDK6、CyclinA2、CyclinB1及CyclinE1表达降低,100、150 μg/ml GLE干预导致HGC27细胞E2F1、CDK2、CyclinA2、CyclinB1及CyclinE1表达不同程度地降低(图3)。

图3 GLE不同浓度对肿瘤细胞周期阻滞及细胞周期相关基因表达的影响Fig.3 Effect of different concentrations of GLE on cell cycle arrest of tumor cells and expressions of cell cycle related genesNote:*.P<0.05,**.P<0.01 vs control group.
2.5GLE在蛋白水平降低Bcl2/Bax的比值,上调c-caspase-3、c-PARP/PARP表达 100、150、200 μg/ml GLE作用24 h后,相比于对照组,A549、SKOV3和HGC27细胞随GLE浓度增加,Bcl2/Bax蛋白表达下调,cleaced caspase-3表达上升,cleaved PARP占总PARP比值上升(图4)。SW1990细胞株仅150和 200 μg/ml GLE处理组cleaved caspase-3、cleaved PARP占总PARP比值上升(图4)。
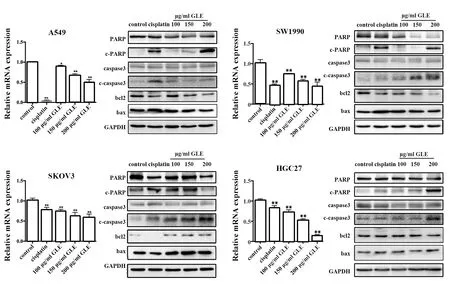
图4 不同浓度GLE对肿瘤细胞Bcl/Bax、c-PARP/PARP比值及caspase-3通路相关蛋白表达的影响Fig.4 Effect of different concentrations of GLE on ratio of Bcl/Bax and c-PARP/PARP and expressions of caspase-3 signaling related proteinsNote:*.P<0.05,**.P<0.01 vs control group.
3 讨论
手术治疗是早期癌症患者的首选,放射治疗和全身性治疗,包括化疗、靶向治疗、激素治疗和免疫治疗,更适合晚期和侵袭性癌症患者,但副作用较多,如疲劳、疼痛、生育能力受损及复发。近年来,因毒副作用较小,灵芝及其提取物在抗肿瘤、增强放化疗敏感性等方面的作用引起广泛关注[11-14]。Su等[15]将灵芝多糖和紫杉醇联用显著抑制小鼠4T1乳腺癌模型肿瘤细胞生长,调节肿瘤代谢和肠道菌群。Yu等[16]将灵芝多糖和硫化铋纳米粒子结合,发现结合产物可增加放疗敏感性,显著抑制肿瘤生长,减少转移。除作为肿瘤辅助治疗药物外,灵芝及其提取物本身也具有显著的抗肿瘤活性。研究表明,灵芝酸A可通过影响PI3K/AKT信号通路抑制人胶质母细胞瘤细胞生长,减弱其迁移、侵袭能力,诱导凋亡和自噬,体内实验表明雪灵芝粗多糖对S180荷瘤小鼠的肿瘤细胞生长具有抑制作用,但对细胞增殖(CyclinD1、PCNA、Ki67)和细胞凋亡相关因子(Bcl2、Bax)表达无显著影响[17]。
凋亡是以细胞膜起泡、细胞收缩、核碎裂、染色质浓缩等为特征的程序性细胞死亡,包括细胞受体和线粒体介导2种途径,均通过半胱天冬酶的级联活化介导。半胱天冬酶是凋亡机制的关键,大致可分为启动子(caspase-2、caspase-8、caspase-9、caspase-10),执行子(caspase-3、caspase-6、caspase-7)和炎症半胱天冬酶(caspase-1、caspase-4、caspase-5)[18]。线粒体介导的凋亡途径主要通过细胞色素c的传递和caspase-9的激活控制。另外,Bcl2家族成员是调节细胞色素c释放至细胞质的重要参与者。细胞色素c激活caspase-9产生凋亡小体,激活caspase-3,最终导致细胞凋亡。细胞周期调控是复杂的过程,已经证实细胞周期进展异常与多种肿瘤的发展密切相关,如食管癌、胃癌和结肠癌[19]。细胞周期蛋白依赖性激酶(CDK)是丝氨酸-苏氨酸激酶,受调节性细胞周期蛋白的正调控和CDK抑制剂的负调控,在细胞周期进程中起重要作用,如CDK1/2-CyclinA和 CDK1-CyclinB分别对S和G2/M期过渡具有重要作用。CDK4/6-CyclinD和CDK2-CyclinE通过视网膜母细胞瘤蛋白(Rb)的顺序磷酸化促进细胞周期从G1期过渡至S期[20]。目前多种CDK抑制剂已进入临床试验阶段。
本研究发现GLE以时间和剂量依赖性降低4种肿瘤细胞的细胞活力,细胞周期相关基因E2F-1、CDK2、CDK4、CDK6、CyclinA2、CyclinB1及CyclinE1表达降低,p21表达升高,说明GLE可诱导肿瘤细胞周期阻滞。流式细胞术检测发现GLE以时间和剂量依赖性诱导细胞凋亡。进一步检测凋亡相关蛋白表达,发现随给药剂量增加,抑制凋亡蛋白Bcl2和促凋亡蛋白Bax比值降低,caspase-3活化形式(cleaved caspase-3)表达升高,凋亡标志蛋白PARP被切割为cleaved-PARP,进一步从分子层面提示GLE通过caspase-3信号通路诱导细胞凋亡。
GLE可显著抑制肿瘤细胞的增殖,诱导细胞凋亡及细胞周期阻滞,提示GLE对肿瘤细胞增殖的抑制可能是通过调节细胞周期相关基因表达和caspase-3信号通路发挥作用。

