miR-223通过调控NLRP3炎症小体减轻免疫球蛋白A肾病大鼠肾脏损伤①
王 瑾 王加强 邱 洪 杨丽萍 李 佳 谭 翔
(四川省医学科学院,四川省人民医院检验科,成都 610072)
免疫球蛋白A肾病(immunoglobulin A nephropathy,IgAN)是一种自身免疫疾病,由IgA1异常糖基化形成半乳糖缺陷型IgA1并被正常IgG和IgA1作用诱发,形成的免疫复合物积累会引起诸如补体激活、氧化应激、炎症级联以及细胞凋亡等一系列反应[1,2]。该病在亚洲太平洋区域的发生率较高,且发展成终末期肾病的风险也高于其他地区[3,4]。现今对IgAN病理机制的研究尚未明确,通过加深对其发病机制的理解,对于开发新的特效治疗药物具有重要意义。miRNA是一类小分子非编码RNA,具有通过结合目标mRNA 3′UTR区域沉默基因的能力[5]。miRNA参与多种肾病的病理生理过程,也有文献报道了miRNA对IgAN的调控作用[6,7]。在包括IgAN在内的诸多文献中报道了miR-223对肾脏疾病的缓解作用,然而其具体机制尚不明确[8-10]。本研究通过建立IgAN的HK2细胞和大鼠模型,并以miR-223 mimics或agomir处理,探究miR-223在IgAN中的作用机制。
1 材料与方法
1.1材料
1.1.1细胞来源 人肾小管上皮细胞HK2和人肾小管系膜细胞HMC购自中科院上海细胞库。
1.1.2实验动物 40只SPF级SD雄性大鼠,体质量220~250 g,购自上海斯莱克实验动物有限公司,于室温、40%相对湿度的环境条件下喂养14 d,期间昼夜12 h交替,水和饲料正常供给。
1.1.3主要试剂 DMEM细胞培养液、胎牛血清购自美国Gibco公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;牛血清白蛋白、脂多糖购自美国Sigma公司;尿蛋白、尿素氮(urea nitrogen,BUN)、血清肌酸酐(serum creatinine,SCr)、IL-1β、IL-18检测试剂盒购自南京建成生物工程有限公司;反转录试剂盒SsoFastTMEva-Green®Supermix购自美国Bio-Rad公司;荧光素酶报告系统购自美国Promega公司;TRIzol试剂、RIPA试剂、BCA蛋白定量试剂盒、HE染色试剂、TUNEL细胞凋亡试剂盒购自上海碧云天生物技术研究所;pcDNA 3.1-NLRP3载体、miR-223 mimics & agomir、mimics NC、siRNA-NLRP3、siRNA-mate体内转染试剂盒购自上海吉玛制药技术有限公司;NOD样受体热蛋白结构域3(NOD-like receptor pyrin domain containing three,NLRP3)、接头蛋白凋亡相关点状蛋白(apoptosis-associated speck-like protein,ASC)、胱天蛋白酶1(Caspase-1)一抗以及辣根过氧化物酶标记的二抗购自英国Abcam公司;所用引物由上海生工生物公司合成。
1.2方法
1.2.1细胞培养及处理方法 HK2和HMC细胞在37℃、5%CO2的环境条件下培养于含10%胎牛血清、100 U/ml青霉素、100 mg/ml链霉素的DMEM细胞培养液。HMC细胞经复苏培养后,加入6孔板,1×106个/孔,继续培养于含0.5%胎牛血清和0.5 mg/ml从IgAN患者或健康志愿者血清中提取纯化聚合的IgA(polymeric IgA,pIgA)的DMEM细胞培养液,培养48 h后,收集培养液并冻存于-80℃冰箱备用。
1.2.2细胞模型建立及分组处理 细胞分为空白对照(Control)组、pIgA组、miR-223 mimics组和miR-223 mimics+pc-NLRP3组,除Control组常规培养外,其余各组均培养于1.2.1中所制备的IgA-HMC培养液,按照Lipofectamine 2000试剂提供的操作说明,miR-223 mimics组转染miR-223 mimics,miR-223 mimics+pc-NLRP3组共转染miR-223 mimics和pc-NLRP3,转染24 h后,低温离心收集细胞,-80℃冰箱冻存。
1.2.3动物模型的建立及分组 大鼠随机分为Control组、IgAN组、miR-223 agomir组和si-NLRP3组, 除Control组所有成分使用等体积溶剂代替以外,其余各组采用如下方式造模:①每天以400 mg/kg的牛血清白蛋白进行灌胃处理,持续6周;②第6周和第8周采用尾静脉注射的方式给予0.05 mg脂多糖;③采用皮下注射的方式每周给予0.1 ml四氯化碳和0.5 ml蓖麻油混合液,持续9周。10周后观察大鼠造模是否成功,参照标准为肉眼可见的血尿,或显微镜下观察可见血尿且尿中红细胞30%以上发生变形。造模成功后miR-223 agomir组采用尾静脉注射给予miR-223 agomir, si-NLRP3组按照siRNA-mate体内转染试剂盒说明书操作,尾静脉注射给予si-NLRP3,Control组和IgAN组尾静脉注射等体积的生理盐水作为参照,1次/d,持续3 d。
1.2.4RT-PCR检测基因表达 PBS缓冲液漂洗细胞,TRIzol试剂盒提取各组细胞中的总RNA,反转录合成cDNA后,根据SsoFastTMEva-Green®Supermix试剂盒提供的循环条件进行PCR扩增,2-ΔΔCt法计算各组基因表达水平。
1.2.5双荧光素酶报告基因检测靶向作用 分别构建NLRP3 3′UTR Lenti-reporter-luciferase野生型(WT)和突变型(MUT)载体,并分别将所构建的载体和pRL-CMV载体共转染至HEK293T细胞,并设为NLRP3 WT组和NLRP3 MUT组,同时分别使用mimics NC或miR-223 mimics转染两组细胞,48 h后通过荧光素酶报告检测系统检测荧光素酶活性。
1.2.6Western blot检测蛋白表达 通过RIPA裂解液提取各组细胞或组织中的总蛋白,BCA法定量,以10% SDS-PAGE电泳分离各组蛋白,电泳结束后将蛋白通过半干转膜法转移至PVDF膜,并通过5%脱脂牛奶室温封闭2 h,弃去残余液体,一抗在4℃条件下孵育过夜,TBST缓冲液清洗后,二抗孵育2 h,再通过ECL显色液显影,凝胶成像仪扫描并通过灰度值进行相对定量。
1.2.7血、尿生化指标检测 最后1次给药之后,收集24 h内的尿液并搅拌均匀,尿蛋白检测专用试剂盒检测24 h尿蛋白量。采用脱颈法处死各组大鼠,采集心尖血样并根据SCr和BUN检测试剂盒说明书检测SCr和BUN浓度。
1.2.8HE染色检测肾组织病理改变 取大鼠肾组织,4%多聚甲醛固定24 h,流水冲洗,以70%、80%、90%、95%、100%的乙醇梯度脱水30 min,二甲苯透明处理,石蜡包埋后切2 μm薄片,HE染色,光学显微镜下观察肾组织病理改变。
1.2.9TUNEL染色检测肾组织细胞凋亡 以1.2.8的方法对肾组织石蜡包埋切片,采用TUNEL细胞凋亡试剂盒对组织进行染色,光学显微镜下观察凋亡细胞,每张切片选择6个视野,统计凋亡细胞数占细胞总数的百分比,即为细胞凋亡率。
1.2.10ELISA检测血清炎症细胞因子 按照1.2.7所述方法采血,根据ELISA试剂盒操作说明书检测血清中IL-1β和IL-18浓度。

2 结果
2.1IgAN患者及HK2细胞中miR-223和NLRP3表达水平 相较于健康对照组,IgAN患者组中miR-223表达水平降低(P<0.05),差异有统计学意义(图1A)。与Control组HK2细胞相比,pIgA组中miR-223表达水平降低,NLRP3表达水平升高,差异有统计学意义(P<0.01,图1B)。

图1 RT-PCR检测临床样本和HK2细胞中miR-223和NLRP3表达水平Fig.1 RT-PCR for detecting miR-223 and NLRP3 expre-ssions in clinical sample and HK2 cellsNote:A.miR-223 expression in clinical sample,n=10;B.miR-223 and NLRP3 expressions in HK2 cells,n=6.*.P<0.05 vs IgAN patients;**.P<0.01 vs Control group.
2.2miR-223靶向作用于NLRP3 如图2所示,与NLRP3 WT+mimics NC相比,NLRP3 WT+miR-223 mimics荧光素酶活性显著降低,差异有统计学意义(P<0.01);NLRP3 MUT+mimics NC和NLRP3 MUT+miR-223 mimics差异无统计学意义。

图2 荧光素酶报告实验检测miR-223和NLRP3靶向作用关系Fig.2 Luciferase report assay for detecting relationship between miR-223 and NLRP3Note:n=3,**.P<0.01 vs mimics NC group.
2.3miR-223降低HK2细胞NLRP3表达水平 与Control组HK2细胞相比,pIgA组miR-223表达水平显著降低,差异有统计学意义(P<0.01);与pIgA组相比,miR-223 mimics组miR-223表达水平显著升高,差异有统计学意义(P<0.01,图3A)。与Control组HK2细胞相比,pIgA组中NLRP3蛋白水平显著升高,差异有统计学意义(P<0.01);与pIgA组相比,miR-223 mimics组NLRP表达水平显著降低,差异有统计学意义(P<0.01);与miR-223 mimics组相比,miR-223 mimics+pc-NLRP3组NLRP3蛋白水平显著升高,差异有统计学意义(P<0.01,图3B)。

图3 RT-PCR和Western blot检测HK2细胞中miR-223对NLRP3表达的影响Fig.3 RT-PCR and Western blot for detecting effect of miR-223 on NLRP3 expression in HK2 cell
2.4miR-223降低HK2细胞中ASC和Caspase-1蛋白水平 如图4所示,与Control组HK2细胞相比,pIgA组中ASC和Caspase-1蛋白水平显著升高,差异有统计学意义(P<0.01);与pIgA组细胞相比,miR-223 mimics组中ASC和Caspase-1蛋白水平显著降低,差异有统计学意义(P<0.01);与miR-223 mimics组细胞相比,miR-223 mimics+pc-NLRP3组中ASC和Caspase-1蛋白水平显著升高,差异有统计学意义(P<0.01)。
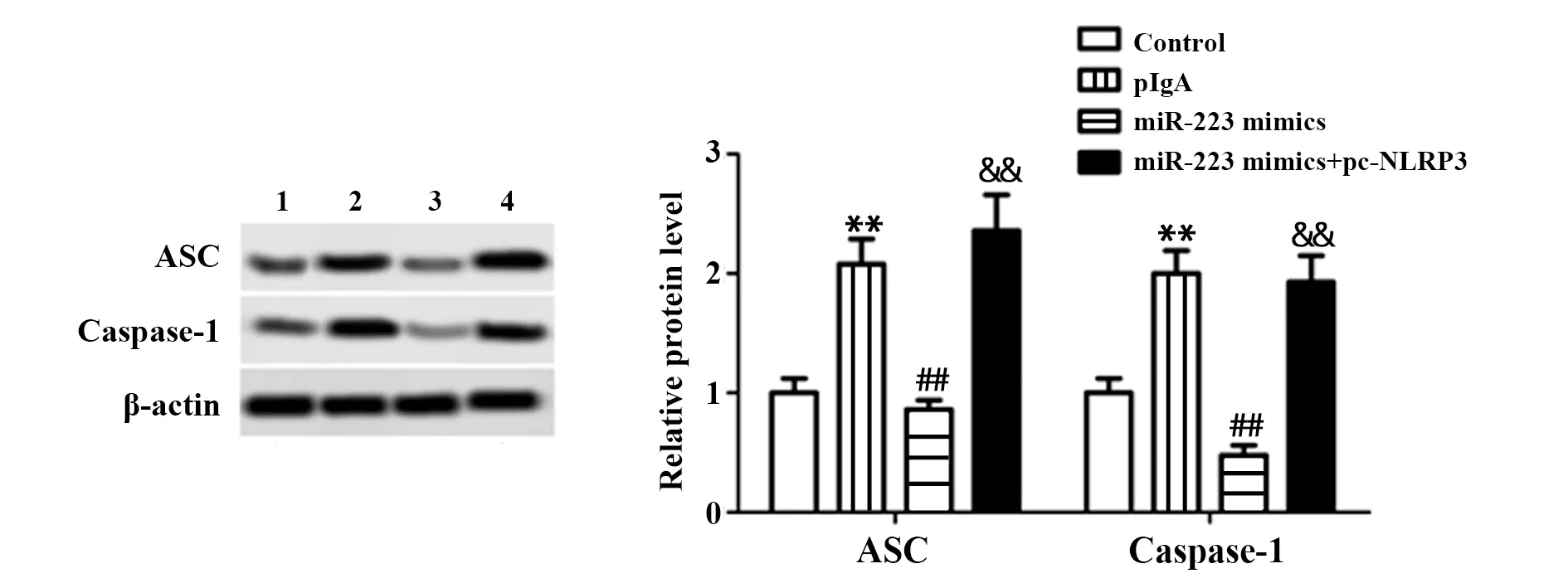
图4 Western blot检测miR-223对HK2细胞中ASC和Caspase-1蛋白水平的影响Fig.4 Western blot for detecting effect of miR-223 on ASC and Caspase-1 protein levels in HK2 cellsNote:n=6,**.P<0.01 vs Control group;##.P<0.01 vs pIgA group;&&.P<0.01 vs miR-223 mimics group.1.Control;2.pIgA;3.miR-223 mimics;4.miR-223 mimics+pc-NLRP3.
2.5miR-223降低IgAN大鼠尿蛋白、Scr、BUN浓度 如图5所示,与Control组相比,IgAN组中尿蛋白、Scr和BUN浓度显著升高,差异有统计学意义(P<0.01);与IgAN组相比,miR-223 agomir组和si-NLRP3组中各指标浓度显著降低,差异有统计学意义(P<0.01)。
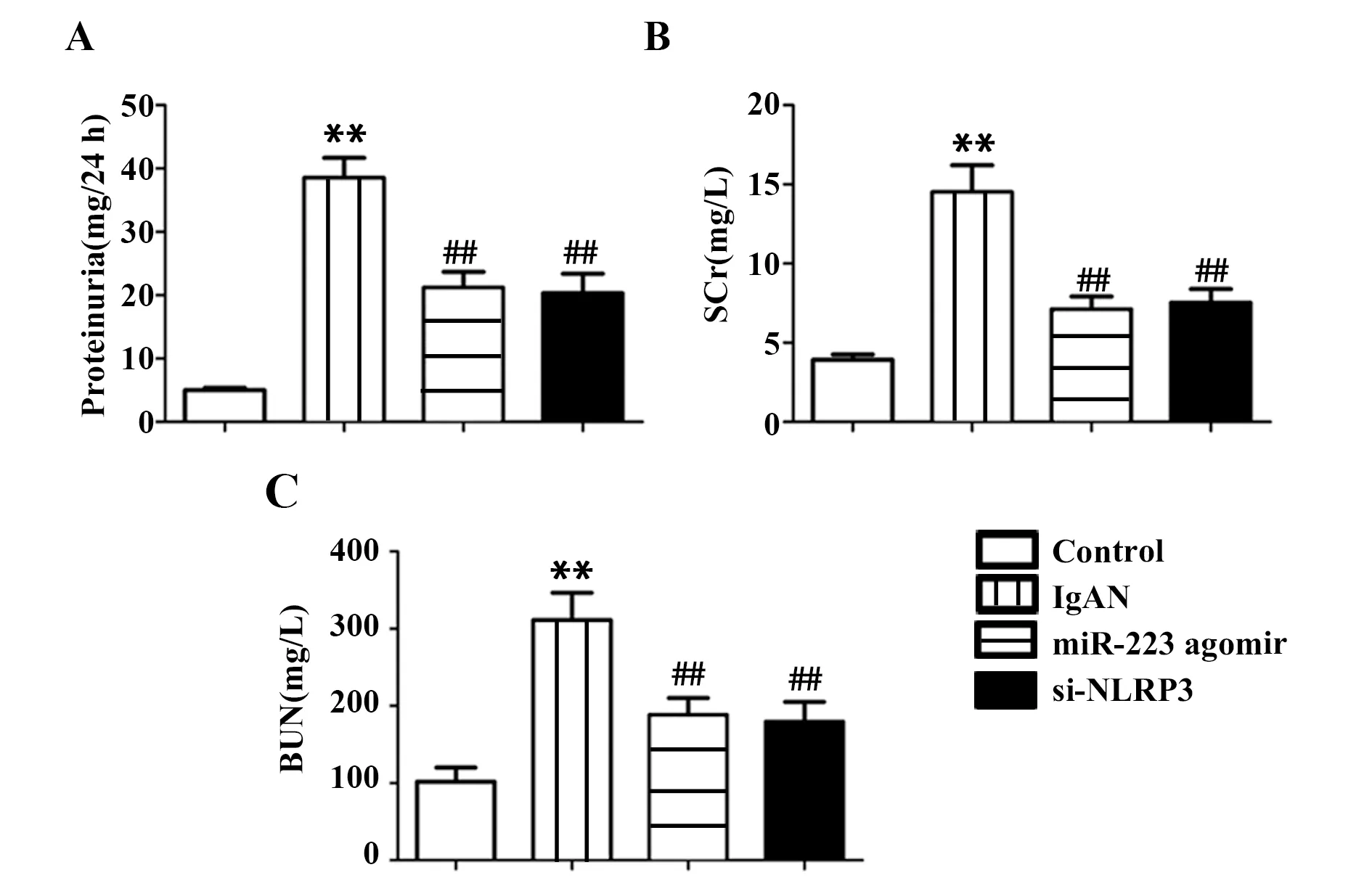
图5 miR-223对IgAN大鼠尿蛋白、SCr和BUN浓度的影响Fig.5 Effect of miR-223 on concentrations of proteinuria,SCr and BUN in IgAN ratsNote:n=10,**.P<0.01 vs Control group;##.P<0.01 vs IgAN group.
2.6miR-223减轻IgAN大鼠肾组织病理变化 如图6所示,Control组大鼠肾组织形态正常,结构完整,小管排列整齐,IgAN组中出现肾小球体积增大,系膜增生,球囊黏连,肾小管上皮细胞空泡样变等病理性改变;经miR-223或si-NLRP3处理后,肾组织中的病理性改变明显减轻。

图6 HE染色检测miR-223对IgAN大鼠肾组织病理变化的影响(×400)Fig.6 HE staining for observing effect of miR-223 on pathological changes of renal tissue in IgAN rats(×400)
2.7miR-223降低IgAN大鼠肾组织细胞凋亡 如图7所示,与Control组大鼠肾组织相比,IgAN组中细胞凋亡水平显著升高,差异有统计学意义(P<0.01);与IgAN组大鼠肾组织相比,miR-223 agomir组和si-NLRP3组中细胞凋亡水平显著降低,差异有统计学意义(P<0.01)。

图7 TUNEL染色检测miR-223对IgAN大鼠肾组织细胞凋亡的影响(×400)Fig.7 TUNEL staining for observing effect of miR-223 on cell apoptosis of renal tissues in IgAN rats(×400)
2.8miR-223降低IgAN大鼠血清中IL-1β和IL-18浓度 如图8所示,与Control组相比,IgAN组血清中IL-1β和IL-18浓度显著升高,差异有统计学意义(P<0.01);与IgAN组相比,miR-223 agomir和si-NLRP3组血清中IL-1β和IL-18浓度显著降低,差异有统计学意义(P<0.01)。
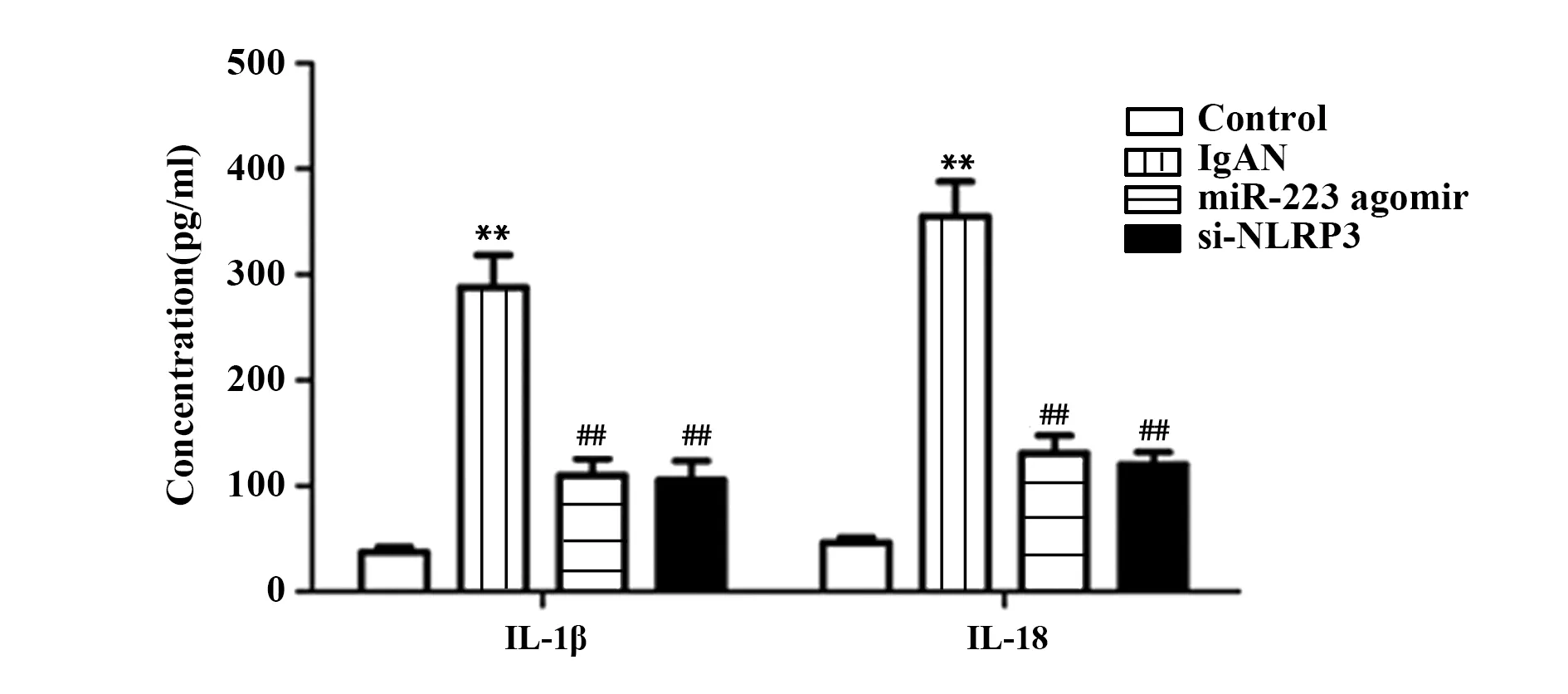
图8 ELISA检测miR-223对IgAN大鼠IL-1β和IL-18表达的影响Fig.8 ELISA assay for measuring effect of miR-223 on IL-1β and IL-18 expressions in IgAN ratsNote:n=10,**.P<0.01 vs Control group;##.P<0.01 vs IgAN group.
2.9miR-223降低IgAN大鼠体内NLRP3、ASC和Caspase-1蛋白水平 如图9所示,与Control组相比,IgAN组肾组织NLRP3、ASC和Caspase-1蛋白水平显著升高,差异有统计学意义(P<0.01);与IgAN组相比,miR-223 agomir和si-NLRP3组肾组织NLRP3、ASC和Caspase-1蛋白水平显著降低,差异有统计学意义(P<0.01)。

图9 Western blot检测miR-223对IgAN大鼠NLRP3、ASC和Caspase-1蛋白水平的影响Fig.9 Western blot for detecting effect of miR-223 on NLRP3,ASC,Caspase-1 protein levels in IgAN ratsNote:n=10,**.P<0.01 versus Control group;##.P<0.01 vs IgAN group.1.Control;2.pIgA;3.miR-223 mimics;4.si-NLRP3.
3 讨论
IgAN的病理机制至今仍有许多不明确的问题,目前的治疗手段仅能缓解病情。研究表明,IgAN的病理机制与NLRP3炎症小体密切相关。Tsai等[11]研究表明,IgA免疫复合物可激活NLRP3炎症小体,活化的NLRP3炎症小体可进一步活化T细胞,并激活线粒体活性氧的产生。有研究报道miR-223在骨髓细胞中可靶向作用于NLRP3的3′UTR区抑制NLRP3炎症小体激活,然而miR-223是否可以通过靶向抑制NLRP3减轻IgAN症状尚未见报道[12]。为了验证这一推测,本研究首先检测了临床样本中miR-223表达水平变化情况,发现IgAN患者体内的miR-223表达水平显著降低,提示miR-223具有调控IgAN的作用。本研究还发现经过IgA-HMC培养液培养的HK2细胞中miR-223表达水平降低,NLRP3表达水平升高,且miR-223过表达可显著降低NLRP3蛋白表达。同时,本研究发现,通过上调miR-223表达或沉默NLRP3表达均可显著降低由IgAN引起的血、尿生化指标升高,减轻病理改变和肾组织细胞凋亡,表明miR-223可通过调控NLRP3蛋白表达减轻IgAN引起的肾脏损伤。此外,双荧光素酶报告基因实验结果显示,miR-223与NLRP3存在靶向作用关系。上述实验结果表明,miR-223可靶向抑制NLRP3蛋白表达,从而减轻IgAN引起的肾脏损伤。
炎症小体是一种高分子量的多蛋白复合体,可激活下游的Caspase-1前体裂解形成活化型Caspase-1,这一过程对蛋白酶解具有重要作用[13]。Caspase-1可进一步裂解IL-1β和IL-18的前体,形成成熟的IL-1β和IL-18,其中IL-1β与IgAN发病过程中免疫介质在肾小球内系膜中的调节有关,IL-18则直接通过多种机制参与免疫性或非免疫性肾脏组织损伤[14,15]。炎症小体的形成是由NOD样受体家族成员引起的,其中NLRP3为最常见的一种NOD样受体成员,可被大范围的外源性和内源性的信号分子激活。NLRP3被信号分子激活后,将解除NACHT和LRRs结构域的相互作用,ASC是炎症小体中的接头蛋白,NLRP3与ASC结合后,可募集Caspase-1的前体并使其裂解活化[16-18]。为了进一步探究miR-223在IgAN中对NLRP3炎症小体的影响,本研究检测了IL-1β、IL-18及其炎症小体相关蛋白水平等指标,发现在IgAN大鼠血清中IL-1β和IL-18浓度升高,而上调miR-223表达或沉默NLRP3表达均可显著降低IL-1β和IL-18浓度。同时,本研究发现在IgAN模型细胞中,炎症小体蛋白ASC和Caspase-1蛋白水平上调,miR-223过表达可降低模型细胞中ASC和Caspase-1的蛋白水平,通过提高NLRP3的蛋白表达可拮抗miR-223的作用。而在IgAN大鼠肾组织中,NLRP3、ASC和Caspase-1蛋白水平上调,通过提高miR-223表达或沉默NLRP3表达均可降低IgAN大鼠肾组织中NLRP3、ASC和Caspase-1蛋白水平。以上结果表明miR-223通过靶向抑制NLRP3蛋白水平阻碍NLRP3炎症小体的激活,从而在IgAN中发挥肾脏保护作用。
综上所述,miR-223可通过靶向作用于NLRP3降低NLRP3蛋白水平,阻碍NLRP3炎症小体激活,从而抑制炎症细胞因子IL-1β和IL-18产生,减轻由IgAN引起的肾组织病理性损伤,降低细胞凋亡。本研究首次探明了miR-223在IgA肾病中对NLRP3炎症小体的作用及机制,为IgAN治疗提供了有潜力的靶向治疗思路。

