危重型新型冠状病毒肺炎心肌损伤与死亡的关系
李伶芝 何兵 张淑娣 王世红 张明霞 赵庆彦
武汉大学人民医院1儿科,2神经外科,3心内科(武汉430060)
2019年12月以来,一种具有严重传染性的急性呼吸道疾病新型冠状病毒肺炎(COVID-19)在世界范围内流行,病原体为新型冠状病毒(SARSCoV-2)。SARS-CoV-2 是 继SARS-CoV 和MERSCoV以后发现的第三种可以引起人类致死性肺炎的冠状病毒[1]。SARS-CoV-2 传染性强,人群普遍易感,其发病率明显高于非典型性肺炎(SARS)和中东呼吸综合征(MERS)[2],逐渐形成全球大流行。COVID-19除了累及呼吸系统外,还可造成全身各器官功能损害,包括对心脏的损伤,如心肌损伤、心律失常、心力衰竭等[3-4]。研究显示,COVID-19 患者,尤其是重型、危重型患者在病程中常伴发心肌损伤和心功能不全[5-6]。荟萃分析显示COVID-19相关的心脏损伤与其较高的病死率相关[7]。COVID-19 相关的心肌损伤已成为患者病情进展或致死的重要原因之一,现就危重型COVID-19 相关心肌损伤与死亡的关系进行分析,以早期发现预警信息,评估死亡危险程度,为临床及时优化治疗提供依据。
1 资料与方法
1.1 一般资料选取2020年2月1日至3月25日武汉大学人民医院东院确诊的113例危重型COVID-19病例资料。诊断标准:所有病例均为确诊病例,即均采取实时荧光逆转录聚合酶链反应(RT-PCR)进行SARS-CoV-2 核酸检测结果为阳性的患者。符合《新型冠状病毒肺炎诊疗方案(试行第七版)》[8]中的诊断标准。所有病例均符合危重症的分型。心肌损伤诊断标准:出现肌钙蛋白(cTnI/cTnT)升高超过99%的参考上限[3]。
1.2 资料收集通过电子病历系统收集及整理患者临床资料,包括:(1)一般情况:患者的性别、年龄、首发症状、基础疾病状况。(2)实验室检查指标:外周血白细胞计数(WBC)、中性粒细胞计数(NEU)、淋巴细胞计数(LYM)、C 反应蛋白(CRP)、降钙素原(PCT)、D-二聚体、谷丙转氨酶(ALT),谷草转氨酶(AST)、血尿素氮(BUN)、血肌酐(Cr)、超敏肌钙蛋白I(Hs-TnI)、肌红蛋白(MYO)、肌酸激酶同工酶(CK-MB)、血清白蛋白、乳酸脱氢酶(LDH)和肌酸激酶(CK)等。(3)心电图结果等相关信息。按照预后将患者分为死亡组(n= 50)及存活组(n= 63)两组。
1.3 统计学方法采用SPSS(20.0版)软件进行统计分析。分类变量以例数及百分数(%)表示。分类变量组间比较采用卡方检验,不满足卡方检验条件时采用Fisher确切概率法。事件(死亡)发生的时间定义为从起病到事件发生的时间。采用多因素Cox回归分析确定危重型COVID-19 患者死亡的独立危险因素。采用Kaplan-Meier 生存曲线分析心肌损伤的累积生存率。然后采用对数秩检验比较Kaplan-Meier曲线分布的差异。最后采用ROC曲线分析心肌损伤标志物对危重症COVID-19 患者死亡的预测能力。采用双侧检验,P<0.05表示差异有统计学意义。
2 结果
2.1 基线资料分析113 例危重症COVID-19 患者中男68例,女45例。平均年龄(67.25±14.06)岁,范围为29 ~95 岁。死亡50 例(44.25%),存活63 例(55.75%)。如表1 所示,年龄>70 岁、高血压、冠心病、体温>39 ℃在死亡组的比例明显高于存活组,差异有统计学意义(P<0.05)。而性别、其他基础疾病和首发症状在两组之间差异无统计学意义(P>0.05)。

表1 死亡组与存活组临床特征比较Tab.1 Comparison of clinical features between the death group and the survival group 例(%)
2.2 实验室检查在表2中,以下因素在死亡组的比例明显高于存活组,差异有统计学意义(P<0.05):WBC >9.5 × 109/L、NEU >6.5 × 109/L、LYM <0.6 ×109/L、CRP >100 mg/L、D-二聚体>5 mg/L、Hs-TnI >0.04 μg/L、MYO >100 μg/L、CK-MB >5 μg/L、BUN >8 mmol/L、LDH >500 U/L。而其他实验室指标在死亡组与存活组之间差异无统计学意义(P>0.05)。
2.3 心电图结果113 例病例中有70 例患者有心电图数据。心电图特征见表3。室性心律失常、异常心电图在死亡组的比例明显高于存活组,差异有统计学意义(P<0.05)。两组患者在ST-T 改变、QT 间期延长、病理Q 波、窦性心动过速、窦性心动过缓、房室传导阻滞、房性心律失常等其他心律失常事件上差异无统计学意义(P>0.05)。

表2 死亡组与存活组实验室指标比较Tab.2 Comparison of laboratory findings between the death group and the survival group 例(%)
2.4 多因素Cox 回归分析如表4 所示,Hs-TnI >0.04 μg/L(HR= 2.10,95%CI:1.13 ~3.91),MYO >100 μg/L(HR= 2.14,95%CI:1.15 ~3.97),WBC >9.5 × 109/L(HR= 2.18,95%CI:1.20 ~3.98)是危重症COVID-19 患者死亡的独立危险因素。

表4 危重症COVID-19 患者死亡的独立危险因素Tab.4 The independent risk factors for death in critical COVID-19
2.5 Kaplan-Meier 生存曲线从图1 可以看出,自起病以来,心肌损伤患者(绿线)的累积生存率明显低于非心肌损伤患者(蓝线),两者曲线分布差异有统计学意义,对数秩检验P<0.001。
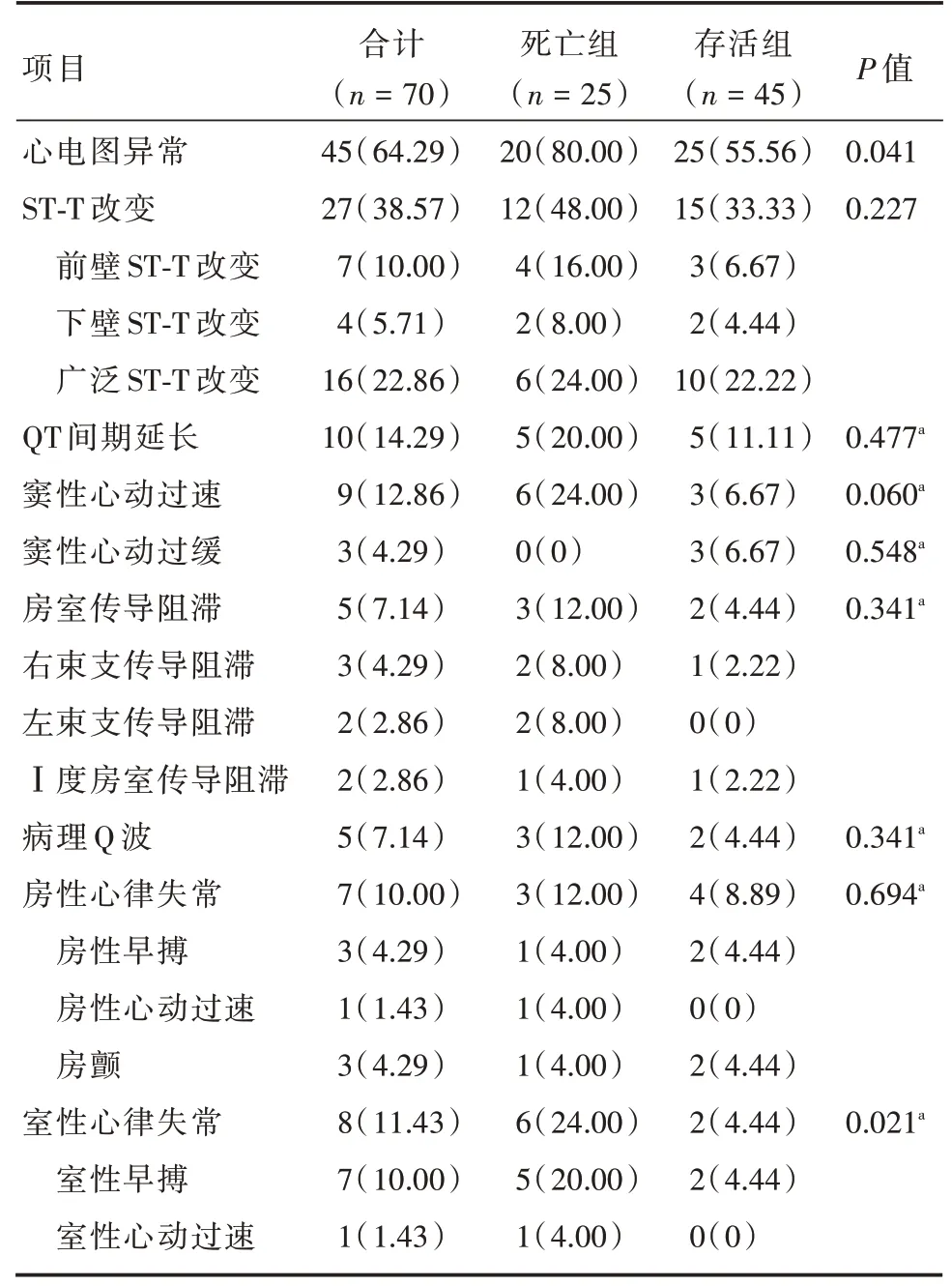
表3 死亡组与存活组心电图结果比较Tab.3 Comparison of electrocardiogram results between the death group and the survival group例(%)

图1 心肌损伤患者与非心肌损伤患者的累积生存率分布Fig.1 Cumulative survival distribution in patients with and without myocardial injury
2.6 心肌损伤标志物对COVID-19患者死亡风险的预测评估如图2 所示,Hs-TnI 曲线下面积0.785,以截断值Hs-TnI ≥0.022 μg/L 预测死亡的灵敏度为78.7%,特异性为67.8%。CK-MB 曲线下面积0.762,以截断值CK-MB ≥2.01 μg/L 预测死亡的灵敏度为76.6%,特异性为69.5%。MYO 曲线下面积0.781,以截断值MYO ≥98.76 μg/L 预测死亡的灵敏度为66.0%,特异性为76.3%。心肌损伤标志物Hs-TnI、CK-MB、MYO 的曲线下面积均在0.7~0.9之间,对危重症COVID-19 患者死亡风险评估具有较好的预测意义(P<0.001)。

图2 Hs-TnI、CK-MB、MYO 对COVID-19 患者死亡风险预测的ROC 曲线Fig.2 ROC curves of Hs-TnI,CK-MB and MYO in critical COVID-19
3 讨论
自COVID-19 疫情发生以来,COVID-19 相关心肌损伤与死亡的关系被国内外学者关注。有文献报道[9-10],危重症COVID-19 患者中合并心肌损伤者达44.4%~62.5%,提示伴有心肌损伤可能是COVID-19 发展成危重症的主要危险因素。另有研究发现,在危重症COVID-19 患者中,50%以上的死亡患者住院期间出现心肌损伤[11]。COVID-19患者的全因死亡率约2.3%[12],而合并心肌损伤病死率可升高至59.6%[13]。本组Kaplan-Meier 生存曲线显示,起病以来心肌损伤患者的累积生存率明显低于非心肌损伤患者,说明COVID-19 合并心肌损伤时病死率更高。
本组113 例危重症患者中有43 例(38.1%)出现心肌损伤,有50 例(44.2%)死亡。死亡患者往往高龄(>70 岁),合并高血压及冠心病等心血管基础疾病的比例比存活组更高,与既往研究[14-15]一致。在本研究中,死亡的患者具有较高比例的心肌损伤和高血压、冠心病等心血管相关基础疾病。这表明具有潜在心血管疾病患者可能在SARS-CoV-2感染后更容易发展为不可逆转的心肌损伤。有研究表明,伴有心血管基础疾病可增加COVID-19 的患病概率[16],而SARS-CoV-2 感染反过来又会加重心血管疾病患者的病情,或增加新的心血管并发症的发生,使COVID-19 向重症及危重症转化[17]。因此心血管基础疾病在COVID-19 患者管理中不可忽视。
死亡组实验室指标WBC、NEU、CRP、D-二聚体、BUN、Hs-TnI、CK-MB、MYO、LDH 等与存活组相比,升高更显著,说明炎症因子风暴以及其引起的心肌损伤、肝肾功能不全、凝血功能异常等多脏器功能障碍,可能是导致COVID-19 患者死亡的重要原因。病理研究显示,COVID-19 死亡患者外周血CD4+T 细胞及CD8+T 细胞的数量明显减少,但呈高度激活状态,促炎性的CCR4+、CCR6+、Th17 细胞显著增多,且CD8+T 细胞中含有大量细胞毒颗粒,推测患者受到了严重的炎症因子风暴造成的免疫损伤[18]。另有研究显示,危重症COVID-19 患者出现炎症因子风暴,可促进血栓形成和心脏、肾脏损伤[6,19],对预后造成不可逆的影响。
COVID-19 患者出现发热、低氧血症和心肌损伤等情况很容易引起心律失常[3,13]。有文献显示,COVID-19 患者中有16.7%出现心律失常[5]。但也有研究报道,COVID-19 患者心律失常的发生率仅为0.3%,相对较低[20-21]。危重症COVID-19 患者有74.2%出现心电图异常[22]。本组研究显示,危重症COVID-19 患者心电图异常发生率为64.3%。与存活组比较,死亡组异常心电图及室性心律失常比例显著升高,推测可能与死亡组有更高比例的心肌损伤有关。ST 段改变、QT 间期延长、房性及室性心律失常均是影响COVID-19 患者临床预后重要因素,心电图存在这些改变时应及时关注心肌损伤标志物,尽早干预治疗。
常用心肌损伤标志物有心肌蛋白和心肌酶。心肌蛋白包括肌钙蛋白(TnT、TnI)和MYO,心肌酶包括CK、CK-MB、AST、LDH。本组研究显示,危重症COVID-19 死亡患者心肌损伤标志物与存活患者相比明显升高,且Hs-TnI >0.04 μg/L,MYO >100 μg/L 是危重症COVID-19 患者死亡的独立危险因素。有研究表明,当Hs-TnI、MYO 和CK-MB 升高超过临界值时,对重症COVID-19 患者有死亡预警作用[23]。本组患者使用ROC 曲线分析显示:Hs-TnI、CK-MB、MYO 对危重症COVID-19 患者死亡风险评估具有较好的预测作用。因此在危重症COVID-19 患者诊治过程中,应动态监测心肌损伤标志物,及早发现预警信息,对心肌损伤及时干预治疗,以降低死亡风险,改善预后。
本研究有一定的局限性。首先,本研究设计为单中心回顾性研究,样本量小,可能需要多中心大样本资料进一步确定COVID-19 患者的死亡独立危险因素。其次,大多数患者没有24 h 动态心电图及超声心动图数据,对COVID-19 患者相关心律失常及心脏功能改变有待进一步更详细的研究。
综上所述,危重型COVID-19患者合并心肌损伤时病死率更高。Hs-TnI >0.04 μg/L、MYO >100 μg/L、WBC >9.5 × 109/L 是危重症COVID-19 患者死亡的独立危险因素。Hs-TnI、CK-MB、MYO 等心肌损伤标志物对危重型COVID-19 患者死亡风险评估具有较好的预测意义。

