左卡尼汀治疗顽固性血液透析相关性低血压的时机研究
范春琴,夏志银,马玉华,李湘鸣,曹红梅,胡春红
1.扬州大学附属医院,江苏225000;2.扬州大学医学院
血液透析相关性低血压(intradialytic hypotension,IDH)是血液透析(hemodialysis,HD)过程中最常出现的并发症,发生率为20%~30%[1]。IDH 的发生不仅会影响HD 效果,还会导致重要脏器灌注不足。目前,临床常采用降低透析液温度、提高透析液钠浓度、减少超滤量、补充高渗液体等方法纠正透析中的低血压症状,但部分病人经上述方法处理后仍会出现顽固性低血压,从而导致HD 不能正常进行,对维持性血液透析(maintenance hemodialysis,MHD)病人的生存质量和预后产生很大影响[2]。多项研究显示:在HD 结束后补充左卡尼汀对IDH 有一定改善作用[3‐5],但临床观察结果显示,该方法对部分IDH 病人治疗效果不佳。故本研究选取20 例顽固性IDH 病人,观察左卡尼汀给药时机对IDH 治疗效果的影响,现报道如下。
1 对象与方法
1.1 研究对象 选择2016 年1 月—2018 年12 月扬州大学附属医院血液净化中心MHD 治疗时间>6 个月的顽固性IDH 病人作为研究对象。纳入标准:①MHD 后1 个月内出现低血压次数>个人总透析次数的50%[6];②在MHD 期间,收缩压下降>20 mmHg(1 mmHg=0.133 kPa)或收缩压<90 mmHg 或平均动脉压降低>10 mmHg,并伴有头晕眼花、大汗淋漓、恶心呕吐等低血压及肌肉痉挛症状[7];③经降低透析液温度、提高透析液钠浓度、减少超滤量或补充高渗液体等处理后低血压症状仍不能改善。排除标准:①MHD后1 个月出现低血压次数<个人总透析次数的50%或体重增长>干体重的5%;②患有心脑血管疾病、恶性肿瘤或存在严重感染、急慢性出血、中重度贫血、低蛋白血症、血糖控制不良症状;③对左卡尼汀有不良反应;④MHD 前服用降压药物或肾上腺受体激动剂。共 纳 入20 例 病 人,男10 例,女10 例;年 龄32~70(49.3±7.3)岁;MHD 时间为11~261(96.2±64.3)个月;原发病为慢性肾小球肾炎9 例,高血压肾损害4 例,多囊肾2 例,糖尿病肾病1 例,原因不明4 例;采用血管通路为自体动静脉内瘘19 例,半永久性深静脉置管1例。研究经我院伦理委员会批准(审查号为2019‐YKL‐02‐22),并经病人知情同意。
1.2 研究方法
1.2.1 药物及设备 包括由常州兰陵制药有限公司生产的左卡尼汀注射液(产品批号:21807180),由广州贝恩医疗设备有限公司生产的德朗空心纤维血液透析器(规格:B‐16P),由上海费森医药用品有限公司生产的血液透析滤过器(规格:Fx80),由大连有限公司生产的欧姆龙电子血压计(规格:OmRon‐1100),由上海耀华称重系统有限公司生产的体重测量仪器(规格:XK3190‐A12+E)。
1.2.2 透析方法 病人每周透析3 次,连续3 个月为1个疗程。透析处方:透析血流量为200~250 mL/min,碳酸氢盐透析液流量为500 mL/min,透析液离子浓度为Na+138.0~142.0 mmol/L、K+2.0 mmol/L、Ca2+1.5 mmol/L,透析温度为36.5~37.0 ℃,抗凝剂选用低分子肝素60~80 IU/kg,每次超滤量为1.0~3.0 kg。透析前嘱病人进食软食、不可过饱,透析期间提高透析液钠浓度、降低透析液温度,观察病人动脉压、静脉压、跨膜压变化。
1.2.3 干预方法 为避免个体差异对研究结果的影响,采用自身前后对照方法进行研究。首先采用传统方法对病人进行干预,即每次透析后取左卡尼汀2 g,加入10 mL 生理盐水溶解,静脉缓慢推注,于3~5 min完成,3 个月为1 个疗程。左卡尼汀平均血液清除半衰期约为17 h[8],故病人第1 疗程结束2 周后进行第2 疗程时,可改用新方法进行干预,即透析前取左卡尼汀2 g,加入10 mL 生理盐水溶解,静脉缓慢推注,于3~5 min 完成,3 个月为1 个疗程。
1.3 评价指标 ①生化指标:于病人透析前、第1 个疗程结束后和第2 个疗程结束后采集病人血液样本,由本院中心化验室检测血液中肌酐(Scr)、尿素氮(BUN)、血 红 蛋 白(Hb)、清 蛋 白(ALB)、钾(K+)、钙(Ca2+)、磷(P3+)等含量和尿素氮清除效率(Kt/V)。②血压:用电子血压计测量病人第1 个疗程透析时和第2 个疗程透析时非内瘘侧上臂卧床收缩压和舒张压数值,测量时间点为透析前、透析过程中及透析后,其中,透析过程中每小时均需测量1 次,至少测量4 次。③超滤量及干体重达标率:记录病人每次透析前、透析后体重,其间注意记录病人有无大便及增减衣物,以确保体重数据的准确性。通过体重计算病人超滤量,超滤量(kg)=透析前体重(kg)-透析后体重(kg)。病人没有水肿,且体内钠、水含量或其他重要组成成分含量降低到再低一点,就会出现低血压症状,此时的体重为达标干体重。干体重达标率(%)=干体重达标例次数/透析总例次×100%。④IDH 及肌肉痉挛症状发生情况:记录病人第1 个疗程最后1 个月透析时和第2 个疗程最后1 个月透析时出现头晕眼花、大汗淋漓、恶心呕吐等低血压及肌肉痉挛症状的情况。IDH 发生率(%)=IDH 发生例次数/透析总例次×100%;肌肉痉挛发生率(%)=肌肉痉挛发生例次数/透析总例次×100%。
1.4 统计学方法 采用SPSS 18.0 统计软件对数据进行处理,定量资料以均数±标准差(±s)表示,计数资料用频数或百分率(%)表示。3 组间定量资料比较采用重复测量方差分析,两组间定量资料比较采用双因素方差分析,计数资料组间比较采用配对χ2检验(McNemar 法)。显著性水平α=0.01。
2 结果
2.1 病人治疗前后血生化指标比较(见表1)
表1 病人治疗前后血生化指标比较(±s)

表1 病人治疗前后血生化指标比较(±s)
时间透析前第1 个疗程第2 个疗程F 值P例数20 20 20 Scr(μmol/L)863.25±202.46 893.50±259.37 979.88±224.32 3.125 0.055 BUN(mmol/L)22.03±6.78 21.64±6.75 23.15±5.67 0.697 0.504 Hb(g/L)114.70±11.58 121.60±18.51 122.10±15.92 3.107 0.056 Alb(g/L)43.11±2.93 44.19±2.83 44.30±3.94 1.603 0.215 K+P3+(mmol/L)4.47±0.45 4.81±0.50 4.64±0.53 2.364 0.103 Ca2+(mmol/L)2.13±0.26 2.26±0.27 2.18±0.67 0.422 0.659(mmol/L)2.03±0.33 2.02±0.49 1.99±0.60 0.081 0.922 Kt/V 1.15±0.21 1.19±0.27 1.20±0.35 0.501 0.610
2.2 病人2 个疗程血压及超滤量比较 表2 显示:病人第2 个疗程透析前收缩压[(113.95±17.06) mmHg]低于第1 个疗程透析前收缩压[(117.30±18.42)mmHg],而病人第2 个疗程透析前舒张压[(70.76±10.74)mmHg]高于第1 个疗程透析前舒张压[(69.52±9.75)mmHg],两个疗程收缩压和舒张压分别相差约3 mmHg 和1 mmHg,虽然差异有统计学意义(P<0.05),但临床意义不大。病人第2 个疗程最低血压收缩压[(101.29±13.81)mmHg]和最低舒张压[(64.31±8.41)mmHg]高于第1 个疗程[最低收缩压为(94.71±13.44)mmHg,最 低 舒 张 压 为(60.31±8.45)mmHg],两个疗程最低收缩压和最低舒张压分别相差约7 mmHg和4 mmHg,差异有统计学意义(P<0.05)。且病人第2 疗 程 超 滤 量[(3.00±0.56)kg]也 较 第1 疗 程[(2.27±0.61)kg]明显增加,约1 kg,差异有统计学意义(P<0.05)。说明透析前给予病人左卡尼汀可能对低血压水平的控制效果优于透析后给药。
表2 MHD 伴IDH 病人2 个疗程血压及超滤量比较(±s)

表2 MHD 伴IDH 病人2 个疗程血压及超滤量比较(±s)
时间第1 个疗程第2 个疗程F 值P例数20 20透析前收缩压(mmHg)117.30±18.42 113.95±17.06 12.219<0.001透析前舒张压(mmHg)69.52±9.75 70.76±10.74 3.945 0.048最低收缩压(mmHg)94.71±13.44 101.29±13.81 46.151<0.001最低舒张压(mmHg)60.31±8.45 64.31±8.41 38.790<0.001超滤量(kg)2.27±0.61 3.00±0.56 14.540<0.001
2.3 病人2 个疗程最后1 个月透析时IDH 及肌肉痉挛发生率比较(见表3)
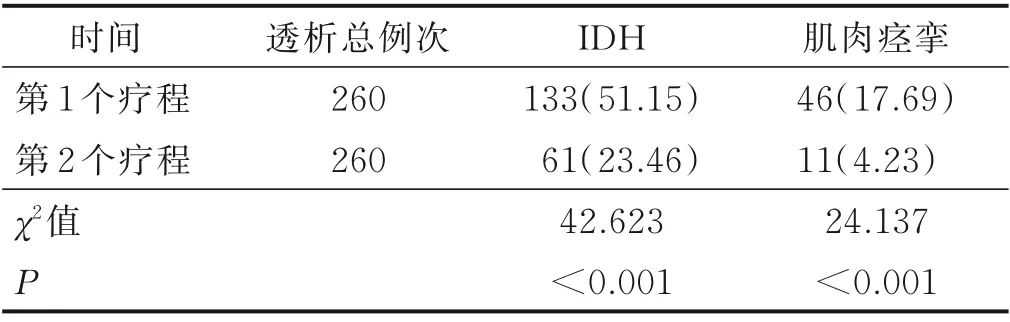
表3 病人2 个疗程最后1 个月透析时IDH及肌肉痉挛发生率比较 单位:例次(%)
2.4 病人2 个疗程干体重达标率比较(见表4)

表4 病人2 个疗程干体重达标率比较 单位:例次(%)
3 讨论
近年来,MHD 技术有了很大进展,但MHD 病人中IDH 发生率仍较高,且随着MHD 病人老龄化、高血压和糖尿病肾病病人增加,IDH 发生率呈进一步增高趋势。IDH 的发生会直接影响透析病人目标超滤量和超滤时间,导致透析不充分,增加透析病人死亡危险[1,9]。因此,减少MHD 病人IDH 发生与降低临床不良事件是医护人员关注的问题。
HD 病人因饮食受限,摄入减少,肾脏合成不足,加之受透析清除的影响,普遍存在肉碱缺乏。肉碱是哺乳动物能量代谢的必须物质,参与脂肪酸的氧化。左卡尼汀又名左旋肉碱,可缓解代谢中的组织缺氧状态,辅助酯酰辅酶A 进入线粒体参与三羧酸循环,其作为代谢必需物质可提供能量,改善血管壁平滑肌细胞和心肌细胞的能量供应,使血管壁反应性进一步提高,心肌收缩力明显增强[10]。左卡尼汀也可促进红细胞向组织内释放更多氧,有效改善心肌细胞功能,提高心肌抗缺氧能力,并可改善肺功能,提高病人透析治疗耐受性[11]。
研究发现,MHD 病人透析后左卡尼汀的常规用量为每次1~2 g[10],而左卡尼汀改善心脏功能的最低有效剂量为2 g[12‐13]。透析后给予病人左卡尼汀对低血压有一定改善作用,但受药物半衰期、机体代谢影响,部分病人透析目标超滤量、超滤时间仍无法达标,而透析前给予病人最低有效剂量的左卡尼汀能够提高病人血浆中游离左卡尼汀浓度、减轻因脂肪酸堆积导致的酸中毒,使病人心脏抗缺血、缺氧能力增加,射血分数与血管反应性提高,从而改善病人血流动力学,降低透析中肌肉痉挛和低血压发生率,保证病人4 h 充分透析。因此,本研究选择20 例MHD 伴IDH 病人作为研究对象,分别于透析前和透析后静脉补充左卡尼汀2 g,治疗时间3 个月,结果发现:透析前静脉输注左卡尼汀与透析后静脉输注左卡尼汀相比,病人IDH 发生率减少27.69%,肌肉痉挛发生率下降13.46%,同时其超滤量和干体重达标率提高。进一步对病人进行分析,发现透析前静脉输注左卡尼汀后均未发现病人过敏、发热、休克、昏迷和惊厥等严重不良反应,但部分病人低血压改善效果不明显,这可能与部分病人年龄较高、合并糖尿病、冠心病、心功能低下有关。
4 小结
总之,对于顽固性IDH 病人采用透析前单次静脉推注左卡尼汀,可在保证病人安全的基础上显著降低病人IDH 发生率和肌肉痉挛发生率,提高病人超滤量和干体重达标率,其间部分IDH 病人效果不明显,原因可能与观察时间较短、病人高龄、超滤率过高、合并糖尿病及心功能低下等有关,今后需进一步探讨。

