结构新型促胰岛素分泌肽的聚乙二醇修饰及生物活性研究
刘 东,任崇飞,杨欣茹,李铁健,张贵民,2*
0 引言
糖尿病(Diabetes mellitus,DM)已成为严重威胁人类健康的内分泌疾病[1]。目前,世界上2型糖尿病患者已超过4亿,预计到2045年2型糖尿病患者将增加到6亿。长期以来,DM患者主要通过注射胰岛素及口服4大类降糖药来控制血糖。胰高血糖素样肽(GLP-1)类多肽药物是治疗2型糖尿病的重要药物,GLP-1受体激动剂类药物不良反应小,可弥补口服降糖药物不良反应较大的不足[2]。
PEG是以-CH2CH2O-为基础结构的大分子线性或分枝状多聚物。PEG修饰又称PEG化,影响蛋白质或多肽的空间结构,改变其各种生物和化学性质,包括化学稳定性增加,抵抗酶水解的能力提高,免疫原性和毒性降低,体内半衰期延长等。PEG修饰可实现蛋白质药物在体内的长效性,是现代生物制药的发展趋势之一。GLP-l类多肽的PEG修饰已成为开发长效糖尿病药物的重要途径。聚乙二醇化促胰岛素分泌肽类似物属于新一代的GLP-1类似物药物,具有降低免疫原性、提高多肽活性保留率、减小给药量、长效、安全性高的特点,在作用机制上优于传统糖尿病药物,为2型糖尿病治疗带来创新性发展[3-4]。
本研究依据艾塞那肽(Exenatide)的39肽结构设计,将其C端的非活性中心的刚性氨基酸结构替换为柔性的氨基酸交联区和1个半胱氨酸,得到了一种新的GLP-1类似物氨基酸序列多肽(代号:DT1),实现了免疫原性降低(DT1不含刚性氨基酸结构),同时保留了生物活性,柔性结构的氨基酸连结肽又可提高PEG修饰后多肽与受体的结合能力[5]。以筛选得到的GLP-1类似物DT1为活性结构基础,选择20 kDa分子量单马来酰亚胺单甲氧基PEG(20k-mPEG-MAL)、40 kDa分子量单马来酰亚胺单甲氧基PEG(40k-mPEG-MAL)和35 kDa分子量双马来酰亚胺无单甲氧基PEG(35k-PEG-Di-MAL)3种修饰剂对DT1进行PEG修饰化研究。使用SP阳离子交换柱和C18柱分离纯化3种修饰物[6],纯化后色谱纯度大于99.0%。此外,通过体内外活性测定,初步研究不同PEG修饰化对活性的影响,分析PEG化促胰岛素分泌肽类似物同源二聚体PEG-Di-DT1的特性。
1 仪器与试药
1.1 仪器 Thermo Ultimate3000高效液相色谱仪,美国赛默飞世尔科技;AKTE Purifier纯化系统,GE Health公司;制备高效液相色谱仪,北京创新通恒科技有限公司;MCO175-CO2培养箱,SANYO公司;MAX190酶标仪,MOLECULAR DEVICES公司;Safire2多功能酶标仪,瑞士TECAN公司;Hofer Mighty Slim电泳系统,美国GE公司;PL5234纯水仪,美国Pall公司;Mini-Protein 蛋白电泳仪和电泳槽,美国Bio-Rad公司;ChampGel5000凝胶分析系统,北京赛智创业科技有限公司。
1.2 试剂 GLP-1类似物氨基酸序列多肽(代号:DT1)和艾塞那肽(Exenatide)为本公司自制,纯度在98.0%以上;20 kDa、40 kDa的MAL-mPEG(单马来酰亚胺活化PEG),35 kDa的Di-MAL-PEG(双马来酰亚胺活化PEG)购于北京键凯科技有限公司;小鼠胰岛瘤细胞RIN-m5F购于美国菌种保藏中心ATCC;胎牛血清、RPMI 1640培养液,美国HyClone公司;3-异丁基-1-甲基黄嘌呤(IBMX),阿拉丁公司;胰蛋白酶,BIC BASIC公司;cAMP-ELISA试剂盒,美国R&D公司;其他试剂购于上海生工生物工程技术服务有限公司。
6~8周龄,SPF级db/db小鼠,雌雄各半;6~8周龄,SPF级db/m小鼠,雌雄各半。所有小鼠均由北京华阜康生物科技股份有限公司提供。
2 方法与结果
2.1 HPLC检测色谱条件[7]色谱柱型号为资生堂CAPCELL PAK C18(4.6 mm×150 mm,5 μm);流动相:以0.045%三氟乙酸-水溶液为流动相A,0.036%三氟乙酸-乙腈溶液为流动相B,梯度洗脱程序见表1。柱温30 ℃,检测波长214 nm;进样量为2 μl;流速1 ml/min。

表1 梯度洗脱程序
2.2 GLP-1类似物多肽的结构设计和制备
2.2.1 多肽的结构设计 多肽的氨基酸序列系参照上市Exenatide的39肽结构,设计将Exenatide的C端8个刚性结构氨基酸(SSGAPPPS)替换,通过计算机辅助设计对比分析GLP-1类似物多肽和Exenatide与受体之间的相互作用。
经计算机模拟分析,筛选得到Exenatide的C端8个刚性结构氨基酸(SSGAPPPS)替换为6个柔性的氨基酸Linker和1个半胱氨酸(GGTGGSC),成为由38个氨基酸组成的促胰岛素分泌肽类似物(DT1)(图1)。

图1 多肽结构设计图
2.2.2 DT1多肽的制备 DT1多肽采用Fmoc固相合成法合成。利用HOBt法活化氨基酸,按照序列连接到氨基树脂上,共进行38步合成。合成结束后,得到带侧链保护基的多肽树脂。按13 ml/g肽树脂,加入裂解试剂TFA/水/TIS/EDT=94∶2∶2∶2(V/V),恒温25 ℃下,搅拌反应4 h,过滤、合并收集液。搅拌下滴加冰乙醚(-10 ℃),得到白色沉淀,过滤,用少量冰乙醚洗涤粗品,并将粗品放入真空干燥器中干燥过夜,得DT1粗肽。
DT1粗肽经HPLC反相纯化,采用梯度洗脱,收集主峰纯度大于98.0%的流出液,得制备洗脱液。收集的制备洗脱液经浓缩冻干,得到DT1产品,纯度大于98.0%(图2)。
以阅读积分来量化读者的某段时间的阅读量,并借助平台以软件的形式进行记录,可以读者的平均积分、某一阶段的平均积分的增量、最高积分等指标对阅读推广活动的效果进行科学的评估,既简单易行又科学合理。另外,还可以增加阅读积分制执行力,并将阅读推广的活动以积分的形式来进行统计,如读者的借阅量、阅读量等,并且可以凭借阅读积分制有效的考评阅读推广活动的效果。

图2 DT1纯化检测图
2.3 PEG对DT1的Cys定点修饰及纯化[8-11]
PEG修饰剂选择:20 kDa、40 kDa的MAL-mPEG,35 kDa的Di-MAL-PEG,分别按20.0 mg/ml溶解于50 mmol/L醋酸铵缓冲液中(pH 6.5),室温搅拌条件下,分别逐渐加入纯度高于98%的DT1多肽,结合HPLC检测,调整DT1∶PEG两者的摩尔比。反应4 h后,HPLC检测PEG偶联DT1达到85% 以上(图3),加入l% 的TFA终止反应。

图3 DT1多肽35k-PEG-Di-MAL修饰检测图
修饰反应终止液用SP柱除去未修饰的多肽和使用C18柱纯化分离除去游离的PEG修饰剂、PEG-mono-DT1和其他杂质,20k-mPEG-DT1、40k-mPEG-DT1和PEG-Di-DT1经非还原型SDS-PAGE纯度测定和MALDI-TOF法测定分子量,均与理论分子量一致。图4为MALDI-TOF法测定PEG-Di-DT1的质谱分子量为42 613 Da,与修饰物的理论分子量43 kDa一致。3种PEG修饰物非还原SDS-PAGE纯度均大于99.0%,仅含有0.5%左右的高分子蛋白杂带。将纯化后的20k-mPEG-DT1、40k-mPEG-DT1和PEG-Di-DT1分别冻干保存。
2.4 样品体外生物活性测定与结果
2.4.1 DT1、Exenatide样品配制 精确称取DT1、Exenatide干粉各10 mg,用无菌注射用水分别溶解精确配成0.1 mg/ml;乘以定氮法测定的多肽百分含量后,用样品稀释液逐步稀释至100 ng/ml,再按2倍倍比稀释,共设8个稀释度:100、50、25、12.5、6.25、3.12、1.56、0.78 ng/ml。
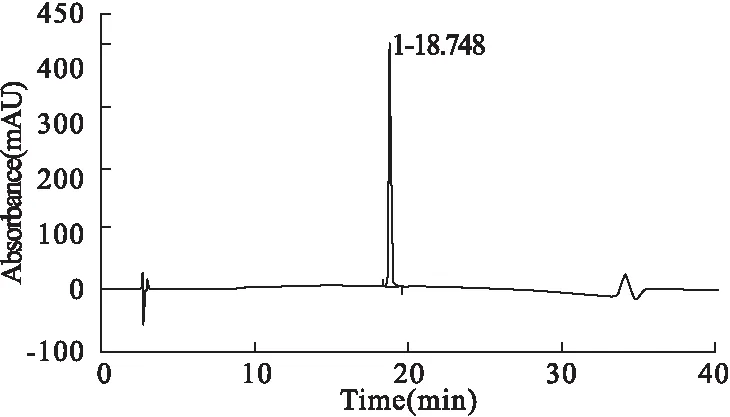
图4 PEG-Di-DT1纯化检测图
2.4.2 待测PEG修饰样品的配制 精确称取20k-mPEG-DT1、40k-mPEG-DT1和PEG-Di-DT1各10 mg,用无菌注射用水溶解精确配成0.5 mg/ml;用样品稀释液逐步稀释至2 600 ng/ml,再按2倍倍比稀释,共8个稀释度:2 600、1 300、650、325、162.5、81.2、40.6、20.3 ng/ml。
2.4.3 生物活性测定方法[12]取生长状态良好的RIN-m5F细胞消化后,细胞计数5×105~8×105个/ml,37 ℃培养18~36 h;用0.25%胰酶消化,按3.5×105个/ml,接种入24孔细胞板,每孔0.5 ml,置37 ℃、5%CO2继续培养24~36 h。弃细胞液,加入细胞维持液,即含5 mg/ml牛血清白蛋白的RPMI 1640培养液,1.0 ml/孔,37 ℃、5%CO2培养15 min。弃上清液,加入含1 mM的IBMX细胞维持液,0.9 ml/孔,37 ℃、5%CO2培养15 min。尽可能快地加入0.1 ml/孔待测样品,轻振荡混匀后,37 ℃、5%CO2继续培养15 min。取出细胞培养板置于冰上,弃上清液,加入1.0 ml/孔预冷的PBS洗2次,弃PBS。每孔加入300 μl细胞裂解液,-80 ℃和37 ℃反复冻融2次,每次30 min。吸出细胞裂解液,12 000 r/min离心10 min,参照cAMP-ELISA试剂盒检测说明书,取上清液用于OD值测定。
2.4.4 体外生物活性结果 体外活性检测结果显示,DT1和Exenatide具有相似的促RIN-m5F细胞产生cAMP作用。在相同浓度下,测定其刺激RIN-m5F细胞中cAMP的ED50分别为0.39、0.56 ng/ml。见图5。

图5 DT1和Exenatide促RIN-m5F细胞产生cAMP作用
待测PEG修饰样品的体外活性测定结果显示(图6):20k-mPEG-DT1、40k-mPEG-DT1和PEG-Di-DT1在相同浓度下,其刺激RIN-m5F细胞中cAMP的ED50分别为20.65、87.49、14.76 ng/ml,按定氮法测定的肽含量计,分别为3.51、7.97、2.74 ng/ml。随着PEG修饰分子量的增加(20 kDa至40 kDa),生物活性保留从12%降低为5%;而PEG同源二聚体PEG-Di-DT1比单修饰40k-mPEG-DT1活性高3倍,活性保留率为15%[13],与20k-mPEG-DT1活性相近,半衰期约为14 h,与Exenatide半衰期(约2 h)相比具有明显优势。

图6 PEG修饰物促RIN-m5F细胞产生cAMP作用
2.5.1 动物分组、给药及血糖测定 将100只db/db自发性糖尿病小鼠,随机分为5组:①模型组;②Exenatide组,5 μg/kg;③高剂量样品组,45 μg/kg;④中剂量样品组,15 μg/kg;⑤低剂量样品组,5 μg/kg。每组20只,雌雄各半。20只db/m小鼠作为正常对照组小鼠[14]。
6组小鼠经皮下注射给药1次,按照10 ml/kg体积注射,对照组和模型组使用生理盐水,Exenatide组以5 μg/kg量注射Exenatide,样品组按设计量注射PEG-Di-DT1样品给药后,对所有小鼠采血,检测空腹(0.5~12 h)和正常进食后(24~72 h)血糖。测定受试药及阳性药单次给药后的降糖作用强度和持续时间。
2.5.2 单次给药对血糖影响的时效关系 以时间为横坐标,血糖值为纵坐标,绘制各组的血糖平均值-时间效应曲线(样品组为高剂量组),确定药物降糖作用峰值时间(图7)。

图7 血糖-时间效应曲线
试验结果显示,与模型组相比,阳性药Exenatide及PEG-Di-DT1皮下注射给药0.5 h后即可显著降低血糖水平,Exenatide单次给药的降糖作用可维持6 h,而PEG-Di-DT1高、中剂量组单次给药72 h后,血糖水平仍明显低于模型组(P<0.05)[15]。与模型组相比,PEG-Di-DT1低剂量组自给药2~36 h内具有明显的降低血糖作用(P<0.01)。PEG-Di-DT1的降血糖作用具有明显的剂量依赖性。DT1多肽的质量和体内外活性不低于上市药物Exenatide,且有明显提高。
2.6 PEG-Di-DT1修饰剂条件研究与结果
2.6.1 修饰比例优化 本研究中,PEG-Di-DT1采用的修饰剂为mal-PEG-35k-mal(图8),能单一定向与DT1多肽C末端Cys的游离巯基发生共价偶联反应。DT1多肽与mal-PEG-35k-mal不同的修饰摩尔比,对修饰率及修饰终产物比例都有较大影响。
DT1多肽用50 mmol/L CH3COONa-CH3COOH缓冲液(pH 6.0)溶解为1.0 mg/ml,按摩尔比3∶1~1∶1(DT1多肽∶mal-PEG-35k-mal修饰剂)分别补入mal-PEG-35k-mal修饰剂,25 ℃反应4 h,取各修饰产物进行RP-HPLC分析。

图8 PEG-Di-DT1修饰图
理论上DT1多肽与mal-PEG-35k-mal的饱和偶联反应摩尔比为2∶1。分析结果见表2,当DT1与mal-PEG-35k-mal反应摩尔比为2.5∶1~2∶1时,达到75%以上修饰,反应摩尔比为2.2∶1时,双修饰目标产物PEG-Di-DT1的产物比例达到85%以上。
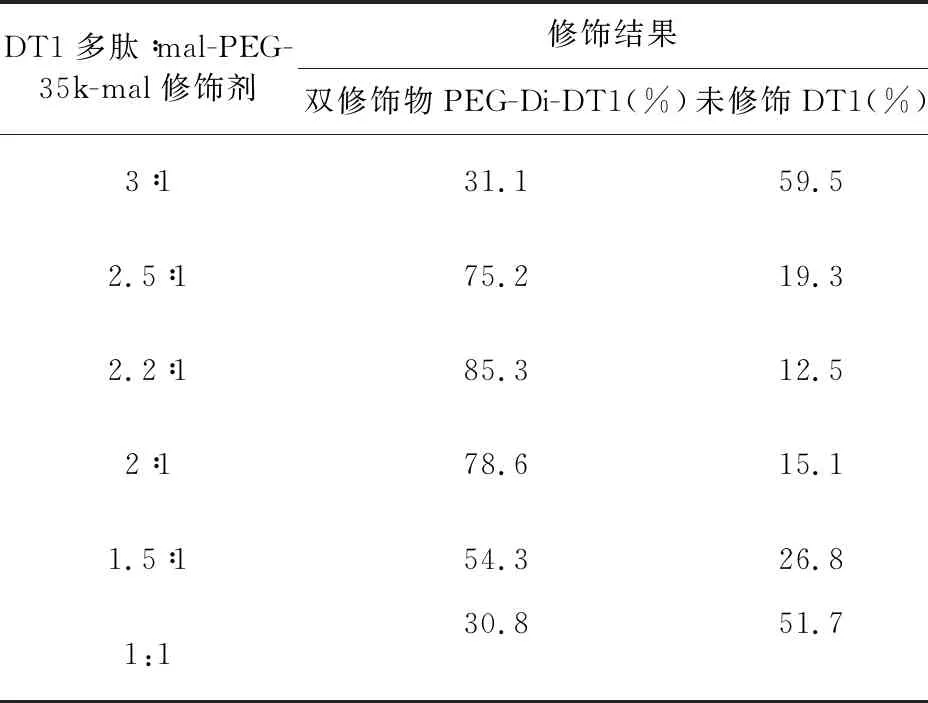
表2 修饰比例与结果
2.6.2 修饰缓冲pH条件 mal-PEG-35k-mal修饰剂的最适偶联反应pH范围为4.0~7.0[16]。当pH过高时,mPEG-mal有非特异性与Lys的ε氨基偶联反应的风险,造成修饰位点不均一。此外,DT1多肽在pH大于7.0的缓冲中易形成自身二聚体,该二聚体不能与mal-PEG-35k-mal发生偶联反应。DT1多肽分别用pH值为4.0、5.0、6.0、7.0的50 mmol/L CH3COONa-CH3COOH缓冲液溶解为1.0 mg/ml,按摩尔比2.2∶1(DT1多肽∶mal-PEG-35k-mal修饰剂)分别补入mal-PEG-35k-mal修饰剂,25 ℃反应4 h,取各修饰产物进行RP-HPLC分析。由表3可见,修饰反应缓冲的pH值为4.0、5.0时的修饰率低于pH值为6.0、7.0时,研究发现,PEG-Di-DT1在高pH缓冲条件下不稳定,从提高修饰率、增加PEG-Di-DT1的稳定性以及防止非特异性偶联产物这三方面综合考虑,选择pH 6.0的缓冲液作为修饰反应缓冲。

表3 pH值与修饰结果
2.6.3 修饰缓冲盐条件 考察在pH 6.0时具有较强缓冲能力的缓冲体系,包括:NaH2PO4-Na2HPO4缓冲体系、CH3COONa-CH3COOH缓冲体系,对DT1多肽与mal-PEG-35k-mal修饰剂偶联反应的影响。DT1多肽用pH 6.0的50 mmol/L CH3COONa-CH3COOH缓冲液和50 mmol/L NaH2PO4-Na2HPO4溶解为1.0 mg/ml,按摩尔比2.2∶1(DT1多肽∶mal-PEG-35k-mal修饰剂)分别补入mal-PEG-35k-mal修饰剂,25 ℃反应4 h,取各修饰产物进行RP-HPLC分析。结果显示,在50 mmol/L CH3COONa-CH3COOH修饰体系中,主要修饰产物色谱峰为双修饰目的产物PEG-Di-DT1占80.7%。在50 mmol/L NaH2PO4-Na2HPO4修饰体系,主要修饰产物色谱峰同样为双修饰目的产物PEG-Di-DT1占78.6%。结合PEG-Di-DT1稳定性研究和下游制备纯化需要,最终选择pH 6.0的CH3COONa-CH3COOH缓冲作为修饰反应的缓冲液体系。
2.6.4 修饰浓度条件 除了多肽与PEG的修饰比例可影响PEG修饰效率外,偶联反应时多肽的浓度同样影响PEG修饰效率。一般情况下,在固定修饰摩尔比例的前提下,多肽浓度越高,PEG修饰效率越高。优化修饰时DT1多肽的浓度,达到提高修饰效率、降低修饰成本的目的。DT1多肽用pH 6.0的50 mmol/LC H3COONa-CH3COOH缓冲液分别溶解为1.0、2.0、3.0 mg/ml,按摩尔比2.2∶1(DT1多肽:mal-PEG-35k-mal修饰剂)分别补入mal-PEG-35k-mal修饰剂,25 ℃反应4 h,取各修饰产物进行RP-HPLC分析。结果表明,DT1多肽浓度为1.0、2.0、3.0 mg/ml的修饰体系中,主要修饰产物均为双修饰物PEG-Di-DT1,修饰产物比例基本一致,分别为85.2%、84.5%、83.9%。随着DT1多肽浓度的增加,其修饰产物的黏度明显增加,双修饰产物比例下降,最终选择1.0 mg/ml作为DT1多肽PEG修饰反应的浓度。
3 讨论
本研究在设计筛选的DT1基础上,对其C末端半胱氨酸进行定向PEG修饰,并测定了修饰物的生物活性,最终得到新型聚乙二醇化同源二聚体偶联的促胰岛素分泌肽类似物PEG-Di-DT1。PEG-Di-DT1为DT1经35k-PEG-Di-MAL同源双肽修饰纯化而得。PEG-Di-DT1属于PEG化长效药物,作为亲水性大分子的PEG,能够屏蔽DT1多肽的免疫位点,可降低其免疫原性,DT1多肽中改造了艾塞那肽的8个非活性中心非天然的刚性序列,同样可减少多肽引入的免疫原性,同时,双活化无单甲氧基PEG修饰剂的使用和独特的修饰方式,产品的体内外生物活性保留率高,结构中PEG-Di-MAL分子不含有单甲氧基,也具有更低的免疫原性。预计比已上市3种同类产品Byetta、Bydureon和Victoza在人体内抗体产生率和滴度更低。
双马来酰亚胺无单甲氧基PEG修饰方式独特新颖,未见其他研究文献。PEG修饰样品的活性测试表明,随着修饰PEG分子质量的增加,虽然偶联物的半衰期延长,活性保留却降低,但新型 PEG修饰同源二聚体35k-PEG-Di-DT1比单修饰40k-mPEG-DT1活性高3倍,活性保留率还高于20k-mPEG-DT1。在同等给药剂量(以多肽计)下,PEG-Di-DT1和Exenatide皮下注射给药0.5 h后即可显著降低血糖水平。在长效性对方面,Exenatide单次给药的降糖作用只维持6 h,PEG-Di-DT1组单次给药72 h后,仍可降低db/db小鼠的血糖水平。PEG-Di-DT1具有良好的体内外生物活性和更低的免疫原性,有潜力成为治疗人2型糖尿病的长效药物,至少可实现人体内皮下7 d给药1次的治疗目的。

