纳米氧化锌对两种蔬菜种子发芽及幼苗生长的影响
林茂宏,沈玫玫,吴佳妮,陈慧玲,徐艺萌,刘维涛*
(1.佛山市环境保护投资有限公司,广东 佛山 528051;2.南开大学环境科学与工程学院污染过程与基准教育部重点实验室/天津市跨介质复合污染环境治理技术重点实验室,天津 300350)
纳米材料(Nanomaterials,NMs)是指至少有一维几何尺寸处于纳米尺度范围内(1~100 nm)的物质,具有比表面积大和表面能高等特点[1-2]。其中,金属型纳米颗粒(Metal-based nanoparticles,MB NPs)是极其重要的一类纳米材料,具有金属材料和纳米材料的双重特性,包括典型的零价金属纳米颗粒和金属氧化物颗粒等[3-4]。
纳米氧化锌颗粒(ZnO NPs)广泛应用于塑料、陶瓷、玻璃、水泥、橡胶、电池、防火阻燃剂、化妆品和传感器等领域[5]。据估计,全球每年ZnO NPs 的生产量约为550~33 400 t,是应用量居第三位的金属型纳米材料[6]。ZnO NPs 一般通过农业化学品的施用、大气沉降、降水和灌溉等途径进入土壤[7-8]。ZnO NPs 在土壤中的迁移能力较小,最终导致其在土壤中的浓度远高于大气和水体[9],并可被植物吸收和积累,影响植物生长甚至通过食物链威胁人体健康[10-11]。
目前,ZnO NPs 对植物的毒理学效应尚未明确[6],甚至出现截然不同的研究结果[12]。ZnO NPs对瓜儿豆(Cyamopsis tetragonoloba)的生物量、茎长、根长、根面积、叶绿素含量和叶总可溶性蛋白具有显著的促进作用[13]。亦有研究表明ZnO NPs 提升了香菜(Corian⁃drum sativum)光合色素含量[8]和莴苣(Lactuca sativa)的生物量及净光合速率[14]。然而,相关研究证实ZnO NPs及其释放出来的Zn2+对植物具有一定的毒性[15]。ZnO NPs显著降低了芥菜(Brassica juncea)的生物量,且造成其根、茎和叶的氧化损伤[16]。Zhang 等[15]研究揭示ZnO NPs 显著降低了玉米(Zea mays)和黄瓜(Cucumis sati⁃vus)的根长,但对种子发芽率无显著影响。此外,ZnO NPs 降低了80%的根和地上部生物量,ZnO NPs的毒性小于ZnCl的毒性[17]。
种子萌发是植物生命周期的一个关键时期,也是对外界环境因子最敏感的时期之一[18],开展种子发芽试验有望初步评估污染物对植物的毒理学效应。尽管针对ZnO NPs 的种子发芽试验已有报道,但主要集中于水稻(Oryza sativa)[19]、小麦(Triticum aestivum)[20]、玉米(Zea mays)[15]、油菜(Brassica napus)[21]和豇豆(Vi⁃gna unguiculate)[22]等作物,而对于根菜类蔬菜樱桃萝卜(Raphanus sativusL.)和叶菜类蔬菜小白菜(Brassi⁃ca chinensisL.)的种子发芽试验研究相对较少。因此,本研究选取在我国广泛种植的樱桃萝卜和小白菜作为供试作物,通过种子发芽试验探究ZnO NPs 和ZnSO4对两种蔬菜作物种子萌发及幼苗生长的影响,以期为今后ZnO NPs 的毒理学效应、环境应用及其风险评估提供一定的理论依据。
1 材料与方法
1.1 试验材料
本试验于南开大学环境科学与工程学院污染过程与基准教育部重点实验室进行,该实验室位于南开大学津南校区(38°59′15.49″N,117°19′53.08″E),试验于2017年7—8月进行。供试ZnO NPs 材料购于上海麦克林生化科技有限公司,纯度99%,粒径(30±10)nm。供试小白菜种子购于北京绿金蓝育苗有限公司,供试樱桃萝卜种子购于北京金丹隆种子有限公司。直径9 cm 的玻璃培养皿与滤纸、30%H2O2(优级纯)以及硫酸锌(ZnSO4·7H2O,优级纯)均购自天津海斯凯尔科技发展有限公司;试验所用去离子水为实验室自制。
1.2 试验方法
1.2.1 ZnO NPs性能表征
通过场发射透射电镜(TEM,日本电子JEM-2800)观察ZnO NPs 形态与粒径分布,利用X 射线粉末衍射仪(XRD,Ulitma Ⅳ)确认纳米材料的晶型,通过多站扩展式全自动快速比表面仪(ASAP 2460)测定纳米颗粒的比表面积。
1.2.2 ZnO NPs悬浮液的制备
通过向超纯水中加入适量的ZnO NPs 制备NPs悬浊液。为避免聚集,基于先前的研究,将溶液在30℃下利用超声波细胞粉碎机(新芝JY98-ⅢN)进行超声处理(130 W,20 kHz)30 min,使其均匀分散于高纯水中形成纳米材料悬浮液。离子溶液由ZnSO4·7H2O 配制,其浓度与相应的纳米材料悬浮液的金属量一致。
1.2.3 预试验
选取直径9 cm、铺有1 层定性滤纸的玻璃培养皿,挑选大小均匀、颗粒饱满的15 粒小白菜或樱桃萝卜种子,用10%的H2O2溶液浸泡30 min 以去除表面细菌,再用去离子水冲洗多次后播种于培养皿,使每颗种子之间的距离不少于1 cm。将处理浓度为0、1、10、100 mg·L-1的ZnO NPs 悬浮液各5 mL 分别加入培养皿中,每个浓度设置3 个重复,将培养皿用封口膜密封后于25 ℃下避光培养。
1.2.4 种子发芽试验
种子的选择和前处理过程与1.2.3 节相同。试验共设13 个处理,每个处理3 次重复,ZnO NPs 处理浓度为0、50、100、200、500、700、1 000 mg·L-1(分别标记为CK、N50、N100、N200、N500、N700、N1000),ZnSO4浓度为50、100、200、500、700、1 000 mg·L-1(分别标记为I50、I100、I200、I500、I700、I1000)。将培养皿均放置在恒温培养箱中于25 ℃下避光培养7 d。培养结束后,将培养皿浸泡在20 mmol·L-1Na2·EDTA 溶液中2 h,然后用自来水和去离子水冲洗,去除黏附于样品上的污染物。
1.3 测定方法
用天平称量幼苗的鲜质量,用游标卡尺分别测量根长、芽长并计算抑制率,计算公式为:
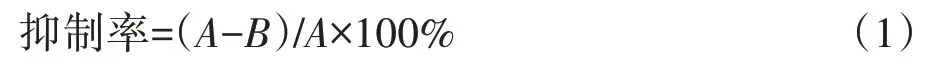
其中:A为对照处理根长或芽长;B为污染处理根长或芽长。
试验期间每日记录发芽的种子数,试验结束时计算种子发芽率(GR),其计算公式为:

本试验中种子幼根或子叶伸出种皮视为萌发,只有幼根超过1 mm才被记为根长。
1.4 数据分析
所有检测的数据均重复3 次,采用Microsoft Excel 2010和SPSS 13.0对测得数据进行计算、处理与统计分析,利用LSD(Least significant difference)法对数据进行显著性分析,并利用Origin 9.0进行制图。
2 结果与分析
2.1 ZnO NPs的表征
本试验所使用纳米材料的大小及形态通过TEM观察(图1A),其材料的物相组成及纯度使用XRD 进行检测(图1B)。从图1A 中可以清晰地看出ZnO NPs均为比较规则的圆球状颗粒,平均粒径约30 nm。图1B 中清晰地展示了纳米材料的XRD 衍射峰,其中ZnO NPs 样品的XRD衍射峰尖锐明显,并且几乎完全一致,在2θ为31.769°、34.421°、36.252°处的主衍射峰分别对应JCPDS No.88—2495 标准卡片的(100)、(002)、(101)晶面,没有任何杂峰,表明该纳米材料为六方晶系,结晶度好,纯度高。
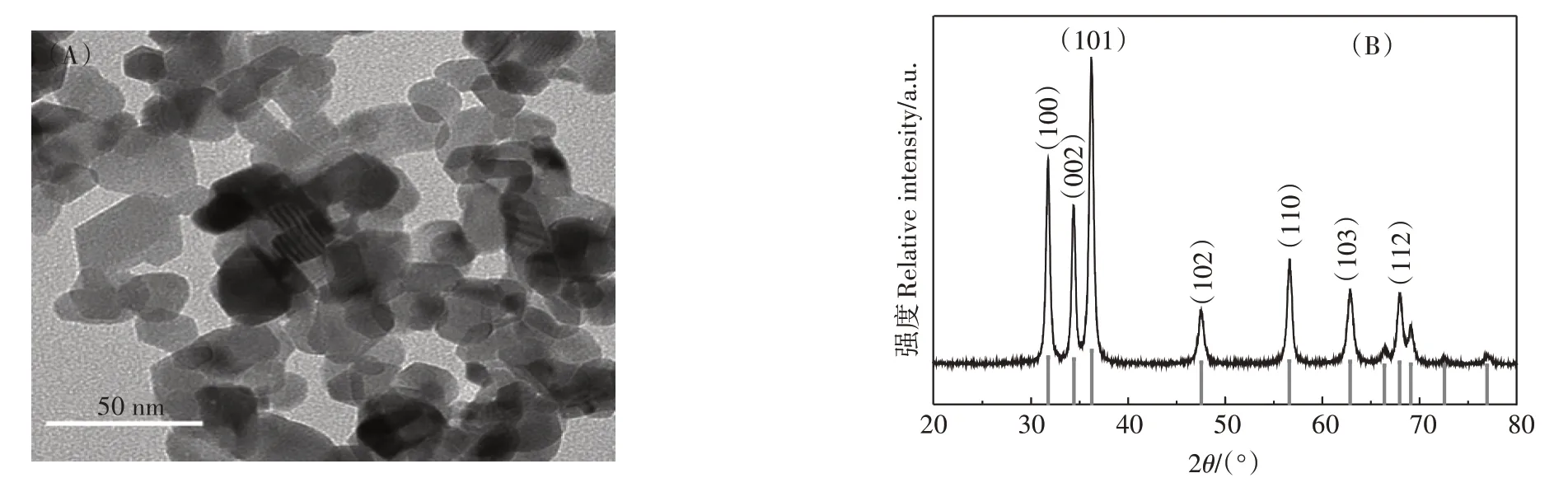
图1 纳米氧化锌(ZnO NPs)的透射电镜图(A)及X-射线衍射图谱(B)Figure 1 Transmission electron microscope(A)and X-ray diffraction pattern(B)of ZnO NPs
2.2 ZnO NPs 和ZnSO4对两种蔬菜种子发芽率及生物量的影响
发芽率不仅是衡量种子发芽能力的最直观的物理量,也是高等植物毒理试验的一个重要指标。根据预试验结果,两种蔬菜种子发芽率均为100%,满足GB 16715.2—2010规定的种子质量标准(≥85%)。在发芽试验浓度范围内,各污染浓度处理下两种蔬菜作物的发芽率均大于93%(图2),与对照处理均无显著差异(P>0.05),表明ZnO NPs 和ZnSO4对两种蔬菜发芽率无显著影响。
生物量是最直观反映植物受污染影响的物理量,与发芽率不同,小白菜幼苗的生物量随着ZnO NPs 和ZnSO4浓度的增加而降低,表现出明显的抑制作用(图3)。尽管ZnO NPs 和ZnSO4对樱桃萝卜表现出低浓度促进高浓度抑制(“低促高抑”)的现象,但在最高浓度(1 000 mg·L-1)时,ZnO NPs对樱桃萝卜鲜质量降低超过60%。整体而言,ZnO NPs 比ZnSO4对樱桃萝卜的毒性更强,而ZnSO4对小白菜生物量的降低作用强于ZnO NPs。
2.3 ZnO NPs 和ZnSO4对樱桃萝卜与小白菜根长和芽长的影响
不同浓度的ZnO NPs及ZnSO4均在一定程度上抑制了两种蔬菜根长和芽长(图4)。由图5可知,两种植物的根长和芽长随着污染物浓度的升高而逐渐降低,但ZnO NPs及ZnSO4对两种蔬菜根长的抑制作用强于芽长。相对而言,ZnO NPs 对两种蔬菜种子根长的抑制作用比ZnSO4更大,且抑制率均随浓度的升高而增加,在1 000 mg·L-1时最高,达到98%。但ZnSO4对两种蔬菜芽长的抑制作用则强于ZnO NPs。
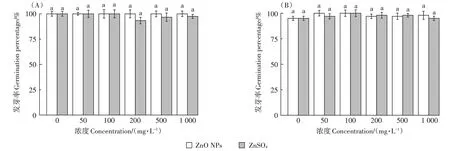
图2 不同处理下樱桃萝卜(A)和小白菜(B)发芽率Figure 2 Germination percentage of Raphanus sativus(A)and Brassica chinensis(B)under different treatments
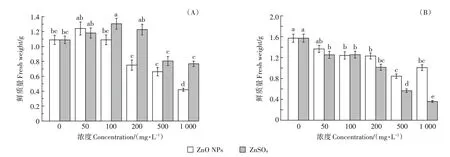
图3 不同处理下樱桃萝卜(A)和小白菜(B)鲜质量Figure 3 Fresh weight of Raphanus sativus(A)and Brassica chinensis(B)under different treatments

图4 不同处理下樱桃萝卜(A)和小白菜(B)的发芽形态Figure 4 Shoot morphology of Raphanus sativus(A)and Brassica chinensis(B)under different treatments
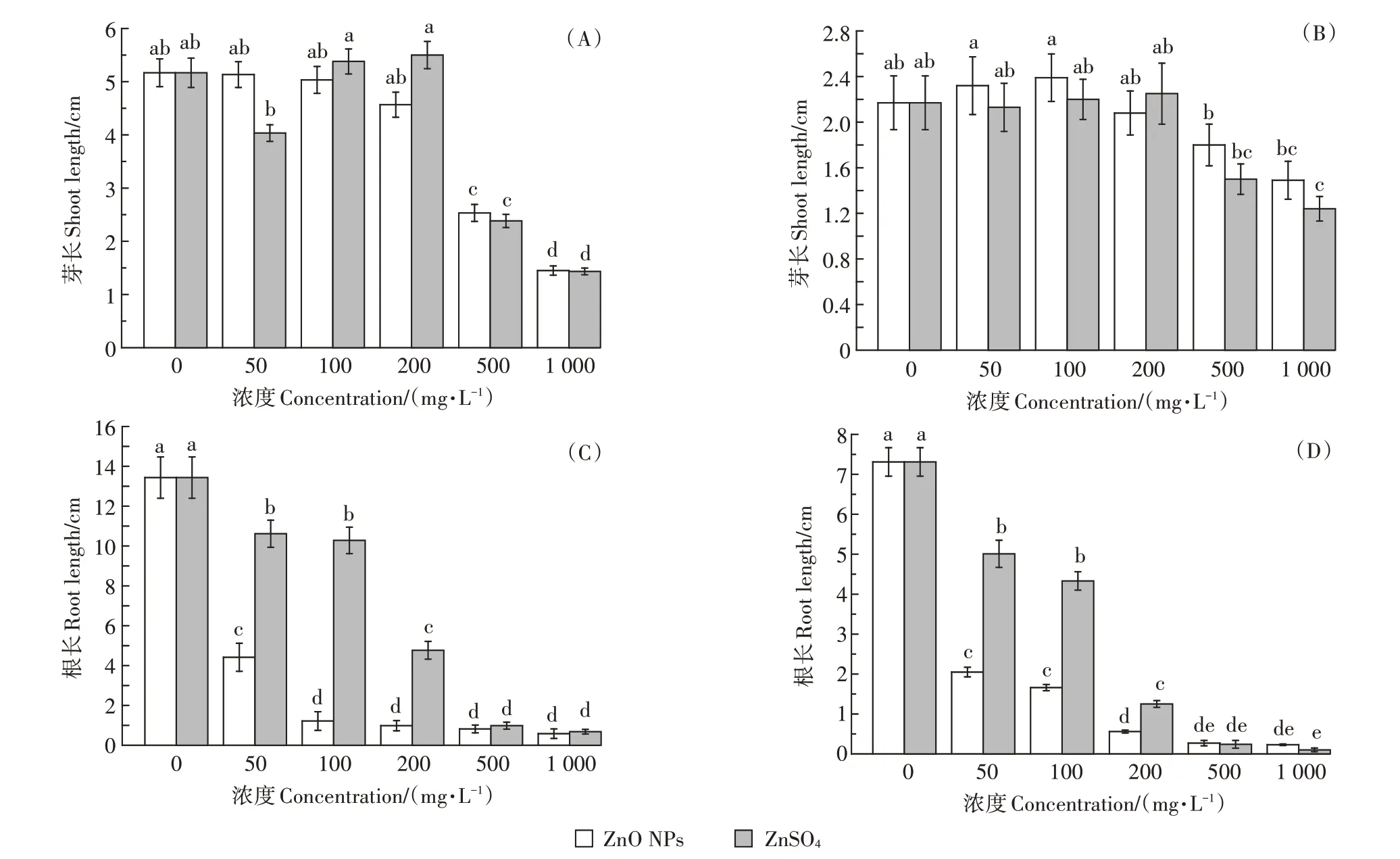
图5 不同处理下樱桃萝卜(A、C)和小白菜(B、D)的芽长及根长Figure 5 Shoot and root length of Raphanus sativus(A,C)and Brassica chinensis(B,D)under different treatments
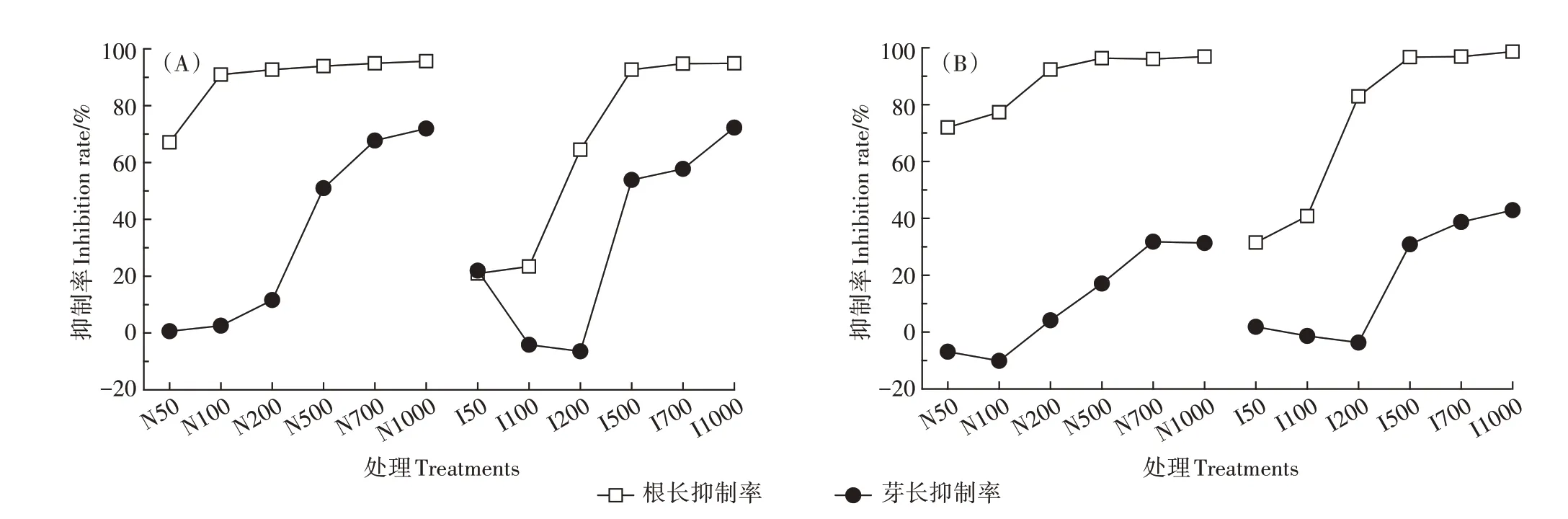
图6 不同处理下樱桃萝卜(A)和小白菜(B)的根长和芽长抑制率Figure 6 Inhibition rates of root and shoot length of Raphanus sativus(A)and Brassica chinensis(B)under different treatments
如图6所示,不同浓度ZnO NPs与ZnSO4处理对两种蔬菜芽长胁迫作用均低于对根长的胁迫作用,甚至在低浓度时出现促进作用。整体而言,ZnO NPs 处理均表现为对樱桃萝卜芽长的抑制率明显高于小白菜(图6),表明ZnO NPs对樱桃萝卜生长的胁迫作用高于小白菜,这与二者对两种幼苗生物量的影响结果一致,并且对根长的抑制作用明显强于芽长。
3 讨论
目前,金属型纳米颗粒(MB NPs)产生的植物毒性机制尚不明确[23]。MB NPs 可以溶出部分金属离子,而金属离子尤其是重金属离子对植物的毒性已得到普遍证实[24]。对于MB NPs,其生物毒性来自溶解的金属离子还是纳米颗粒自身也是目前NPs 毒性研究中争议较大的问题之一[25-26]。作为一种具有代表性的金属氧化物纳米材料,ZnO NPs 的植物致毒机制也同样饱受争议[27]。有研究认为纳米氧化物的生物毒性主要源于所溶出的金属离子[28-29],而García-Gómez 等[30]研究结果表明,ZnO NPs 溶解出的Zn2+在植物中优先发挥毒性,但是可能存在Zn2+与ZnO NPs共同对植物产生毒性作用的现象。López-Moreno等[25]研究认为,很难说明ZnO NPs 的植物毒性是否来自纳米颗粒,而经ZnO NPs 暴露后,大豆组织中的Zn以Zn2+而非ZnO NPs 形式存在。Lin 等[31]研究表明,Zn NPs和ZnO NPs能够明显抑制植物发芽及根生长,但是二者暴露液离心过滤后的上清液则未表现出植物毒性,表明Zn NPs和ZnO NPs的毒性来自纳米颗粒而非溶解的Zn2+;而Xiang 等[32]也得出了相似的结果,即ZnO NPs 溶解的Zn2+不是其对大白菜幼苗影响的主要原因。类似地,本研究发现低浓度(50~100 mg·L-1)的ZnSO4对两种蔬菜根长的抑制作用显著低于相同浓度的ZnO NPs 处理(P<0.05),而相同浓度的ZnO NPs 溶出的Zn2+浓度低于对比离子处理,表明在低浓度时ZnO NPs 对两种幼苗根的生物毒性高于Zn2+,这一毒性主要来源于ZnO NPs 自身毒性而非Zn2+毒性;但在高浓度处理下,二者抑制率较为接近,其致毒机理仍需进一步研究。
ZnO NPs 可明显抑制玉米(Zea maysL.)根的生长,但对于植物的发芽没有显著的影响[31];类似的研究也发现ZnO NPs 对苜蓿(Medicago sativaL.)、黑芥(Brassica nigra)、拟南芥(Arabidopsis thaliana)、玉米(Zea maysL.)和水稻(Oryza sativaL.)等作物的种子萌发、植株生长以及产品质量均有负面影响[6,17,33-34]。在本研究中,ZnO NPs 对两种植物的根长与芽长抑制率与污染物浓度呈正相关(图6),并且ZnO NPs 对两种蔬菜种子根长的抑制作用较芽长更强,两种污染物浓度在1 000 mg·L-1时抑制率均高于95%。可能原因是种子萌发后根部最先伸出种皮,种皮对于种子发芽前的保护作用,可在一定程度上减少污染物对于种子的毒害作用,从而使得ZnO NPs 对两种蔬菜发芽率影响不显著;但幼苗生长阶段,根部相较于地上部与污染物接触时间最长,接触面积也最大[35-37],受污染物胁迫作用比地上部大,从而使得污染物对根长的抑制作用比芽长更强。
4 结论
(1)ZnO NPs 和ZnSO4对樱桃萝卜和小白菜的发芽率均无显著影响。
(2)不同浓度的ZnO NPs 和ZnSO4均在一定程度上抑制了两种蔬菜根长和芽长,ZnO NPs 对两种蔬菜根长的抑制作用比ZnSO4更大,但ZnSO4对两种蔬菜芽长的抑制作用则强于ZnO NPs。
(3)ZnO NPs比ZnSO4对樱桃萝卜的毒性更强,而ZnSO4对小白菜生物量的降低作用强于ZnO NPs。
(4)不同浓度ZnO NPs 与ZnSO4处理对两种蔬菜芽长胁迫作用均低于对根长的胁迫作用。

