高尿酸血症对非酒精性脂肪性肝病患者动脉粥样硬化及血管内皮功能的影响*
巩伟伟,周 蒨,李 晗,徐 蕾,雷 涛
1.上海市第一康复医院代谢与肾病康复科,上海 200090;2.上海中医药大学附属普陀医院内分泌科,上海 200062
非酒精性脂肪性肝病(NAFLD)是临床常见的慢性肝病,我国成人患病率高达15%,其病理机制为以胰岛素抵抗(IR)、脂质过氧化为核心的“二次打击”[1]。研究表明,血尿酸(UA)升高与NAFLD发生密切相关,60%~70%的NAFLD患者可合并高尿酸血症(HUA),HUA是导致NAFLD发生、发展的独立危险因素,可加重肝细胞脂肪变性[2]。NAFLD患者普遍存在脂质代谢紊乱,易导致动脉粥样硬化(AS)和内皮功能损伤的发生,但HUA与NAFLD患者AS及血管内皮功能的相关性研究仍鲜有报道[3]。本研究通过检测NAFLD患者的UA水平,探讨HUA对患者AS及血管内皮功能的影响,从而为NAFLD的防治提供参考依据。
1 资料与方法
1.1一般资料 选择2018年1月至2019年6月本院收治的NAFLD患者82例为研究对象。纳入标准:(1)均符合2018年美国肝病研究学会发布的《非酒精性脂肪性肝病的诊断和管理》相关诊断标准[4],并经影像学检查确诊;(2)年龄≥18岁,近期未服用影响UA或保肝药物。排除标准:酒精性肝病、肝豆状核变性、慢性病毒性肝炎、药物性肝病、自身免疫性肝病等其他导致肝功能异常的肝病。82例患者中男50例,女32例;年龄31~70岁,平均(48.2±6.4)岁;病程1~18年,平均(12.4±4.4)年。根据是否合并HUA,将患者分为HUA组(n=48)和非HUA组(n=34)。HUA的诊断标准:男性或绝经后女性UA>420 μmol/L,绝经前女性UA>350 μmol/L。
1.2仪器与试剂 日立7600型全自动生化分析仪及其配套试剂盒,GE Vivid E9型彩色多普勒超声检测仪;日立HITACHI型高速离心机。
1.3方法
1.3.1NAFLD的筛查及评估 (1)测量身高、体质量、腰围、臀围和收缩压(SBP)、舒张压(DBP),计算体质量指数(BMI)和腰臀比。(2)详细询问患者的病史,包括体质量改变、吸烟、饮酒及病毒性肝炎、痛风、高脂血症、高血压等疾病及其家族史;(3)了解患者的饮食和运动习惯;(4)当疑似有过量饮酒或酒精滥用时,使用酒瘾问题自填式筛查问卷(CAGE),计算日均饮酒量[乙醇(g)=饮酒的毫升数×酒精的度数(%)×0.8]和饮酒持续时间,并记录12周内有无过量饮酒。
1.3.2生化指标检测 所有患者均于入院次日清晨采集空腹静脉血5 mL,3 000 r/min高速离心,留取上清液备检。采用全自动生化分析仪检测血清UA、空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C);采用酶联免疫吸附法检测内皮素-1(ET-1),硝酸还原酶法检测一氧化氮(NO),尿素酶法检测UA。
1.3.3颈动脉超声检查 入院时采用彩色多普勒超声检测仪检测颈总动脉、双侧颈内动脉、颈动脉分叉处,记录斑块形成情况,并测定颈动脉内-中膜厚度(IMT),取3次测量的平均值。
1.3.4治疗与随访 入院后,根据《非酒精性脂肪性肝病诊疗指南(2018更新版)》[5]进行生活方式干预,包括控制膳食热量摄入,每日减少2 092~4 184 kJ热量;调整膳食结构,适量脂肪和碳水化合物的平衡膳食,限制含糖食品,增加全谷类食物摄入;每天坚持中等量有氧运动30 min,每周5次。对于3个月生活方式干预后无明显效果的患者,适当给予治疗代谢综合征的药物。跟踪随访1年,由专人每个月定期对患者进行饮食、运动、服药、作息等方面健康教育,记录两组患者心脑血管事件的发生情况,包括临床确诊的心绞痛、心肌梗死、脑出血或脑梗死。
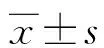
2 结 果
2.1HUA组与非HUA组患者临床指标比较 与非HUA组比较,HUA组TC、TG明显升高,HDL-C明显降低,差异均有统计学意义(P<0.05)。两组患者年龄、性别构成、BMI、FBG、SBP、DBP及LDL-C比较,差异无统计学意义(P>0.05)。见表1。
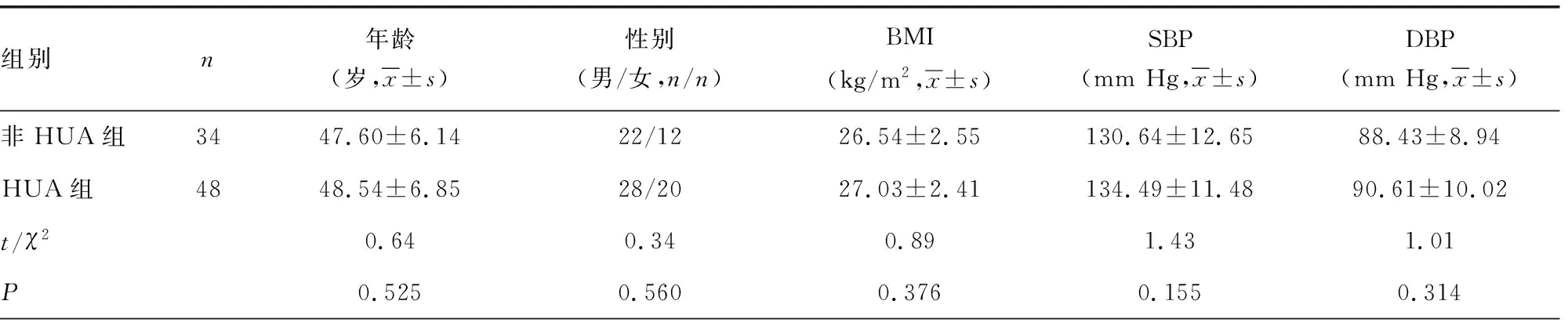
表1 HUA组与非HUA组患者临床指标的比较

续表1 HUA组与非HUA组患者临床指标的比较
2.2非HUA组和HUA组AS和血管内皮功能比较 与非HUA组比较,HUA组患者ET-1、颈动脉斑块检出率明显升高,NO明显降低,而IMT明显增厚,差异均有统计学意义(P<0.05)。见表2。

表2 非HUA组和HUA组AS和血管内皮功能比较
2.3血清UA与NO、ET-1、IMT的相关性分析 Pearson相关分析表明,NAFLD患者血清UA与ET-1、IMT呈正相关,与NO呈负相关(r=0.458、0.401、-0.527,P<0.05)。
2.4非HUA组和HUA组心脑血管事件比较 HUA组心脑血管事件的总发生率为22.91%(11/48),显著高于非HUA组的5.88%(2/34),差异有统计学意义(χ2=4.24,P<0.05)。见表3。
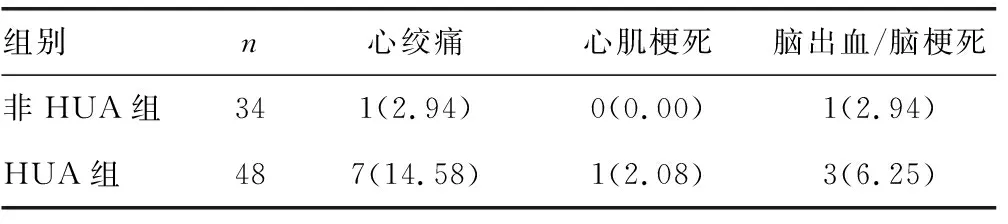
表3 非HUA组和HUA组心脑血管事件比较[n(%)]
3 讨 论
NAFLD的发病机制仍未完全阐明,其中“二次打击”学说已得到广泛认同。“第一次打击”表现为能量摄取与消耗平衡的紊乱,同时IR加剧脂质代谢紊乱,诱发TG在肝脏沉积。氧自由基、炎症因子所致氧化应激反应促使单纯性脂肪性肝病向脂肪性肝炎进展,造成“第二次打击”。研究证实,HUA与脂代谢紊乱、IR、氧化应激及炎性反应密切相关,参与了NAFLD发生过程,导致两种疾病相互促进、相互发展[6]。LIU等[7]通过Meta分析研究发现,血清UA水平与NAFLD的发病具有线性的量效关系,血清UA每增高1 mg/dL,NAFLD的发病风险可上升20%。本研究所有患者经筛查及系统评估均不存在过量饮酒或酒精滥用,HUA组TC、TG较非HUA组明显升高,HDL-C明显降低(P<0.05),表明UA水平升高加重了NAFLD患者的脂质代谢紊乱。
近年来研究表明,NAFLD的临床负担并不局限于对肝脏及相关疾病的影响,心血管疾病也是患者死亡的主要原因,而心血管疾病的发病基础则是AS[8]。PETTA等[9]对NAFLD患者的长期随访后发现,NAFLD可能参与了AS的早期发生和发展。在众多危险因子的作用下,动脉壁单核-巨噬细胞、平滑肌细胞大量聚集,细胞外基质合成、分泌以及脂质的内膜沉积,导致AS的形成,其中内皮细胞功能紊乱与血管内皮损伤作为AS形成前的早期病理改变,在NAFLD患者并发AS过程中的作用受到越来越多的重视[10]。本研究结果显示,与非HUA组比较,HUA组患者颈动脉斑块检出率明显升高,IMT明显增厚,其机制主要通过加重NAFLD代谢紊乱导致AS的发生。YANG等[11]研究认为,HUA可加重NAFLD患者脂质代谢异常,且对AS存在明显影响。
有研究还发现,NAFLD患者并发HUA除加重代谢紊乱外,HUA还可刺激血管平滑肌细胞增殖和迁移,诱导局部血栓素及ET-1的生成,抑制内皮细胞释放NO[12],与本研究结论一致,且血清UA水平与ET-1呈正相关,与NO呈负相关(P<0.05),从而造成血管内皮损伤、功能障碍,加重AS病情。随访1年发现,HUA组患者心脑血管事件的总发生率为22.91%,显著高于非HUA组的5.88%,差异有统计学意义(P<0.05),可见UA水平与心脑血管事件的发生密切相关。曾海城等[13]研究指出,HUA加剧了老年高血压患者血管内皮舒张功能的损伤程度,可能是心脑血管事件潜在的独立危险因素。动物实验表明,HUA对血管内皮细胞功能的损伤呈时间依赖性,通过介导内皮细胞活化、血小板活化及黏附等诱发AS,进而导致心脑血管事件的发生[14]。因此,临床上正确评估NAFLD患者伴发HUA的病情,对心脑血管事件的防治具有重要意义。
综上所述,NAFLD患者存在明显脂质代谢紊乱,而HUA可能参与并加重AS和血管内皮功能损伤,临床上加强UA水平的监测,积极调节脂质代谢紊乱可能有助于改善NAFLD病情及减少心脑血管事件的发生。鉴于本研究为回顾性研究,未对生化指标进行动态的监测分析,且未能排除随访期间饮食、运动等干扰因素的影响,故所得结论需要前瞻性的研究进一步论证。

