生殖道支原体基因芯片在宫颈炎患者支原体感染诊断中的价值*
张 薇,智深深,荣长仙,李丽娟△
重庆市急救医疗中心:1.检验科;2.妇产科,重庆 400014
宫颈炎是国内外常见的妇科疾病,发病率持续上升,发病年龄亦呈年轻化趋势,严重影响女性的生活质量[1-2]。支原体感染是引发宫颈炎的主要原因之一,有研究报道,与宫颈炎相关的支原体阳性率为50%以上,其主要类型是解脲脲原体(Uu)、微小脲原体(Up)、生殖支原体(Mg)和人型支原体(Mh)[3]。女性生殖道感染支原体后,多数情况下只是作为携带者,当宿主抵抗力下降或黏膜受损时,支原体可侵入宫颈黏膜细胞引起宫颈炎,继续向上蔓延引起子宫内膜炎、卵巢炎、不孕,甚至导致流产、早产等[4]。
Uu和Mh的检测在国内外临床实验室开展较早,培养法是主要检测方法,原理是Uu分解尿素、Mh分解精氨酸后,生成的碱性物质引起pH值上升,使液体培养基由黄色变成红色。该方法具有操作简单、易推广等优点,但耗时较长,不能区分支原体类型,可受杂菌干扰造成假阳性,也是导致国内抗菌药物滥用和支原体耐药率上升的原因之一[5]。为此,本课题组前期成功研发了基于环介导恒温扩增和微流控技术的生殖道支原体基因芯片,经性能验证后,采用该基因芯片检测本院宫颈炎患者,判断生殖道支原体感染类型,以期为临床快速诊断和合理用药提供参考价值。
1 资料与方法
1.1一般资料 选取2019年3-8月本院初诊的156例宫颈炎患者为研究对象,宫颈炎诊断标准参照《2015美国疾病控制和预防中心关于宫颈炎症的诊治规范》。纳入标准:宫颈管流出脓性分泌物;进行拭子操作后宫颈出血;阴道分泌物镜检每高倍视野下白细胞计数>10个。排除标准:月经期;24 h内有性生活;3 d内使用阴道药物或进行阴道冲洗;1周内服用抗菌药物。
1.2仪器与试剂 生殖道支原体微流控芯片由本课题组研发;RTisochipTM-A恒温扩增微流控芯片核酸分析仪由博奥生物有限公司提供;恒温扩增试剂购自上海荣研生物有限公司;DNA提取试剂盒购自Tiangen公司;PCR试剂盒购自北京康为世纪有限公司;Uu和Mh分离鉴定试剂盒购自珠海丽珠有限公司。
1.3方法
1.3.1标本采集 患者取膀胱截石位,会阴处常规消毒,阴道窥器暴露宫颈。无菌拭子插入宫颈管内,轻轻旋转3~5圈,取出拭子后立即放入无菌管,尽快送检。
1.3.2芯片法 将拭子放入0.9%氯化钠溶液中,挤压、旋转拭子数次,充分混匀后提取标本核酸。配制恒温扩增试剂,取9.0 μL恒温扩增试剂和9.0 μL标本的核酸提取液,混匀后离心。芯片加样后于RTisochipTM-A恒温扩增微流控芯片核酸分析仪上进行核酸扩增,50 min后判读结果。
1.3.3培养法 将基础液及试验板于室温复温后,吸取50.0 μL基础液加入试验板上的空白对照孔。将含分泌物的拭子插入剩余的基础液中,挤压、旋转拭子数次,充分混匀。取混匀后的基础液加入试验板余下各孔,每孔50.0 μL,轻轻震荡至包被上的物质溶解。所有孔滴加1滴无菌液状石蜡,加盖后置于37 ℃孵箱培养,Uu和Mh分别于24和48 h后观察结果。
1.3.4测序法 按照PCR试剂盒操作流程进行操作。引物分别如下,Uu上游引物:5′-GCA ATC TGC TCG TGA AGT AC-3′;Uu下游引物:5′-CTA AGC CAT TTA CAC CTC AA-3′;Up上游引物:5′-GCA ATC TGC TCG TGA AGT AC-3′;Up下游引物:5′-CTA AGC CAT TTA CAC CTC AA-3′;Mg上游引物:5′-CCA TGT GCG CCC TGA TGG GG-3′;Mg下游引物:5′-TCA CGC TAC TAC GTT GCT TAT TTT GGT-3′;Mh上游引物:5′-ACC CTG AAT TTG AAA TCG TTG C-3′;Mh下游引物:5′-CAA ATA TTG AGC CTG CTT TTG CAC CA-3′。PCR反应程序:95 ℃ 3 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,72 ℃ 5 min,产物于测序仪上测序。
1.3.5患者信息收集 收集并分析患者的临床信息包括年龄、孕次、产次、是否绝经等。
1.4统计学处理 采用SPSS22.0统计软件进行分析,计数资料以例数或百分率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1生殖道支原体芯片法检测结果 156例标本中,阳性78例(部分标本同时存在两种或两种以上支原体感染,阳性率为50.0%),其中Uu 18例(阳性率为11.5%),Up 57例(阳性率为36.5%),Mg 4例(阳性率为2.6%),Mh 14例(阳性率为9.0%)。
2.23种方法检测的阳性符合率比较 芯片法与测序法比较,Uu、Mg和Mh的阳性符合率均为100.0%,Up的阳性符合率为96.6%。芯片法与培养法比较,Mh的阳性符合率为93.3%;培养法中Uu阳性数为82例,而芯片法中Uu阳性数为18例,Up阳性数为57例,推测培养法检测的是总的脲原体。见表1~2。

表1 支原体芯片法与测序法的阳性符合率比较

表2 支原体芯片法与培养法的阳性符合率比较
2.3宫颈炎患者发生支原体感染的影响因素 宫颈炎患者发生支原体感染与年龄、孕次、产次、是否绝经无关(P>0.05)。见表3。
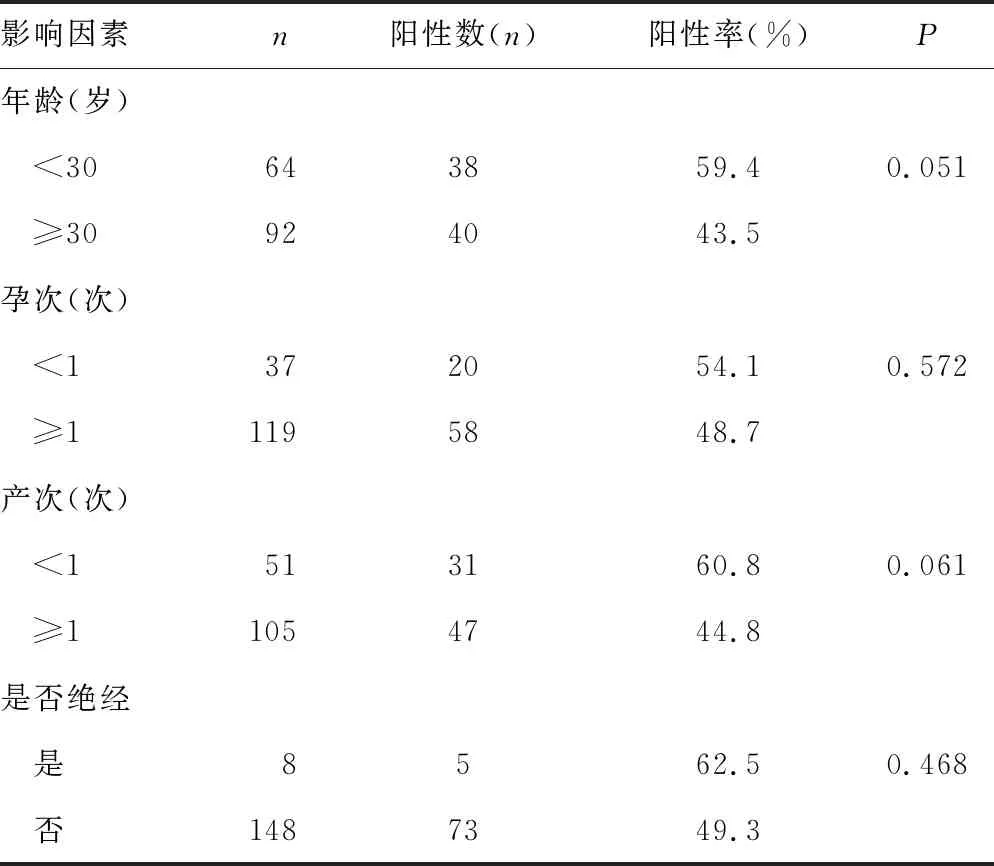
表3 宫颈炎患者支原体感染的影响因素分析
3 讨 论
目前大部分实验室对生殖道支原体感染的鉴定多依赖于培养法或PCR单项验证,尚未对支原体分型进行同步、高效的鉴定评价[6],因此本研究在这方面有一定的创新性。本课题组前期成功研发了基于环介导恒温扩增和微流控技术的生殖道支原体基因芯片,以不同分型支原体的特征片段制备引物探针,将标本DNA扩增并荧光标记,通过杂交后检测的荧光强度来判断支原体的类型,其特点是标本需要量少、准确性高,整个检测过程在1 h内完成[7],在妇产科学、生殖医学、泌尿学等学科具有可观的临床应用前景,充分体现了基因芯片技术在生殖道感染诊治中的优越性。
本研究显示,宫颈炎患者生殖道支原体的阳性率为50.0%,其中Uu阳性率为11.5%,Up为36.5%,Mg为2.6%,Mh为9.0%。意大利的一项多中心研究利用实时PCR技术检测这4种支原体,有症状感染者中Uu阳性率为9.0%,Up为38.3%,Mg为0.6%,Mh为8.6%[8],与本研究结果基本一致。然而,也有研究报道脲原体(包括Uu和Up)在宫颈处可能仅是定植,并不是宫颈炎的致病因素[9],经基因分型后,Uu和Up在不同人群中的分布亦有差异,普通人群以Up定植为主,而高危人群以Uu定植为主[10]。
目前支原体的培养法只针对Uu和Mh。Up是从Uu中分离出的一个新种,亦能分解尿素,因此推测培养法很难将Uu和Up区分开[11],芯片法则提供了一个高准确度的脲原体分型。本研究显示,培养法中Uu阳性数为82例,而芯片法中Uu阳性数为18例,Up阳性数为57例,因此推测培养法检测的是总的脲原体,并且少数杂菌也可导致假阳性结果。李平卫等[12]报道了Up的感染率远高于Uu,生殖道感染性疾病与Up具有明显相关性,Uu大多存在于无症状携带者。因此,对生殖道支原体进行分型具有重要意义。芯片法与测序法比较,Uu、Mg和Mh的阳性符合率均为100.0%,Up的阳性符合率为96.6%,符合率较高。芯片法中有2例未检出Up阳性,推测是由于测序法的灵敏度高于芯片法,导致该2例标本测序法结果为阳性但芯片法为阴性。鉴于培养法可获得药敏试验结果,因此在诊断泌尿生殖道支原体感染时建议联合使用培养法和芯片法。
此外,有研究报道年龄、性生活、流产、分娩史等是女性患宫颈炎的危险因素[13-14],但本研究中宫颈炎患者发生支原体感染与年龄、孕次、产次、是否绝经无关,可能是样本量较少的缘故。宫颈支原体感染需引起女性重视,临床医生也要充分评估其配偶感染的危险因素,以提高支原体感染的诊治水平[15]。
关于生殖道支原体感染的临界值暂未设定,无法区分是定植还是感染,目前只能结合临床症状和药敏试验结果给予针对性的治疗。基因芯片技术提高了检测方法之间的符合率,适宜临床应用推广。后续,本课题组将继续收集标本,进行生殖道支原体定植和感染的研究。
综上所述,生殖道支原体基因芯片可准确、快速地检测支原体及进行分型,具有可观的临床应用价值。

