青海省青稞条纹病菌遗传多样性分析
胡章薇,杨 帆,闫佳会,侯 璐,翁 华,姚 强
(青海大学农林科学院/青海省农业有害生物综合治理重点实验室/农业农村部西宁作物有害生物科学观测实验站,青海西宁810016)
青稞(Hordeum vulgareL.var.nudum Hook.f.)又名裸大麦,为禾本科大麦属植物,属于栽培大麦的变种,其特点是成熟时籽粒内外稃与颖果分离,籽粒裸露[1]。青稞在藏族同胞的食物结构中举足轻重,起着重要的营养与健康平衡作用。因其适宜生长在高原冷凉的区域,具有耐寒性强、生长期短、高产早熟、适应性广等特点,以及独特的营养结构和保健作用,青稞已成为极具开发利用价值的高原特色农作物之一[2]。青稞产业的健康发展,对于保障青藏高原地区粮食安全、社会稳定和高原特色产业的发展具有重大意义。
青稞条纹病为种子传播的系统性病害,病菌潜伏于种子中,成为翌年发病的菌源。控制该病害有效的方法就是使用健康良种,但受经济发展和环境条件等的限制,目前青稞生产用种60%以上依靠农户自留。以粮代种造成了条纹病发生逐年加重,在青海造成的年均产量损失达10%左右,严重的高达25%。青稞条纹病菌为真菌门子囊菌纲盘菌目盘菌科核腔菌属麦类核腔菌Pyrenophora.graminea,传统丝状真菌无性阶段形态相近,因此,分类鉴定主要依据真菌的孢子形态进行。青稞条纹病菌在人工培养基上较难产生分生孢子[3],难以通过表观形态鉴定,而rDNA-ITS序列分析使丝状真菌的鉴定更容易且更准确[4]。rDNA-ITS包括ITS1、5.8S和ITS2的全长ITS区域序列,拥有相对丰富的信息,因而全长序列的ITS分析在真菌分子生物学鉴定中比较常用[5]。吴宽然对来自不同地理区域的菌株进行ITS序列分析,将供试菌株分为3个大类,共发现13个变异位点,15种单核苷酸多态性类型[6]。通过rDNA-ITS序列分析能揭示菌株的核苷酸变异,可以更加稳定和直接地研究菌株的遗传分化。本研究通过对青海省不同地区青稞条纹病株进行病原菌分离、纯化,基于rDNA-ITS进行条纹菌群体的遗传多样性分析,以期为明确该病害的发生流行规律以及制定相关防控技术体系提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株。供试菌株采自青海青稞主产区(表1)典型条纹病症状的发病叶片标样,保存于标本夹,常温保存。
1.1.2 供试试剂与仪器。供试试剂:琼脂粉、葡萄糖,均购自北京索莱宝科技有限公司;DNA提取试
剂盒HP Fungal DNA Kit,购于Omega Bio-Tek科技有 限 公 司;dNTP Mixture、Loading Buffer,均 购 于TaKaRa公司;引物由生工生物工程(上海)股份有限公司合成。

表1 发病叶片样品采集信息
供试仪器:TissueLyser II组织研磨仪,购自凯杰企业管理(上海)有限公司;微量核酸蛋白测定仪、sorvall ST 16R高速冷冻离心机,均购自赛默飞世尔科技(中国)有限公司;PCR仪、电泳仪、凝胶成像仪,均购自爱普拜斯应用生物系统贸易(上海)有限公司。
1.2 研究方法
1.2.1 培养基的配制。PDA(potato dextrose agar)培养基配制:马铃薯200 g,葡萄糖10 g,琼脂粉18 g,加水调至1 L,121℃下灭菌20 min。
1.2.2 供试菌株分离、纯化及保存。病样冲洗处理干净后,剪取病、健交界处的组织小段约3 mm,通过表面消毒处理(75%乙醇30 s,5%次氯酸钠1 min),无菌水冲洗3次后,接种在PDA平板培养基上,每皿5块病组织。各地区病样各分离10皿,置于22℃恒温箱中培养。待菌落长出后,先用挑针挑取上层菌丝,待菌丝长至培养皿的2/3时用手术刀切取尖端菌丝,反复纯化5~7次,直至菌丝形态一致。
由本实验室分离、纯化得到的条纹病菌菌株用滤纸片法保存并验证其活性后,于-20℃冰箱保存。
1.2.3 基因组DNA提取。对长满培养基的各供试菌株,小心挑取菌丝于2 mL离心管中,参考DNA提取试剂盒HP Fungal DNA Kit说明书提取DNA。获得的基因组DNA经2%琼脂糖凝胶电泳检测其质量,同时,DNA稀释10倍后保存于-20℃冰箱,原液保存于-80℃冰箱。
1.2.4 rDNA-ITS区间扩增及遗传多样性分析。利用通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')扩增条纹病病菌rDNA-ITS区间,PCR体系为:dNTP Mixture12.5μL,引物各1μL,DNA模板2μL,添加无菌去离子水至25μL。PCR反应程序为:92℃预变性10 min;92℃变性1 min,50℃退火1 min,72℃延伸1 min,循环30次;72℃延伸10 min。
PCR产物经电泳后确定片段为600 bp左右,送生工生物工程(上海)股份有限公司测序。各菌株测序结果于GenBank比对后,经MEGA和DNAsp软件分析病原菌群体间的遗传分化关系。
2 结果与分析
2.1 青稞条纹病病原菌的分离及菌落形态特征
采自青海青稞主产区(42个采集地点)典型条纹病症状的发病叶片,经分离纯化得到79株病株。培养初期菌丝白色,边缘整齐,生长10 d后部分菌株产生白色、灰色、墨绿色和橙色等可溶性色素,导致菌落颜色多变,但均不产生分生孢子(图1)。
2.2 青稞条纹病病原菌DNA提取及PCR产物电泳结果
提取已纯化的病菌菌丝基因组总DNA经2%琼脂糖凝胶电泳检测结果如图2-a所示,其总基因组DNA条带明亮,表明DNA质量较好。条纹病病原菌rDNA-ITS区间片段大小为600 bp左右,利用通用引物ITS1和ITS4扩增rDNA-ITS区间,取2 μL PCR产物经2%琼脂糖电泳凝胶显色确定,扩增片段为600 bp左右(图2-b)。PCR产物送生工生物工程(上海)股份有限公司测序。
2.3 条纹病菌遗传多样性分析及邻接聚类分析
采用引物ITS1和ITS4扩增79株条纹病菌rDNA-ITS区间,其长度范围为597~599 bp。各菌株测序结果于GenBank比对后,其中75株与麦类核腔菌Pyrenophora graminea(GenBank:KC787968.1)同源性最高为98.31%~99.49%,其他4株不确定。经MEGA 7.0.14软件分析75株病原菌的遗传关系。对75条rDNA-ITS序列区间,以DNAsp软件进行群体多态性位点分析,最终确定长度为569 bp序列用于分析。
所有变异位点共定义了5个单倍型(表2),H1包含70个菌株,菌株源于青海青稞主要种植区。2个单倍型(H2和H3)菌株(DLXRD1和DLXRD2)采自海西蒙古族自治州都兰县香日德镇。其余2个单倍 型(H4和H5)的 菌 株(LDMY1、LDMY2和GNSD2)分别采自海东市乐都县马营乡和海南藏族自治州贵南县森多乡。结果表明,该段序列具有较低的遗传多样性水平。根据DNAsp软件分析,得到多态位点有18个,占总位点的3.16%,其中有8个位点是因为碱基缺失造成的。这18个多态性位点中单类型多态性位点有14个,简约性信息位点有4个,没有3种或4种多态性位点。分析表明,Pyrenophora graminea的该段序列较为保守,突变也较为随机,仅有点突变。
邻接(Neighbor-Joining,NJ)聚类分析表明(图3),75个rDNA-ITS序列聚成5支,且遗传相似度较高(0.002~0.027);H4(LDMY1和LDMY2)与Pyrenophora graminea(GenBank:KC787968.1)聚 为一支;H5(GNSD2)独立聚为一支,与其他支遗传距离距离较远。
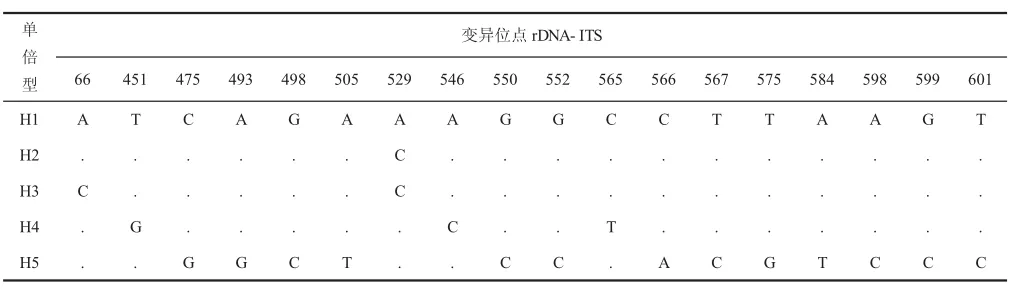
表2 Pyrenophora graminea 5个单倍型的ITS序列差异位点
3 讨论与结论
本研究所分离纯化的条纹病菌株在菌丝颜色、菌丝形态方面存在差异,且同株分离的条纹病菌在培养基上的形态多样,但基于rDNA-ITS的测序结果表现一致。可能是控制色素和形态的基因不在rDNA-ITS区间。如需划分生理小种,还要进一步选取其他基因序列。
rDNA-ITS区在真菌种间存在着丰富的变异,在种内却高度保守,同时,ITS片段的进化速率是18SrDNA的10倍,这是ITS序列在微生物种类鉴定和群落分析的理论基础[7],已广泛运用于植物检疫[8-9]。本研究采样寄主均为青稞,各菌株测序结果于GenBank比对后,其中75株与麦类核腔菌Pyrenophora graminea(GenBank:KC787968.1)同 源性最高。rDNA-ITS序列区间经DNAsp软件进行群体多态性位点分析,所有变异位点共定义了5个单倍型,有5株菌株发生点突变,变异位点有18个,共3种变异类型。吴宽然检测大麦条纹病菌株间ITS变异位点,共检测到13个变异位点,15种位点变化[6],与本研究相比,变异位点更少但变异类型更多,可能与青海特殊地理环境及本试验样品采集样本的寄主均为青稞有关。其中H5(GNSD2)独立聚为一支且变异位点较多,可能是由于其采集点的海拔最高,地理位置相对其他区域较远引起的。单倍型多样性(Hd)和邻接聚类分析是评价遗传多样性的重要指标。根据单倍型多样性(H)和邻接聚类分析数据表明,所有变异位点共定义了5个单倍型,75个rDNA-ITS单倍型聚成5支,且遗传相似度较高(0.002~0.027),与单倍型结果一致,表明该群体具有较低的遗传多样性水平,且遗传多样性与地理位置的分布无相关性。这与Bayraktar等[10]和司二静等[4]的研究结果类似,造成该现象的原因可能与青稞条纹病为种传病害有关。
本研究在青稞生长季节对主要种植区的条纹病采集标样,进行病原菌分离、培养和纯化,基于条纹病菌群体的rDNA-ITS序列进行群体遗传多样性分析及变异位点分析,明确了青海条纹病菌优势毒性类群及其相应的差异位点。抗病育种是病害防治经济有效的途径,抗性评价是抗病育种的前提条件,本研究对青海条纹病优势毒性类群进行了初步的分类,可为青海青稞品种抗性评价提供主要毒性类群。同时,本研究所分离纯化的菌株培养10 d后,其生长速度、菌丝颜色和菌丝致密程度等方面均存在差异,可为生理小种的划分提供理论依据。

