甲嘎松汤对藏医寒性肝病动物模型肠肝轴的调控机制研究
王碧霞,陈正元,泽仁达瓦,吴玉环,顿 珠,方佳敏,熊天琴
(1.广州中医药大学,广东 广州 510000;2.西藏藏医药大学,西藏 拉萨 850000)
藏医作为具有2000多年历史的传统医学,对肝病有着独特的认识[1],其认为肝病诱发外因多由感受湿热疫毒之邪所致,内因则与患者正气虚弱有关.藏医将肝病分为寒热两种,其中慢性肝病为寒性肝病,临床表现为脉象迟缓,尿现寒象,肝端不颤,肌色青黄,肝端薄长,食欲不振,消化力下降,大便色白而稀薄等[2-3].
现代医学肠肝轴理论认为,肠和肝脏的关系密切.肠和肝通过多种介质互相影响联系,对于黄疸类疾病,胆汁酸是联系肝肠的重要介质,胆汁酸肠肝循环障碍是其主要特征.胆汁酸肝肠障碍,将导致毒性胆汁酸淤积诱发肝脏和肠道的氧化或炎症损伤[4],因此,改善胆汁酸肝肠循环障碍导致的肝肠炎症或氧化损伤,对于肝和肠的调控具有重要意义.
藏医在临床实践中已广泛用于肝病[5],藏方甲嘎松汤记载于《四部医典》,由干姜、豆蔻、肉豆蔻组成,用于治疗寒性肝病.前期研究表明该方可以通过调节肠肝轴稳态对多种肝损伤动物模型具有确切的保肝作用[1,6-7].
现有的研究中,没有能有效地反映临床上寒性肝病表现特征的动物模型.慢性黄疸模型动物出现了较严重的胆汁淤积性肝损伤,表现为明显的炎性浸润以及胆管增生,但没有出现大便稀薄的现象,因此拟用刺激性泻药番泻叶,以模拟寒性肝病部分症状.基于此,本文通过在采用隔日皮下注射ANIT建立慢性黄疸模型基础上,期间每日灌胃番泻叶汤剂建立寒性肝病模型,观察甲嘎松汤对其肝脏和肠道损伤的改善作用,初步阐明甲嘎松汤对寒性肝病模型肠肝轴的调控作用,为进一步完善肠肝轴理论以及扩大甲嘎松汤临床应用提供数据支撑.
1 材料和方法
1.1 实验材料
1.1.1 实验动物
C57BL/6小鼠,6周龄,购自广东省医学实验动物中心(许可证号:SCXK(粤)2018-0002),饲养于广州中医药大学中药学院实验动物中心(许可证号:SYXK(粤)2019-0202),经广州中医药大学中药学院实验动物中心伦理学审查后进行实验(广东省实验证明编号:00224202).
1.1.2 实验药物与试剂
ANIT,上海阿拉丁化科技股份有限公司,批号:N1063891;ALT/GPT试剂盒,批号:C009-2-1,AST/GOT试剂盒,批号:C010-2-1,AKP试剂盒,批号:A059-2-2,TBA试剂盒,批号:E003-2-1,TGSH/GSSG试剂盒,批号:A061-1-2,SOD试剂盒,批号:A001-3-2,MDA试剂盒,批号:A003-1-2,均购自南京建成生物工程研究所有限公司;动物RNA抽提试剂盒(离心柱式),上海碧云天生物技术有限公司,批号:R0026;TGFβ1 mouse DuoSet Elsia kit,Bio-Techne(中国)有限公司,批号:DY1679-05;MMP2、MMP13、TIMP1、FXR、MRP2、NTCP、NQO1、HO-1和IL-10 qPCR引物购自生工生物工程(上海)股份有限公司;Mouse IL-1 beta/IL-1F2 DuoSet Elsia kit,Bio-Techne(中国)有限公司,批号:DY401;TGF-β1 mouse DuoSet Elsia kit,Bio-Techne(中国)有限公司,批号:DY1679-05.
1.1.3 实验仪器
全波长酶标分析仪,美国Thermo Fisher Scientific公司,批号:THM51119300;qPCR荧光定量PCR仪,美国Thermo Fisher Scientific公司,批号:ABI7500;激光共聚焦,德国ZEISS,批号:LSM800.
1.1.4 实验试剂配制
(1)ANIT溶液:称取适量的ANIT,配制成5 mg/mL的ANIT橄榄油溶液,现配现用.
(2)番泻叶汤剂:取适量番泻叶饮片,加入纯水煎煮10 min,纱布过滤后滤液使用旋转蒸发仪将浓度浓缩至1 g/mL生药,4℃备用.
(3)甲嘎松汤:干姜、豆蔻和肉豆蔻打粉,过6号筛(100目),按干姜:豆蔻:肉豆蔻=6∶5∶4的重量比混匀,配制成0.66 g/kg(0.066 g/mL)的混悬液,煮沸10 min,临用前混匀.
(4)茵陈术附汤煎剂:以3∶6∶1.5∶1.5∶3∶1的比例将茵陈、白术、附子、干姜、炙甘草,肉桂备用,附子先煎60 min,其余药后下煎煮30 min,纱布过滤后滤液使用旋转蒸发仪将浓度浓缩至1 g/mL.
1.2 实验方法
1.2.1 寒性肝病模型的建立及药物组给药
小鼠随机分为5组,分别为正常组,慢性黄疸模型组,寒性肝病模型组,茵陈术附汤阳性组(10 g/kg),甲嘎松汤组(0.66 g/kg).模型及各药物组隔日早上皮下注射ANIT橄榄油(50 mg/kg),每天上午寒性肝病模型组、茵陈术附汤组、甲嘎松汤组灌胃番泻叶汤剂,慢性黄疸模型组给予等量生理盐水,药物组每天下午灌胃对应药物.正常组给予等量生理盐水.ANIT造模14天后取材.
1.2.2 样本采集与实验方法
小鼠眼眶取血后,静置分离血清,检测血清中ALT、AST、AKP及TBA含量;取肝最大叶肝尖部位的组织和回肠组织,进行HE染色和Masson染色,并在显微镜下观察其病理形态改变;通过免疫荧光共定位观察肝组织中P-Smad2/3的入核情况;取部分肝组织用qPCR荧光定量的方法检测肝脏中FXR、MRP2、NTCP、MMP2、MMP13、TIMP1的转录水平和采用Elisa法测定TGF-β1的含量;取部分回肠组织,通过免疫荧光共定位的方法检测ZO-1和Occludin的阳性表达;将剩余的小肠组织制备10%的肠匀浆,检测GSH、GSSG和MDA含量、HO-1、NQO1、FXR、IL-10 mRNA的水平和采用Elisa法测定IL-1β的含量;此外,使用LC-MS进行定量检测血清中胆汁酸的成分和含量.
1.3 统计学方法
对数据进行正态检验(Kolmogorov-Smirnov test)及方差齐性检验(Bartlett′s test)后,对于符合正态分布,方差齐的数据进行单因素方差分析,组间比较使用多重T检验(Tukey′s).对于不符合正态分布或方差不齐的数据,使用使用Dunnett’s T3检验.P值小于0.05被认为具有统计学差异.使用GraphPad Prism 8.0作图.
2 实验结果
2.1甲嘎松汤对寒性肝病模型动物肝损伤的作用
2.1.1对肝脏功能指标的调控
如图1,与正常组相比,慢性黄疸模型与藏医寒性肝病模型的肝功酶ALT、AST、AKP、TBA均显著升高,但两者没有明显差异.茵陈术附汤和甲嘎松汤均能改善藏医寒性肝病模型的肝功酶和血清总胆汁酸的升高.
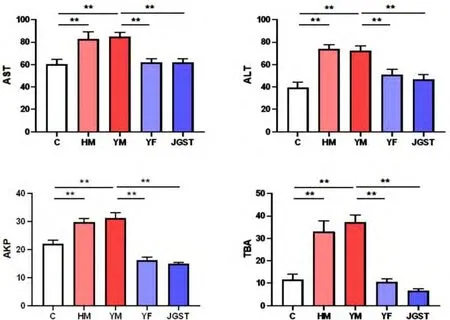
图1 甲嘎松汤对寒性肝病模型肝功酶的调控(Mean±SEM,n=8)注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组,**p<0.01Fig.1 The regulation of JGST on liver function enzymes inCold-Liver disease model(Mean±SEM,n=8)
2.1.2 对肝脏病理损伤的改变
如图2,慢性黄疸模型出现炎症浸润和胆管增生,寒性肝病模型的炎性浸润和胆管增生显著加重,茵陈术附汤和甲嘎松汤能够改善寒性肝病模型的炎症浸润和胆管增生.

图2 甲嘎松汤对寒性肝病模型病理损伤的改变(200×,n=6)注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组Fig.2 Effect of JGST on pathological damage of Cold Liver disease model(200×,n=6)
2.1.3 对肝脏胆汁酸蛋白的影响
如图3所示,慢性黄疸模型及寒性肝病模型会抑制肝脏FXR及其下游蛋白MRP2、NTCP的转录,甲嘎松汤和茵陈术附汤能提高FXR、MRP2、NTCP的转录水平,提示甲嘎松汤有助于缓解肝脏胆汁酸淤积.

图3 甲嘎松汤对寒性肝病模型肝脏胆汁酸蛋白的影响(Mean±SEM,n=8)注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组,*P<0.05,**P<0.01.Fig.3 Effect of JGST on bile acid protein in Cold Liver disease model(Mean±SEM,n=8)
2.1.4肝脏Masson染色的改变
寒性肝病模型与慢性黄疸模型比较,胶原沉积增多,胶原容积分数增大,甲嘎松汤与茵陈术附汤均能改善寒性肝病模型的胶原沉积,如图4.

图4 甲嘎松汤对寒性肝病模型Masson染色的改善(200×,n=6)注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组Fig.4 Improvement of JGST on masson of Cold Liver disease model(200×,n=6)
2.1.5 对TGF-β1/P-Smad通路的影响
如图5所示,寒性肝病模型P-Smad2/3阳性表达显著高于正常组和慢性黄疸模型组,甲嘎松汤和茵陈术附汤均能降低P-Smad2/3的入核,降低肝脏TGF-β1的含量,下调αsma的转录.

图5 甲嘎松汤对寒性肝病模型TGF-β1/P-Smad通路的作用注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组;P-Smad2/3,n=3,放大倍数400X;αsma、TGF-β1,n=8;*P<0.05,**P<0.01Fig.5 Effect of JGST on TGF-β1/P-Smad pathway in Cold Liver disease model
2.1.6 对纤维化调控因子的作用
寒性肝病模型中纤维化相关因子MMP13和TIMP1的升高,茵陈术附汤能下调MMP13、TIMP1转录.甲嘎松汤能降低寒性肝病模型中肝脏MMP2和MMP13的升高,但对TIMP1无明显作用,如图6.

图6 甲嘎松汤对寒性肝病模型纤维化调控因子的作用(Mean±SEM,n=8)注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组,*P<0.05,**P<0.01Fig.6 Effect of JGST on fibrosis regulatory factors of Cold Liver disease model(Mean±SEM,n=8)
2.2 甲嘎松汤对寒性肝病模型动物肠道损伤的作用
2.2.1 肠道屏障损伤的影响
图7,慢性黄疸模型和寒性肝病模型肠道出现绒毛断裂,ZO-1和Occludin的表达下降(病变部位如黄色箭头所示),其中Occludin在寒性肝病模型表达比慢性黄疸模型稍低(病变部位如黄色箭头所示).甲嘎松汤和茵陈术附汤均能改善寒性肝病模型的肠绒毛断裂,增加ZO-1和Occludin的表达.

图7 甲嘎松汤对寒性肝病模型肠道屏障损伤的作用注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组;HE,n=6,放大倍数100×;ZO-1、Occludin,n=3,放大倍数400×,病变部位用黄色箭头表示Fig.7 Effect of JGST on intestinal barrier injury in Cold Liver disease model
2.2.2 对肠道氧化损伤的影响
如图8所示,慢性黄疸模型和寒性肝病模型的抗氧化酶GSH、NQO1、HO-1较正常组显著下降,氧化物MDA、GSSG显著上升,抗氧化指标GSH/GSSG显著下降.寒性肝病模型相比慢性黄疸模型,GSSG显著升高,GSH/GSSG显著下降.甲嘎松汤和茵陈术附汤均能改善上述指标.

图8 甲嘎松汤对寒性肝病模型肠道氧化损伤的作用(Mean±SEM,n=8)注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组,*P<0.05,**P<0.01Fig.8 Effect of JGST on Intestinal oxidative damage in Cold Liver disease model(Mean±SEM,n=8)
2.2.3 对肠道炎症的影响
如图9所示,慢性黄疸和寒性肝病模型上调了致炎因子IL-1β的表达,抑制了抗炎因子IL-10的转录.甲嘎松汤、茵陈术附汤均能降低IL-1β的表达,增强抗炎因子IL-10的转录.
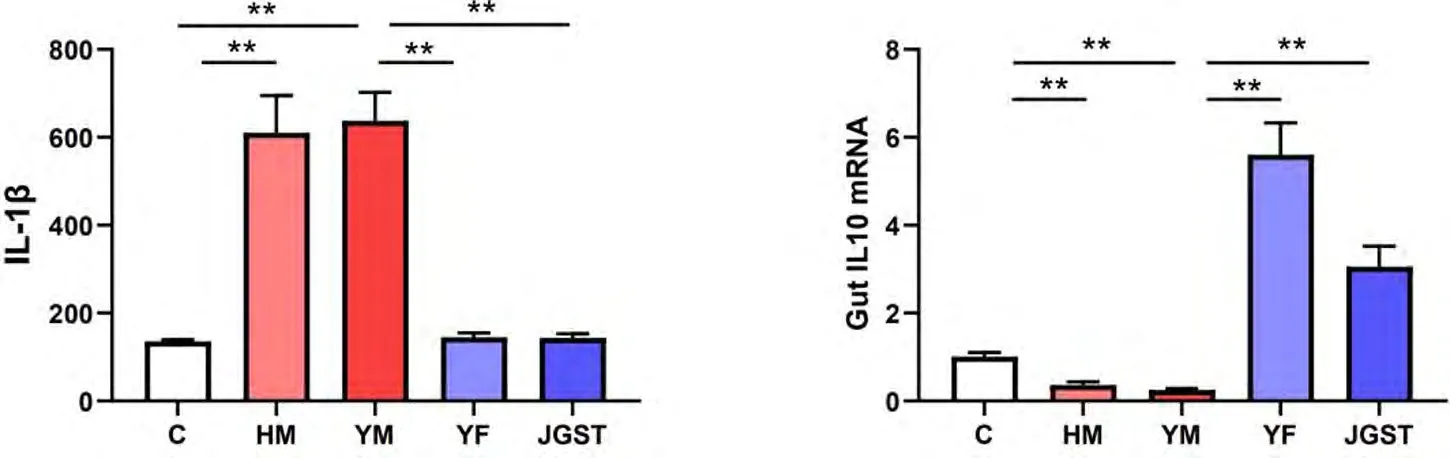
图9 甲嘎松汤对寒性肝病模型肠道炎症损伤的作用(Mean±SEM,n=8)注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组,**P<0.01Fig.9 Effect of JGST on intestinal inflammation damage in Cold Liver disease model(Mean±SEM,n=8)
2.2.4 对肠FXR的作用
如图10,显示慢性黄疸模型及寒性肝病模型抑制了肠FXR的转录,甲嘎松汤、茵陈术附汤能显著增加肠FXR的转录.

图10 甲嘎松汤对寒性肝病模型肠FXR的作用(Mean±SEM,n=8)注:C正常组,HM慢性黄疸模型组,YM寒性肝病模型组,YF茵陈术附汤组,JGST甲嘎松汤组,**P<0.01Fig.10 Effect of JGST on intestinal FXR in Cold Liver disease model(Mean±SEM,n=8)
2.3 甲嘎松汤对寒性肝病模型动物血清胆汁酸图谱的作用
2.3.1 对血清胆汁酸的总体作用
如图11中OPLS-DA和聚类热图主要表现胆汁酸的总体变化,显示寒性肝病模型与慢性黄疸模型相比,血清胆汁酸成分总体具有明显差异.甲嘎松汤给药组与寒性肝病模型组相比,血清胆汁酸图谱有明显变化.
3.3.2 对血清胆汁酸差异的作用
如图12,慢性黄疸模型组与正常组比较,抗炎作用胆汁酸ω-MCA显著减少,毒性胆汁酸TCA,TβMCA的升高.寒性肝病模型相比慢性黄疸模型,血清中大量胆汁酸成分增加,其中毒性TCA、TLCA、TβMCA的含量较慢性黄疸模型显著增加.甲嘎松汤给药后,血清中各类胆汁酸均表现为明显下降,其中毒性胆汁酸TLCA、DCA、LCA、TCA、TCDCA均减少.
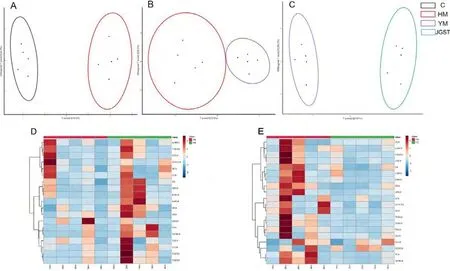
图11 慢性黄疸模型、寒性肝病模型与甲嘎松汤给药组血清胆汁酸总体变化注:A为正常组与慢性黄疸模型组的OPLS-DA图;B为慢性黄疸模型组与寒性肝病模型组OPLS-DA图;C为肝寒模型组与甲嘎松汤给药组OPLS-DA图;D为寒性肝病模型和慢性黄疸模型聚类热图;E为甲嘎松汤给药组与肝寒模型聚类热图,n=5Fig.11 Overall change of serum bile acid between chroniccholestasis,cold liver disease and JGST administration group

图12 慢性黄疸模型、寒性肝病模型与甲嘎松汤给药组血清胆汁酸差异注:图A,慢性黄疸模型组与正常组相比,血清差异胆汁酸成分;图B,寒性肝病模型组与正常组相比,血清差异胆汁酸成分;图C,甲嘎松汤给药后为与模型组相比,血清胆汁酸变化;n=5Fig.12 The difference of serum bile acid between chroniccholestasis,cold liver disease and JGST administration group
3 讨论
藏医理论认为,寒性肝病有食欲不振,消化功能减退,大便稀薄的特征.番泻叶有泻下作用,会造成大便稀薄,同时会出现食欲不振、消化酶减少等消化功能减退的症状[8].本研究拟采用番泻叶模拟寒性肝病胃火势微弱,消化功能减退,大便稀薄的症状特征,在慢性黄疸模型的基础上添加番泻叶造模.通过检测肝功酶,观察肝脏和肠道的病理,以及肠道上皮屏障的改变,结果显示寒性肝病模型肝脏中碱性磷酸酶、总胆汁酸明显升高,胆管增生明显,提示动物出现了黄疸,同时肝脏出现胶原沉积、肠道以及肠上皮屏障的损伤更严重,且造模过程中实验动物出现大便稀薄状况,提示初步建立了藏医的寒性肝病模型.
藏医将肝病各种表现症状归纳为三种不同症型,均呈现有皮肤略暗黄或暗黄症状.寒性肝病(“培根”症型)的症状,除巩膜和皮肤略呈暗黄外,伴有消化不良、食欲不振、大便不成形[3].从上述症状分析,寒性肝病以慢性黄疸以及肠道损伤为主要病变特征.根据ANIT的造模原理,其通过诱导胆管上皮释放炎症因子诱发肝脏炎症,造成肝内胆汁淤积[9].前期研究发现,多次注射ANIT制备慢性胆汁淤积模型,会出现胆汁酸稳态失衡.肠道中胆汁酸含量异常有可能导致肠道损伤.在寒性肝病模型中,肠道紧密连接蛋白ZO-1和Occludin表达显著下降,肠绒毛断裂,致炎因子IL-1β升高,抗炎因子IL-10降低,抗氧化指标GSH/GSSG显著下降,氧化产物GSSG显著升高,提示在寒性肝病模型中,肠道出现明显氧化损伤、炎症损伤和肠屏障损伤.
现代医学肠肝轴理论认为,肠和肝脏的关系密切.肠和肝通过多种介质互相联系,其中肠道菌群代谢物和胆汁酸是联系肝肠的两种重要介质[10].对于胆汁淤积作用机制的研究,主要以核受体为靶点.寒性肝病模型中肠胆汁酸受体FXR转录被明显抑制,其下游的ASBT趋势相同.而ASBT的减少,表明肠道对胆汁酸的重吸收功能减弱.在该模型中,血清胆汁酸成分较慢性模型出现显著差异.ω-MCA被认为是具有抗炎作用的胆汁酸[11],TCA和TβMCA被认为对于肝脏有毒性作用[12-13].其中TCA是艰难梭菌的强效诱发剂,提示了肠道菌群结构的失调[14].在寒性肝病模型中血清ω-MCA的减少,TCA和TβMCA的增多提示胆汁酸的正常转运被破坏,致使毒性胆汁酸的增多及有益胆汁酸的降低.
肠道损伤影响肝脏主要观点是“肠漏”学说,其理论在于肠道损伤后,肠道的模式损伤相关分子(PAMPs),进入肝门静脉,进而影响肝脏[15],胆汁酸是PAMPs的一种,其成分和量将通过肠肝循环影响肝脏.实验结果提示寒性肝病模型能够加重肠屏障的损伤,结合“肠漏”学说,提示寒性肝病模型可能是肠道的损伤加剧,肠通透性发生改变,使更多毒性胆汁酸穿过肠壁进入肝门静脉,加重胆汁酸肝肠循环障碍,导致寒性肝病模型的肝纤维化进程加重.
甲嘎松汤为藏族传统基础处方,常单独或联合其他中药用于小儿肝炎、寒性肝炎的治疗.藏医在治疗肝病时,主张治肝先保胃,肝胆脾胃同调理的治疗原则[3].实验观察到甲嘎松汤能够改善寒性肝病模型造成的肝损伤并且调节肝脏的胆汁酸受体FXR,增加胆汁酸转运蛋白MRP2和NTCP的表达,促进淤积的胆汁外排进肠道,减轻肝脏胆汁淤积.对寒性肝病模型造成的肠道氧化损伤、炎症损伤和肠屏障损伤均有显著的改善作用.提示甲嘎松汤能够通过调理胃肠以改善模型动物的胆汁淤积性肝损伤,其机制可能与通过激活FXR调节肠肝轴稳态有关.
综上所述,本研究在慢性黄疸模型基础上灌胃给予番泻叶汤剂初步建立了寒性肝病动物模型,同时甲嘎松汤能改善寒性肝病模型的肠肝轴损伤,表现为减轻寒性肝病模型造成的胆汁淤积,改善肠道屏障损伤及氧化炎症损伤,降低血清中毒性胆汁酸含量,其具体作用机制有待进一步探讨.

