赤霉素延缓‘丰水’梨落叶的生理机制
郝紫微,吴潇,戴雨沁,王鹏,张绍铃
(南京农业大学园艺学院梨工程技术研究中心,江苏 南京 210095)
近些年,梨早期落叶问题较为严重,一直影响梨的产量和品质,使果农每年都遭受很大损失。梨早期落叶是指在10月中上旬以前,梨正常生长期内出现的叶片大量脱落现象[1]。梨早期落叶的诱因有:气候异常、病虫危害、管理不当和品种适应性不良等[2-3]。早期落叶会严重影响树体营养累积,造成第2年梨果产量和品质下降[4]。在我国各产梨区均有不同程度的早期落叶现象发生,尤其是长江以南砂梨产区发生范围较广,危害较重[5]。梨花芽为混合芽,属夏秋分化型,通常花芽在8月已完成分化,且具备开花能力。梨早期大量落叶后,若遇到水分、温度适宜,树体则会打破休眠,部分花芽和叶芽萌发,出现二次开花和抽梢现象,导致树势减弱,严重影响梨的产量和品质。
植物器官脱落受多种激素的协同调控[6],对乙烯、赤霉素(GA)、生长素、脱落酸(ABA)、细胞分裂素这5种激素研究较多[7]。GA是一类化合物的总称,目前已鉴定出100多种[8],其中GA12是赤霉素合成过程中重要的中间体,而GA1、GA3、GA4等则具有较强生物活性[9]。目前,赤霉素在果树上应用广泛,可诱导葡萄产生无核果实[10];打破桃芽休眠[11];芒果正常果实及花梗即将脱落的果实和花梗的赤霉素含量高[12];喷施外源赤霉素可以抑制葡萄落粒[13];柑橘植株中赤霉素增加可以减少子房和果树脱落的发生[14-15]等。另外,赤霉素可以减缓RNA和蛋白质失活,增强蛋白质合成能力[16];作为自由基清除剂,GA可提高抗氧化酶如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性,调控植株衰老过程[17-18]。
活性氧(ROS)主要包括过氧化氢(H2O2)和超氧阴离子等,是植物细胞程序性死亡的关键调控因子,与发育过程和环境应激反应有关[19],在叶片脱落过程中起调节作用[20]。研究表明,活性氧的增加会促进植物器官的脱落,如在杨树[21]、烟草[22]以及荔枝[23]等植物中H2O2可加速植物器官的脱落。抗氧化酶如SOD可发生岐化作用产生过氧化氢和氧气,再经POD和CAT清除H2O2,从而延缓脱落[24]。硝基苯酚可通过增强SOD、CAT等抗氧化酶活性延缓番茄花和果实的脱落[25]。
本研究以‘丰水’梨为材料,通过石蜡切片观察叶柄离区组织形态,测定叶柄离区赤霉素、活性氧含量及抗氧化酶活性,研究喷施赤霉素后落叶率及活性氧和抗氧化酶的变化,旨在探寻赤霉素延缓‘丰水’梨叶片脱落的生理机制,为防治砂梨早期落叶提供理论依据。
1 材料与方法
1.1 试验材料及设计
供试品种为砂梨的代表品种‘丰水’梨。试验于2017年9月在四川省成都市龙泉驿区黄土镇和天府新区籍田镇的‘丰水’梨园进行,梨树树龄10年,长势良好。试验区属亚热带湿润季风气候区,气候温和,四季分明,雨量充沛,日照较少。分别在正常生长区(对照组)与早期落叶严重区(早期落叶组)随机挑选3株梨树,每株选取3枝带有叶片的1~2年生果枝整枝(不含新梢),放于样品袋中。从清洗过的枝条样本上取长、宽均为0.3~0.5 mm的叶柄离区组织,去除芽,取叶柄和枝各一半,样品包括离区细胞及邻近的细胞,用于石蜡切片观察和赤霉素、抗氧化酶及活性氧的测定。
于2018年6月14日、7月4日、7月24日、8月14日、8月21日、9月4日在江苏省南京市浦口区江浦实验农场取样。‘丰水’梨树龄15年,长势一般,株行间距2~3 m,常规管理,落叶率50%~60%。采集早期落叶严重的‘丰水’梨树叶柄离区组织,用于石蜡切片观察。
于2018年和2019年9月至11月,在江苏省南京市溧水区南京农业大学白马基地选取树龄4年、长势良好、无落叶情况发生的‘丰水’梨树,正常管理,立地条件同南京市浦口区江浦实验农场,用于植物生长调节剂喷施处理及外源喷施不同浓度赤霉素对叶柄离区抗氧化酶和活性氧影响试验。
1.2 试验方法
1.2.1 叶柄离区解剖结构观察将叶柄离区样品浸泡在FAA固定液(38%甲醛5 mL、冰醋酸5 mL、70%乙醇90 mL)中,经脱水、透明、浸蜡、包埋、修块与切片、脱蜡、染色(甲苯胺蓝染色法)、封片、镜检后,观察正常树与早期落叶严重树的叶柄离区在细胞组织形态上的差异,以及发生落叶梨树叶柄离区的动态变化。
1.2.2 赤霉素、活性氧含量及抗氧化酶活性测定将‘丰水’梨叶柄离区从枝条上取下后,立即用液氮速冻,-80 ℃保存备用。赤霉素含量测定采用Chen等[26]的方法。抗氧化酶[过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)]活性及活性氧[过氧化氢(H2O2)和超氧阴离子]含量采用苏州科铭生物技术有限公司的相关试剂盒测定。
1.2.3 叶片保留率统计于2018年和2019年9月至11月在江苏省南京市溧水区南京农业大学白马基地,选取27株树势相当、长势良好的‘丰水’梨树,用4种植物生长调节剂进行叶面喷施处理,每6~8 d喷施1次,每年6次。每株随机选取树冠外侧4个不同方向生长健壮的枝条(不含新梢),处理前统计每个枝条的叶片数,每隔6~8 d统计1次。植物生长调节剂分别为0.4和0.8 g·L-1乙烯利(ETH),0.5和1.0 mg·L-1赤霉素(GA3),0.3和1.0 mg·L-1脱落酸(ABA),0.3和0.6 mg·L-1生长素(IAA),以清水为对照,每个激素水平处理3株树。叶片保留率=叶片数/最初叶片总数×100%。
1.2.4 赤霉素处理后抗氧化酶活性及活性氧含量测定于2019年10月8日至10日在南京农业大学白马基地随机选取‘丰水’梨树不含新梢、生长势一致的健壮枝条,带回实验室后将长度修剪为40 cm,放置于装有清水的烧杯中,每4 h使用GA3(0.5 和1.0 mg·L-1)喷施叶片,以清水处理为对照,共处理28 h,光照/黑暗时间为16 h/8 h,温度(25±1)℃。处理完成后采集枝条叶柄离区置于-80 ℃保存,用于活性氧相关物质含量及抗氧化酶活性测定。
1.3 数据分析
采用Excel 2016、GraphPad Prism 7和SPSS 22.0软件进行数据分析和图表绘制。2组独立样品显著性检验使用t测验,多组样品显著性检验使用One way-ANOVA方差检验和Duncan’s多重比较。
2 结果与分析
2.1 ‘丰水’梨叶柄离区的组织形态观察
由图1可见:‘丰水’梨早期落叶组的叶柄离区组织发生了明显的缢缩现象,离区的细胞比邻近细胞小且具有密集的细胞质。同一时期,正常生长树(对照组)的离层维管束完整,而脱落严重树的叶柄离层维管束有断裂趋势,说明早期落叶组与对照组的叶柄离区细胞形态学差异明显。由图2可见:离区处离层细胞比邻近细胞小并且具有密集的细胞质。随着时间的延长,离层细胞逐渐变小或被水解破坏,维管束宽度变窄,这可能为叶柄断裂脱落提供了结构基础。

图1 ‘丰水梨’对照组与早期落叶组叶柄离区石蜡切片对比Fig.1 Comparison of sectioned paraffin sections of control and early leaf abscission groups of ‘Hosui’pearA.对照组叶柄离区Petiole abscission zone of control group;B.早期落叶组叶柄离区组织Petiole abscission zone of early leaf abscission group.右侧是左侧图中方框部分的放大图。The right panel is an enlargement of the rectangle part of the left figure.
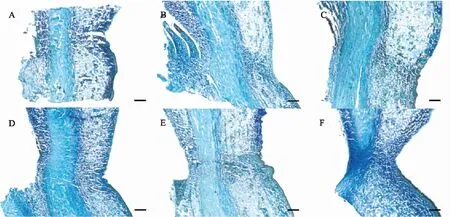
图2 早期落叶‘丰水梨’在叶柄发育过程中离层细胞的形态变化Fig.2 Morphological changes of abscission zone during petiole development in early leaf abscission‘Hosui’pearA—F表示采样日期分别为06-14、07-04、07-24、08-14、08-21、09-04时的叶柄离区。标尺=200 μm。A-F indicate the petiole abscission zone collected date on 06-14,07-04,07-24,08-14,08-21,09-04,respectively. Bar=200 μm.
2.2 ‘丰水’梨叶柄离区内源赤霉素、活性氧含量及抗氧化酶活性的变化
由图3可见:相比对照组,早期落叶组叶柄离区的赤霉素合成途径中关键中间体GA12含量极显著下降55.38%;具有生物活性的GA3和GA4含量也有所减少,分别降低了83.78%和43.59%,且GA3含量与对照组相比达极显著水平,GA1在落叶组样品中含量低于检测限,未能检出。

图3 ‘丰水’梨对照组和早期落叶组叶柄离区的赤霉素含量变化Fig.3 Changes of gibberellin(GA)content in control group(CK)and early leafs abscission group of ‘Hosui’pear** P<0.01. The same as follows.
由图4可见:与对照组相比,早期落叶组叶柄离区活性氧含量及抗氧化酶活性在籍田镇与黄土镇的梨树样品中均存在显著差异。早期落叶组叶柄离区的SOD、POD和CAT活性在2个城镇的梨树样品中均显著低于对照组,SOD分别降低53.71%和30.95%,POD 分别降低44.88%和75.82%,CAT分别降低62.09%和70.15%。早期落叶组叶柄离区中的超氧阴离子和H2O2含量都显著高于对照组,其中,2组早期落叶组中,H2O2含量分别增加22.09%和99.08%,超氧阴离子含量分别增加36.29%和21.00%。
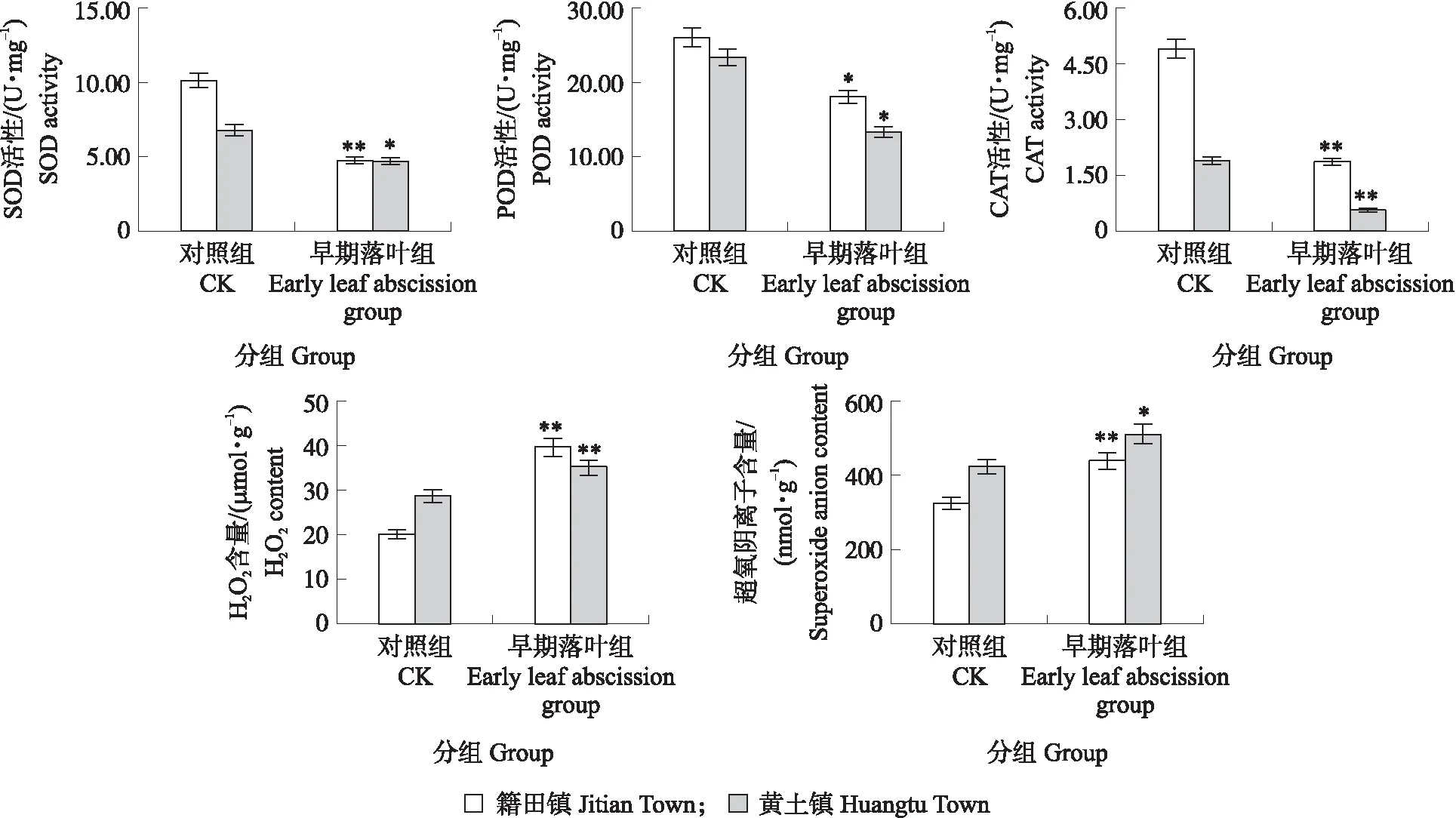
图4 ‘丰水’梨对照组与早期落叶组叶柄离区的抗氧化酶活性和活性氧含量变化Fig.4 Changes of the antioxidant enzymes activities and the reactive oxygen species(ROS)contents in control group and early leaf abscission group of ‘Hosui’pear*P<0.05.
2.3 外源喷施植物生长调节剂对‘丰水’梨叶片脱落的影响
喷施外源激素的2年试验表明:GA3可延迟叶片脱落进程,0.5和1.0 mg·L-1赤霉素处理均可提高叶片保留率,而1.0 mg·L-1赤霉素处理后叶片保留的时间更长(图5)。喷施1.0 mg·L-1赤霉素后37和34 d时,梨树叶片的保留率增加最为明显,2018年和2019年分别比对照增加1 023.08%和65.56%。而喷施不同水平的ETH却使叶片脱落加速。0.3和1.0 mg·L-1ABA处理后早期落叶组的叶片数低于对照组。IAA对‘丰水’梨叶片落叶影响较小。

图5 2018和2019年喷施不同生长调节剂对‘丰水’梨落叶的影响Fig.5 Effects of various plant hormones on leaf abscission of ‘Hosui’pear in 2018 and 2019
2.4 外源喷施不同质量浓度赤霉素对‘丰水’梨叶柄离区抗氧化酶活性和活性氧含量的影响
由图6可见:随着喷施浓度的增加,叶柄离区SOD和CAT活性增强。0.5 mg·L-1GA3处理对SOD和CAT活性影响较小,而1.0 mg·L-1GA3处理后,SOD和CAT活性均显著高于对照,分别提高45.96%和119.41%。随着GA3质量浓度的增加叶柄离区超氧阴离子含量逐渐降低,而H2O2含量无明显变化。表明GA3质量浓度为1.0 mg·L-1时抑制叶片脱落较好。

图6 GA3处理‘丰水’梨叶柄离区对抗氧化酶活性和活性氧含量的影响Fig.6 Effect of GA3 treatment on the antioxidant enzymes activities and the ROS content in abscission zone of ‘Hosui’pear不同字母表示处理间在0.05水平上差异显著。Different letters indicate the significant differences between treatments at 0.05 level.
3 讨论
植物器官脱落与赤霉素密切相关,刘妮等[27]研究结果显示,高水平的赤霉素浓度可以抑制梨萼片脱落。本研究结果表明,赤霉素处理可以显著增加‘丰水’梨树叶片保留率。与正常组相比,早期落叶组的叶柄离区有效赤霉素含量显著降低,甚至未能在叶柄离区中检测出具有生物活性的GA1,而且活性氧含量及主要抗氧化酶的活性均存在显著差异。此外,赤霉素处理后,发现叶柄离区中超氧阴离子和H2O2含量明显降低,而SOD和CAT活性显著升高,这与郭绍霞等[28]研究结果一致。由于赤霉素可以调控ROS产生,而ROS是导致植物发生细胞程序性死亡(PCD)的关键信号分子[29],从而调节植物器官的脱落[30],因此推测GA-ROS-PCD信号通路参与调控梨树叶片脱落过程,可以针对赤霉素和活性氧2个主要靶点开发调控梨树叶片脱落的药剂。
梨树的早期落叶受诸多因素影响,如气候条件、病虫害、品种特性、管理水平、树势等。本研究中,成都梨园出现的早期落叶现象可能是由于管理水平的差异,而在南京江浦实验农场发生早期落叶的梨园,进行常规管理也出现了早期落叶,可能是部分梨树株行距较窄,树冠郁闭,树势较弱。非病害引起的‘丰水’梨出现的早期落叶均表现为叶柄离区的赤霉素含量减少,抗氧化酶活性降低,活性氧含量升高。因此推测赤霉素可能通过促进抗氧化酶活性的提高,使组织细胞有较强的活性氧清除能力,减少活性氧在体内的积累,增强自身的防御能力,减轻对细胞的损害,以推迟植物PCD过程,延缓叶片脱落。
在本研究中,由非病虫害引起的早期落叶可以通过外源喷施赤霉素提高离区的抗氧化能力,延缓梨早期落叶的发生,‘丰水’梨树的最佳GA3处理浓度为1.0 mg·L-1。部分赤霉素氧化基因家族的表达由活性赤霉素来反馈调节[31-32]。GA1作为在高等植物中主要的活性赤霉素,在发生早期落叶的叶柄离区中未能检出,可能是赤霉素在不同组织中有一定的特异性。此外,赤霉素对器官脱落过程中相关基因的表达能否产生影响、产生何种影响以及赤霉素与活性氧调控的分子机制,还需进一步研究。赤霉素除了通过抗氧化酶影响PCD信号转导过程,是否还影响其他生物过程进而影响脱落,还需更深入的探讨。

