辽宁省重症新型冠状病毒肺炎17例临床特征分析
王 妍 , 祖太坤 , 李 丹 , 戴青荃 , 王 岩 , 宋 军 , 吴云海 , 刘 宾 , 刘劲阳 ,章志丹, 马晓春, 刘洪艳
冠状病毒是冠状病毒科中的一种非片段阳性RNA病毒,目前已知的感染人冠状病毒共有6种,包括α属229E、NL63,β属 OC43、HKU1、 SARSCoV、MERS-CoV[1]。大多数冠状病毒感染人体后症状均较轻,其中α属和β属中的OC43、HKU1主要导致普通感冒样症候群,但是 SARS-CoV 和MERS-CoV 感染人体后可引起严重的急性呼吸窘迫综合征(ARDS),文献报道的SARS-CoV及MERS-CoV 的病死率分别为10%和37%[2-3]。
自2019年12月以来,湖北武汉报告了数例病因不明的肺炎,随后波及全国乃至全球[4-5],世界卫生组织(WHO)将其命名为“coronavirus disease 2019(COVID-19)”[6],中国国家卫生健康委员命名为“新型冠状病毒肺炎”,简称“新冠肺炎”。新冠肺炎死亡多发生在重型、危重型病例中,目前有文献报道的重症病例病死率在12.1%[7],所以对于重型和危重型新冠肺炎患者的救治就显得尤为重要。本研究对辽宁省多中心收治的重症病例,进行回顾性分析,所有患者均有明确临床结局。
1 材料与方法
1.1 研究对象
纳入2020年1月22日-3月1日入住辽宁省2所新冠肺炎集中收治医院确诊新冠肺炎的患者,确诊及分型标准依照《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》执行[8],呼吸道标本或血液标本经实时荧光RT-PCR检测新型冠状病毒(SARS-CoV-2)核酸阳性。本组收治17例患者中15例属重型,2例属危重型。
1.2 研究方法
回顾性分析重症新冠肺炎患者的流行病学、人口统计学、临床表现、实验室及放射科检查结果、治疗、预后转归资料。临床结局随访至2020年3月16日。
1.3 统计学分析
所有统计学分析均使用SPSS 17.0版软件进行。计量资料描述为中位数及范围,计数资料描述为频数及百分比。
2 结果
2.1 一般情况
17例中男10例,女7例。年龄26~87岁,中位年龄50岁。3例有吸烟史。7例伴有慢性基础疾病,其中2例高血压,2例2型糖尿病,1例动脉粥样硬化性心脏病,1例慢性支气管炎,1例为双侧股骨头坏死的长期卧床患者。
2.2 流行病学史
由湖北省输入7例,其他省输入4例,本地感染6例。1例危重型与2例重型有亲属关系,为家族聚集性感染,其他14例间无相互接触或亲属关系,但17例重症患者与2所医院收治的确诊病例存在8簇家族聚集感染。湖北省输入病例中,包括高铁列车员、武汉当地职员、个体经营者,6例否认华南海鲜市场暴露史,1例危重型病例居住地离华南海鲜市场3 km,否认去过该市场。其他省病例均有高铁站、机场等人群密集场所逗留史。
2.3 临床表现
17例患者均存在发热,伴咳嗽13例,呼吸急促10例,乏力9例,肌肉酸痛8例,鼻塞/咽痛/流涕6例,恶心呕吐3例,腹泻2例。起病至确诊时间1~12 d,中位数4 d。除1例死亡外,其他患者发热持续时间7~16 d,中位时间10.5 d;热退时间在发病后第8~17天,中位时间第11天。发病至出现呼吸困难/呼吸急促时间1~15 d,中位时间8 d。
17例患者在病程中序贯器官衰竭(SOFA)评分较基线提升2分以上(包含2分),发生在发病第4~18天,中位时间第10天。6例病程中出现呼吸衰竭,5例出现不同程度ARDS。
2.4 实验室和影像学检查
入院首次实验室检查报告,血常规白细胞计数升高5例、正常12例,淋巴细胞计数绝对值降低12例、正常5例。13例CRP升高。所有患者入院时均无PCT升高。9例出现轻度肝功能损伤,以转氨酶升高为主,低蛋白血症1例。入院时无肾脏损伤病例。肌酸激酶升高2例,乳酸脱氢酶升高7例。D-二聚体升高4例。
所有患者淋巴细胞计数随病程均先降后升,15例低于正常值范围,下降极值出现在发病第4~18天,中位数第12天。14例发生不同程度肝损伤,13例仅表现为转氨酶升高, 2例伴有总胆红素升高,发生在发病第2~19天,中位数第9.5天。低蛋白血症5例,发生在发病第7~20 d,中位数第17 d。1例出现轻度肾损伤,发生在发病第5天。15例检测肌酸激酶,5例升高,发生在发病第4~16天,中位数第12天。未发现肌钙蛋白升高患者。乳酸脱氢酶升高6例,出现在发病后第6~13天,中位数第11天。13例出现不同程度D-二聚体升高,高峰时间在发病第7~29天,中位数第13.5 天。
所有患者均在入院及病程中监测胸部CT变化。1例典型患者,入院时诊断为轻型病例,肺部未见明确炎性改变,随着病情进展肺部出现磨玻璃影并且范围迅速扩大、衍变,经抗病毒、氧疗等综合治疗后,肺部影像逐渐见好转。肺部影像学特点:①起病时,无明显改变;②早期,病变局限,呈斑片状、亚段或节段性磨玻璃影(图1);③进展期,病灶增多、范围扩大,累及多个肺叶,部分病灶实变,磨玻璃影与实变影或条索影共存,病变内血管影增粗,细支气管扩张,有时会出现“铺路石征”;④重症期,病灶进一步扩大,可呈弥漫性病变,实变影为主,合并磨玻璃影,多伴条索影,支气管充气征(图 2);⑤治疗吸收期,实变影、磨玻璃影、“铺路石征”逐渐吸收;⑥恢复期,双肺遗留磨玻璃影、索条影、网状影缓慢吸收、消散(图3)。
2.5 治疗
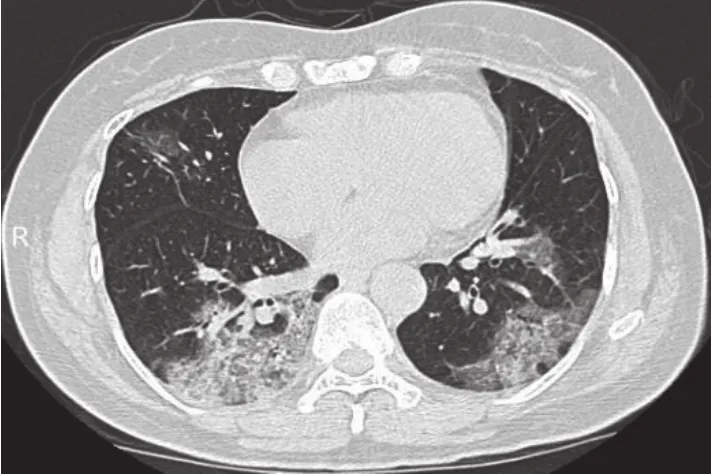
图1 感染早期肺部CT表现Figure 1 Chest CT image of early-stage COVID-19

图2 重症期肺部CT表现Figure 2 Chest CT image of severe COVID-19 case
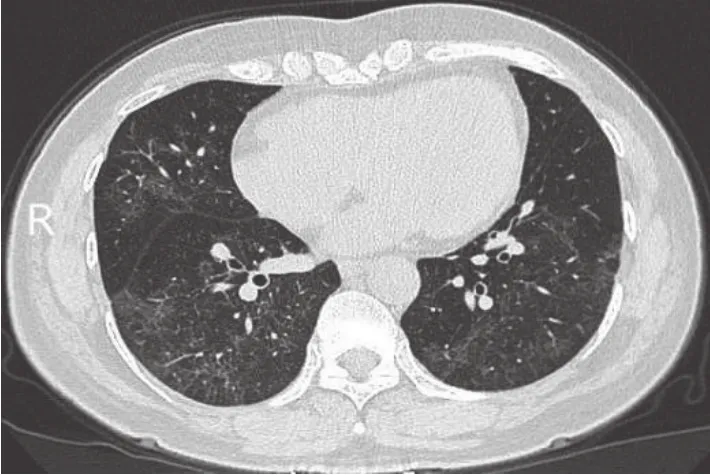
图3 恢复期肺部CT表现Figure 3 Chest CT image of patient in convalescent period
所有患者均接受吸氧治疗,接受治疗时间为发病第1~16天,中位数第3天,氧疗持续时间1~41 d,中位数13.5 d。单纯低流量吸氧5例,使用经鼻湿化高流量吸氧(有或没有低流量吸氧)10例;1例危重型先后采用鼻导管低流量、经鼻湿化高流量、无创呼吸机、有创呼吸机、体外肺膜氧合(ECMO)呼吸支持;另1例危重型病例使用低流量吸氧及有创呼吸机辅助通气至最终死亡。
所有患者均接受抗病毒治疗,包括洛匹那韦/利托那韦、α干扰素,阿比多尔、磷酸氯喹。单用洛匹那韦/利托那韦7例,单用阿比多尔3例,7例联合使用包含上述中2种抗病毒药物。
15例患者在住院过程中使用抗菌药物治疗,其中4例已在确诊新冠肺炎前开始使用左氧氟沙星、莫西沙星。另11例在确诊为重型/危重型后,单一使用莫西沙星6例,4例使用2种以上广谱抗菌药物,包括利奈唑胺、美罗培南、头孢哌酮钠-舒巴坦钠;开始使用抗菌药物时间在发病第1~17天,中位数第5天,使用总时间2~30 d,中位数9 d。1例危重型患者病程中使用抗真菌类药物,使用卡泊芬净70 mg/d,共7 d。所有病例均因实验室生物安全问题,未行细菌、真菌病原学检测,抗菌药物使用根据患者临床症状、炎症指标变化等由专家组根据临床经验选择应用。有8例使用糖皮质激素治疗,最大剂量为1.19 mg·kg-1·d-1,开始使用在发病第2~13天,中位数第10天,使用时间3~28 d,中位数17.5 d。有3例使用丙种球蛋白,均在起病1周内使用。10例病程中应用胸腺肽类药 物。
2.6 转归
截至2020年3月16日,17例患者治愈出院16例,死亡1例。出院患者的住院天数14~42 d,中位数22 d。1例危重型患者在确诊后第2天突发呼吸心跳骤停死亡。治愈出院患者发病至病毒核酸阴转时间(咽拭子、痰液RT-PCR检测)14~50 d,中位数27 d。
3 讨论
17例重症患者以异地输入为主,有7例存在慢性基础疾病,中位年龄50岁。研究显示新冠肺炎患者中,重症组与非重症组组间年龄差异有统计学意义,重症组合并基础疾病的比例高于非重症组且差异有统计学意义[9]。提示老年人和存在基础疾病者发生新冠肺炎重型、危重型的风险更高,年龄的增加与死亡有关[10]。而本组转归较大可能与患者的中位年龄构成有关。
所有患者起病均有发热症状,其次为咳嗽、呼吸急促、伴或不伴有乏力、肌肉酸痛、鼻塞 /咽痛/流涕等,发生和持续时间与其他报道相似 [9, 11]。
实验室指标中所有患者的淋巴细胞计数均呈早期下降、随病情改善后回升,下降极值出现在发病后第12天。在Zhou等[10]研究中,生存者的淋巴细胞计数在发病后第7天最低,并在住院期间得到改善,而死亡病例呈严重的淋巴细胞计数减少,直到死亡。研究因为仅纳入重型、危重型病例,故而淋巴细胞极值出现的时间延后。
目前认为新冠肺炎早期出现的肝损伤,首先考虑由病毒感染的直接损伤和诱导体内的炎性反应所致,对于治疗中发生的肝损伤,可能由抗病毒治疗和中药治疗所致[12],所以应根据肝损伤发生的时间和程度,停用可疑的肝损伤药物,调整治疗方案。白蛋白在一般急性或轻度肝损伤中可无明显下降,本组共有5例出现低蛋白血症。低蛋白血症可能与重症患者蛋白质消耗过多、腹泻丢失以及摄入减少等有关[13],针对此情况,给予患者必要营养支持,可酌情补充免疫球蛋白、白蛋白,以提高机体的免疫力。
目前认为无论有无心血管系统基础疾病,心肌损伤标志物的异常升高广泛存在于新冠肺炎确诊患者中,且与病情进展和预后密切相关[14]。在本研究中,5例心肌酶升高,发生中位时间12 d,乳酸脱氢酶升高6例,出现在第11天。本组未发现肌钙蛋白升高病例,这可能也是预后结局较好的原因之一。
本组有13例出现不同程度D-二聚体升高,高峰时间发生在第13.5天。既往的文献显示,约90%肺炎住院患者凝血活性增加,表现为D-二聚体水平增高[15]。在Zhou等[10]的研究报道中,D-二聚体大于1 μg/L与新冠肺炎的死亡有关,可能的机制为:急性炎性反应导致动脉粥样硬化斑块的破裂,诱导促凝因子以及血流动力学改变,从而导致缺血和血栓形成。因此在对重症新冠肺炎的救治中,应及时评估发生静脉血栓栓塞症的风险,对高危者实施有效的预防,警惕肺血栓的发生,及时给予相应治疗。
SOFA评分是脓毒症和脓毒性休克的良好诊断指标,反映多器官功能障碍的状态和程度。通常认为细菌感染是脓毒症的主要原因,但病毒感染也会导致脓毒综合征。在Zhou等[10]的研究中,入院时SOFA评分较高是住院死亡的相关因素之一。本研究中,所有患者病程中均有SOFA评分较基线升高2分,说明所有病例均有脓毒症表现,但未出现脓毒性休克。
重型和危重型新冠肺炎患者的肺部CT影像学典型改变是双侧多灶性斑片状磨玻璃影,随着病情的进展,可出现双肺多发性小叶和节段性实变,且影像学异常比非重症患者更为明显[16]。本研究中,所有患者的肺部影像学均符合典型的病毒性肺炎表现。重症患者肺部CT变化往往早于临床表现。治疗后肺CT表现逐渐好转,但在出院后第2周及第4周复查时,肺部仍可见磨玻璃影的改变,所以对于确诊患者应在临床观察的同时及时复查肺部CT,以便发现病情变化。
所有患者在发病后第3天接受氧疗,而发病至出现呼吸困难中位时间为8 d,提示在患者主观感受呼吸困难前,已经需要氧气支持治疗。专家共识[17]建议对于呼吸频率≥30次/min 和/或自然呼吸下血氧饱和度≤93% 的新冠肺炎患者应立即开始 5 L/min的初始氧疗。研究表明,经鼻湿化高流量吸氧在急性低氧型呼吸衰竭患者中是安全有效的,可以降低有创通气患者的比例[18]。
有效的抗病毒治疗可以改善新冠肺炎的疗效,目前推荐的抗病毒药物有洛匹那韦/利托那韦、α干扰素,阿比多尔、磷酸氯喹。但在洛匹那韦/利托那韦治疗重症新冠肺炎患者的随机对照研究中显示,两药没有明显临床改善作用,也没有降低死亡率[19]。其他药物如瑞德西韦正在进行随机临床试验。
糖皮质激素用于治疗重型病毒性肺炎一直存在争议,但有研究显示,中低剂量糖皮质激素免疫抑制治疗未延长新冠肺炎患者的病毒清除时间[20]。而重症新冠肺炎患者出现肺水肿和肺透明膜形成,提示ARDS[21]。使用糖皮质激素可以减轻或阻止ARDS进展。本研究中共有8例使用糖皮质激素治疗,开始使用中位时间在发病后第10天(第2~13天),使用时间3~28 d,中位数17.5 d。使用时间较长主要是因为激素逐渐减量使用的原因。截至2020年3月16日,尚未发生严重不良反应,但因时间较短尚需进一步追踪评估。
本组有11例在确诊后使用抗菌药物,包括单药使用6例,联合使用5例。联合使用抗菌药物主要应用在住院时间长、有创操作、可能发生医院感染的病例中。因生物安全问题未行相关病原学检测,可根据所在科室的细菌流行病学选用抗菌药 物。
除1例死亡病例外,其他16例患者在符合以下条件时给予咽部、痰液病毒核酸检测:①体温恢复正常3 d以上;②呼吸道症状明显好转;③肺部影像学显示急性渗出性病变明显改善。发病至核酸阴转时间14~50 d,中位数27 d,与已报道的20 d差异较大[9],原因是本组患者全部是重型、危重型病例,且没有短间距的持续采样。
综上,重症患者有发热持续时间长,淋巴细胞计数早期下降、随病情改善后回升的表现,病程中严密监测肝功能、心肌损伤指标、D-二聚体,并及时干预,以预防不良事件的发生,针对重症患者的长期消耗,应给予必要营养支持,可酌情补充免疫球蛋白及白蛋白,以提高机体的免疫力。在患者主观感受呼吸困难前已经需要氧气治疗,目前经鼻湿化高流量吸氧可以满足大部分患者的氧气供应,一定程度可以避免有创插管等操作。目前仍建议重症病例应用抗病毒药物治疗,小剂量的糖皮质激素可以减轻肺部渗出、改善ARDS,且短期使用未发现严重不良反应。在目前国家联防联控的机制下,辽宁省能够做到早发现、早隔离、早治疗重症新冠肺炎病例,重症患者死亡率较低。

