脓毒症并发急性呼吸窘迫综合征的危险因素及预测评分研究 进展
张芮豪,夏金根,詹庆元*
1中日友好医院呼吸中心/呼吸与危重症医学科;北京 100029;2国家呼吸系统疾病临床医学研究中心,北京 100029;3北京协和医学院中日友好临床医学研究所,北京 100029
脓毒症(sepsis)是由感染引起的全身炎症反应综合征(systematic inflammatory response syndrome,SIRS),可通过严重的肺部感染直接造成肺损伤,或因其他部位的严重感染间接造成肺损伤,进而发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[1]。脓毒症是ARDS最常见的诱因,25%~50%的ARDS是由脓毒症引起的[2-3]。脓毒症相关ARDS不同于非脓毒症相关ARDS,两者的临床特点、预后[4-5]及炎性因子等生物标志物水平[5-6]均具有明显差异。ARDS为ICU内常见的危重症,病死率为30%~40%[7]。患者住院期间发生ARDS意味着病死率更高,出院后长期预后更差[8],医疗负担更重[9]。而且ARDS的治疗难度大,药物治疗效果差[7],目前仍是采取以肺保护性通气、严格的液体管理及体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)等器官支持为主的治疗策略[7,10]。 一项国际性多中心前瞻性研究表明,对于未发生ARDS的患者临床管理具有较大提升空间[10]。因此,很多学者主张早期识别急性肺损伤(acute lung injury,ALI),以降低ARDS的发病率[11]。但在实际临床工作中,绝大多数患者虽然有风险,但最终未发生ALI/ARDS[12]。因此应早期准确识别并筛选合适的人群进行肺保护等干预策略[13]。
近10年来,有关早期识别ALI/ARDS的危险因素及预测评分研究较多,其中最受关注的是肺损伤预测评分(lung injury prediction score,LIPS),并有许多研究在LIPS的基础上进行了简化,或是在LIPS的基础上加入一些生物标志物。有研究在对脓毒症相关ARDS进一步分类时发现,肺部感染较其他部位感染发生ARDS的风险更高[14],因此,肺部感染发生ARDS的危险因素也值得关注。本文就脓毒症患者及肺部感染患者发生ARDS的危险因素、ALI/ARDS预测评分、LIPS衍生评分的研究进展进行综述。
1 发生ARDS的危险因素
1.1 脓毒症患者发生ARDS的危险因素 对于脓毒症患者,根据疾病阶段不同可分为:①基于SIR S标准定义的脓毒症患者;②与器官功能障碍、低灌注或低血压有关的严重脓毒症患者; ③合并不能被其他原因解释的、以低血压为特征的、急性循环衰竭的脓毒性休克患者[15]。
1.1.1 基于SIRS标准定义的脓毒症 Seethala等[16]发现,6%的急诊脓毒症患者发生了ARDS,且病死率明显增高;APACHE Ⅱ评分、年龄、早期液体给药量、肺源性脓毒症、休克、胰腺炎和急腹症与ARDS的发生有关。此外,Seethala等[16]指出,液体管理是唯一可以改变的暴露因素,尤其对于未休克的脓毒症患者应实行严格的液体管理,需要根据脓毒症的严重程度确定最佳早期复苏策略,寻找ARDS与休克之间的平衡。而基于序贯器官衰竭评分(sequential organ failure assessment,SDFA)的Sepsis 3.0定义重视对器官功能障碍的评估[17],对于脓毒症患者,除肺脏以外的其他脏器功能也与ARDS密切相关。发生ARDS的患者入ICU时常合并其他脏器功能不全,尤其是神经系统及凝血系统功能不全是脓毒症患者发生ARDS的危险因素[18]。血管生成素2(angiopoietin-2,ANG-2)是一种调节内皮细胞通透性的促炎细胞因子[19],血ANG-2水平升高对ARDS的发生具有预测价值[20-22]。Ioakeimidou等[23]研究了脓毒症进展过程中炎性介质的变化,发现血ANG-2水平升高与脓毒症患者发生休克及ARDS等病情恶化相关。
1.1.2 严重脓毒症 Mikkelsen等[24]发现,LIPS评分、入院早期血清乳酸水平是ARDS发展的独立危险因素。此外,休克作为ARDS的危险因素,对急诊和ICU患者的影响不同:急诊中仅12%的休克患者发生ARDS[24],而ICU中近40%的感染性休克患者发生ARDS[12,25]。
1.1.3 脓毒性休克 内皮细胞损伤介导了器官衰竭,内皮细胞特异性分子(Endocan)作为一种生物标志物,其水平降低可作为预测器官衰竭(包括呼吸衰竭)的危险因素[26]。既往研究发现,酗酒史[27]、 低白蛋白血症[28]、输血史[29]、肺部感染[3]及糖尿病史[30]与ALI的发生相关,而ALI发展的时间常不能明确,难以区分风险因素与治疗的影响。Iscimen等[25]研究发现,延迟治疗休克和感染后,近50%的脓毒性休克患者发生ALI/ARDS,且大多数患者是在脓毒性休克12 h内发生ALI;将ALI的危险因子(最近的化疗、输血、误吸、糖尿病和酗酒史)调整一致后,ALI的发生与休克治疗延迟、感染控制不足、呼吸频率较快明显相关,且发生ALI/ARDS的患者病死率也明显增高。因此,评估ARDS的发生风险及发生时间需要考虑抗休克及抗感染治疗开始时间等治疗策略的影响。
Endocan是由肺内皮细胞在促炎症反应时分泌的一种蛋白多糖[31],可以抑制ALI时白细胞的渗出,从而发挥潜在的肺保护作用[32]。脓毒症患者血Endocan水平升高是其病情恶化的标志,也是ARDS的独立危险因素[23]。但Palud等[26]及Gaudet等[33]的研究表明,严重脓毒症及脓毒性休克患者入I CU 时低水平的E n d o c a n 也具有临床意义,血Endocan<2.54 ng/ml可以预测72 h时ARDS的发生。对于早期及病情较轻的脓毒症患者,Endocan水平持续升高常常提示ARDS的发展;而严重脓毒症及感染性休克患者若反常地表现为Endocan低水平,则可能对ARDS的发生有提示作用。Endocan对于ARDS的预测作用尚未完全明确,需要进一步深入研究。
1.2 肺部感染患者发生ARDS的危险因素 肺部感染者发生ARDS的危险较其他部位感染者更高[14],因此应更加重视肺部感染患者的病情进展。病原体类型对于ALI/ARDS的发展有一定影响。一项回顾性队列研究发现,细菌性肺炎患者ALI/ARDS的发病率低于真菌、病毒和混合感染患者[34];进一步对年龄、性别及特定病原体等变量进行控制后发现,肺炎患者ALI/ARDS的独立预测因子为基础疾病的严重程度、不适当的初始抗菌治疗以及输血[34]。
重症肺炎作为肺源性ARDS的主要诱因,常因其与ARDS具有相似的危险因素、临床表现、影像学表现[35],导致两者鉴别诊断十分困难[3]。因此,临床工作者很难在早期识别重症肺炎患者ARDS的发生发展。Luo等[36]对入ICU时诊断为严重肺炎的患者进行回顾性研究发现,与未发生ARDS的患者相比,发生ARDS的患者入院前病程较短,肺损伤评分(lung injury score,LIS)[37]、体温、纤维蛋白原(fibrinogen,Fib)和C反应蛋白水平、呼气末正压(positive end expiratory pressure,PEEP)、吸气相气道正压(expiratory airway pressure,EPAP)、有创和无创机械通气时的吸氧浓度、有创机械通气的比例以及镇静和肌松药物用量较高,Marshall评分和SOFA评分、氧饱和度、氧合指数、血尿素氮和肌红蛋白水平、合并心血管和胃肠道疾病的比例以及下肢水肿比例较低。其中,血清Fib和PEEP有助于早期识别ARDS,并且Fib>5.15 g/L、PEEP>6.5 cmH2O预测ALI/ARDS的敏感度和特异度较高。对ICU社区性获得性肺炎(community acquired pneumonia,CAP)且需要机械通气的患者,SOFA评分及入院前抗生素应用史是ARDS的独立危险因素,而吸入皮质类固醇治疗史是ARDS的保护因素[38]。
2 预测评分研究方法
2.1 LIPS评分 LIPS评分最初在2011年一项由Trillo-Alvarez等[39]发表的单中心观察研究中提出,以有ALI/ARDS危险因素(高危创伤、高危手术、脓毒症、休克、肺炎、误吸和胰腺炎)的成人患者为研究对象,报告了一个ALI/ARDS的预测模型,其中包括入ICU 6h内所获取的危险因素和风险调节因子(表1)。同年Gajic等[40]发表了一项大样本多中心观察研究,研究对象与Trillo-Alvarez等[39]的研究相似,以验证和完善LIPS评分为目的。经Gajic等[40]完善的LIPS评分(表2)可在疾病早期和入ICU前确定ALI/ARDS的高风险患者(LIPS评分≥4分),并得到了广泛的认可,但存在以下局限性:第一,LIPS评分是对于所有出现ALI/ARDS危险因素患者的预测评分,如前所述,脓毒症相关ARDS与其他原因所致ARDS的临床特点不同,预测标准可能会有差异,因此可能并不能完全适合脓毒症患者,需要更广泛的研究进一步验证;第二,LIPS评分主要收集早期急诊入院及术前患者的数据,评分项目未纳入初步的临床检验数据,而对于很多已经初步完善了实验室检查及疾病严重程度评估的ICU及住院患者,这些数据可能对提高预测的敏感度和准确性具有重要意义,因此需要对ICU等其他住院患者进行更深一步的研究;第三,有学者指出,LIPS评分≥4分的标准不适用于非急诊住院患者,可能出现敏感度(90.3%)较高但对ARDS的特异度(30.9%)和阳性预测值(17.3%)过低的情况[41],所以针对不同患者尤其是病情较重的患者,LIPS评分的最佳截断值仍需进一步研究[41-42]。
Levitt等[43]通过分析急性双肺阴影患者的数据,建立了由3个变量组成的早期急性肺损伤(early acute lung injury,EALI)评分,用于识别发生ARDS前需要正压通气的肺损伤患者(表3),若EALI评分≥2分,则考虑为可能进展至需要正压通气的ALI。与LIPS评分相比,EALI评分的阳性预测值及阴性预测值较高,但Levitt等[43]的研究为单中心研究,需要进行更严格的验证,其对于脓毒症患者呼吸支持的指导意义仍待进一步研究。
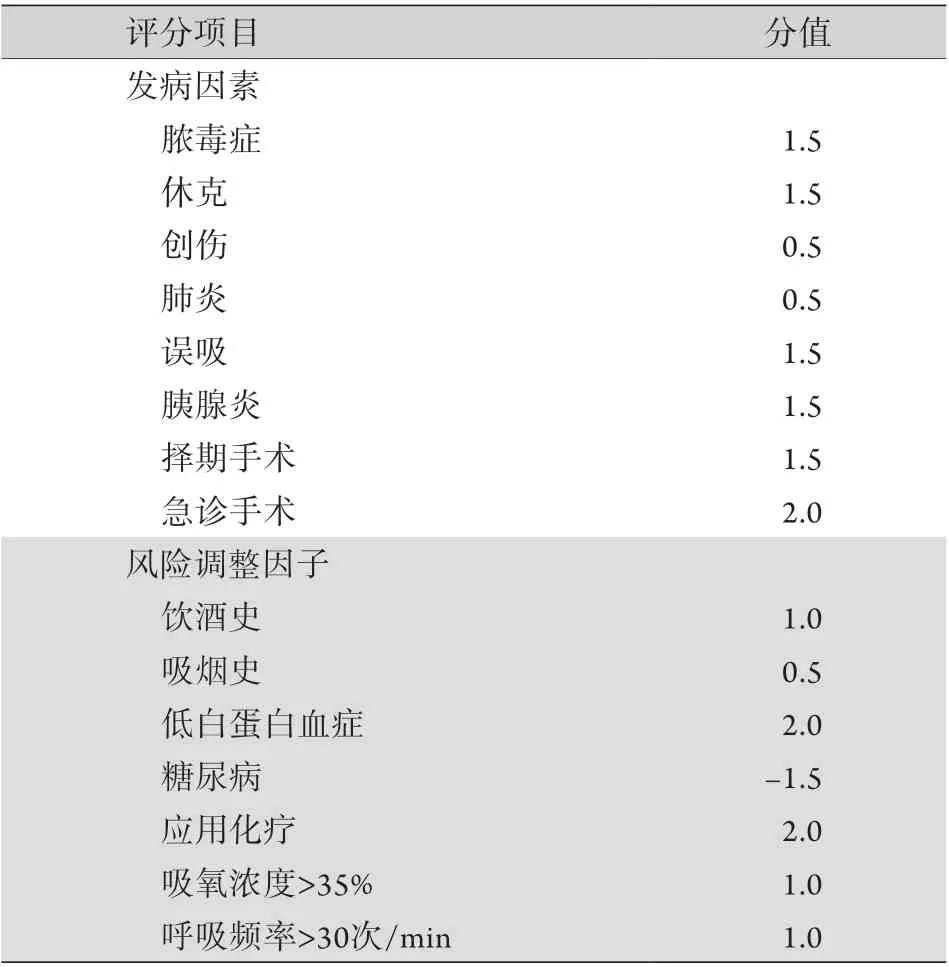
表1 LIPS评分*Tab.1 Lung injury prediction score*
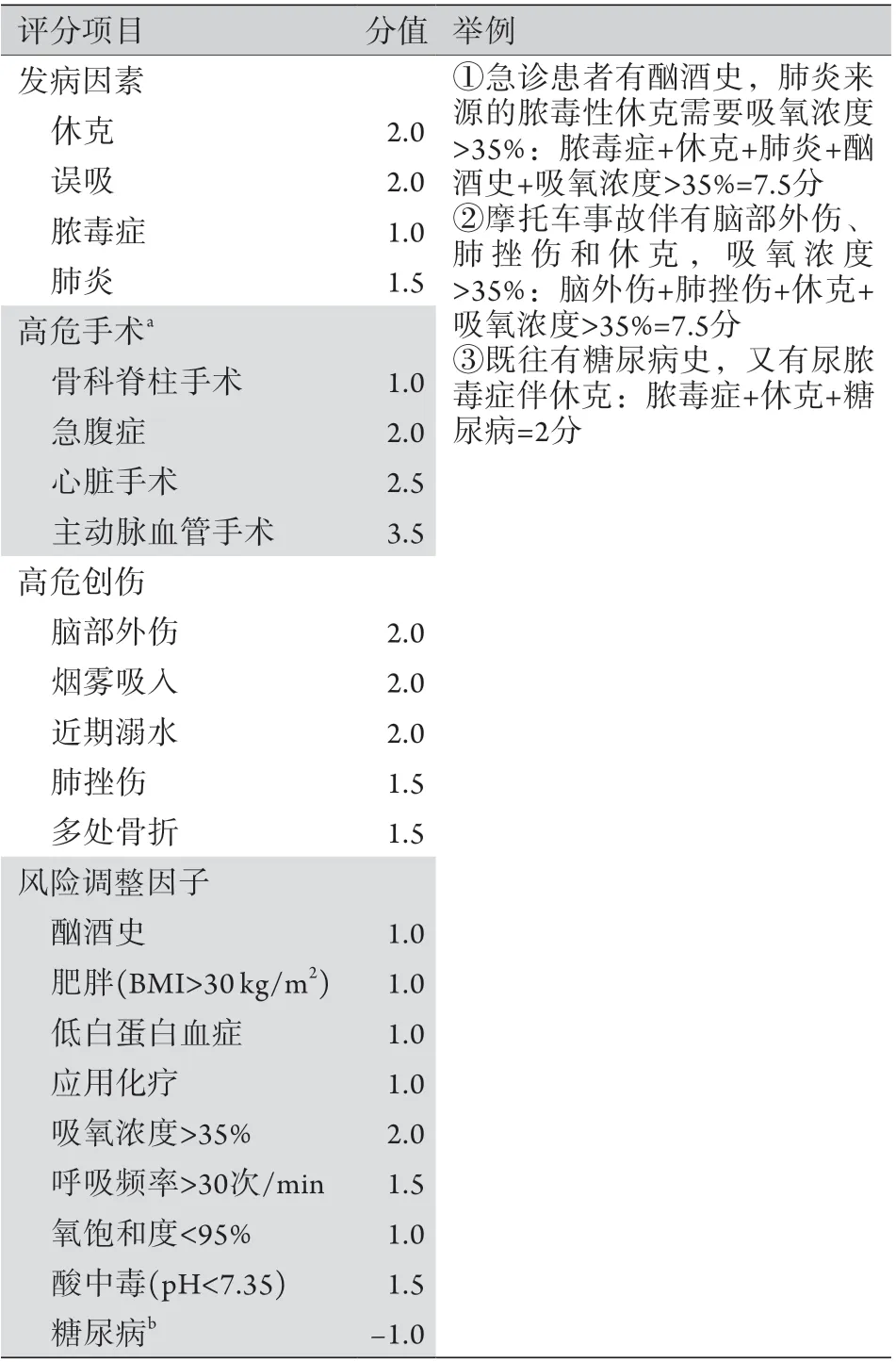
表2 LIPS完善评分*Tab.2 Consummate lung injury prediction score*
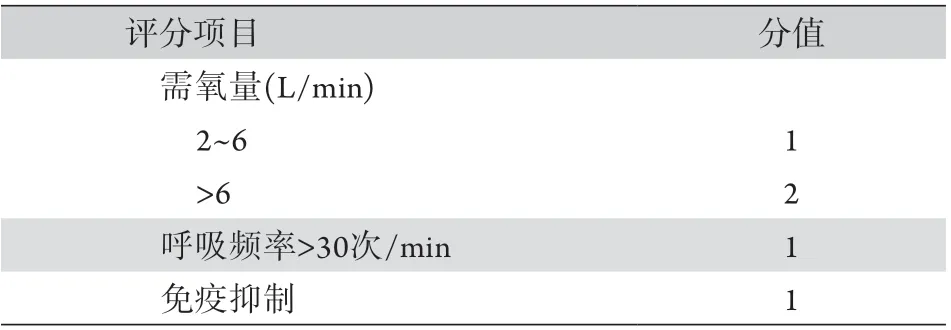
表3 EALI评分*Tab.3 Early acute lung injury score*
2.2 LIPS衍生评分 LIPS评分虽可在早期筛选有ARDS风险的患者,但准确性差,评分项目相对过多,且未纳入生物标志物。有研究以LIPS评分为基础,对其进行简化或与生物标志物相结合进行ARDS预测分析,均较LIPS评分本身更具优势[18-19]。
Xie等[44]进行了基于中国人群的观察性多中心队列研究,以入ICU时有ARDS危险因素的患者为研究对象,收集了入ICU前24 h及入ICU时的数据,建立了简化的ARDS预测评分系统(modified ARDS prediction score,MAPS;表4),并对MAPS评分和LIPS评分进行比较,发现前者能更好地预测ARDS的发展(MAPS评分>4分),具有更高的预测价值,且更适用于可能进入ICU的患者。但该研究样本量较少,时间跨度较短,可能不能完全适合其他患者。
ARDS作为不可控制的肺部炎症反应,特点为可引起中性粒细胞活化和血管内皮细胞损伤[7]。ARDS患者血清炎性因子如IL-6、IL-8[45]及ANG-2水平[46]显著增高,但并未发现可以很好地预测ARDS发生发展的单一生物标志物。Xu等[22]的研究将基于临床数据建立的LIPS评分及APACHE Ⅱ评分与上述生物标志物相结合,对ARDS的发生发展进行预测,发现LIPS评分+ANG-2组合模型对ARDS的预测能力最好;进一步比较入院前未进行医疗干预和入院前进行了医疗干预的两组患者,发现该组合模型仍表现出较好的预测能力,表明LIPS评分+ANG-2模型更适用于预测复杂临床情况下ARDS的发生和发展。

表4 MAPS评分*Tab.4 Modified ARDS prediction score*
3 总结与展望
综上所述,脓毒症患者发生ARDS的危险因素主要包括以下方面:①基础疾病,如糖尿病、免疫抑制状态、低白蛋白血症、饮酒史等;②疾病严重程度,如SOFA评分、APACHE Ⅱ评分、休克、需氧量等;③临床特点,如是否为肺源性感染、病原微生物种类、合并症类型等;④治疗的影响,如早期抗生素、糖皮质激素的使用,早期液体管理,呼吸支持方式等;⑤生物标志物,如血ANG-2、Endocan等的水平。关于ALI/ARDS的预测评分仍相对较少,且应用不广泛,LIPS评分需要进一步简化并纳入生物标志物以提高其灵敏度及特异度,目前尚无针对脓毒症患者ARDS的预测评分,未来需要结合脓毒症相关ARDS的特点进一步研究。

