早发性脊柱侧凸肺发育与相关机械力的刺激
罗兴鹏 王迎松 解京明 张颖 施志约 杨桂然
肺泡生长速度最快的时期是在 2 岁以前[1],2~4 岁时,肺泡细胞数量达到成年人水平 ( 3 亿~6 亿个 ),这之后肺泡的数量、大小和复杂程度可能还会继续缓慢增加,直至青春期甚至成年期[2-3]。越早发生在胸段的脊柱畸形,对胸廓的形态、活动度、容积影响就越大,同时产生的异常机械应力对肺细胞生长发育、组织分化的影响就越大。关于机械应力如何影响肺形态发生、功能和新陈代谢的机制,在细胞和分子水平上已取得了重大进展,例如,血流动力作用下内皮基因表达调控[4]、血管平滑肌[5]、骨和内皮细胞[6]中的机械转导、异常应力与机械通气肺损伤分子机制[7]等。
肺受到多种复杂的应力作用,包括呼吸、肺血流和表面张力。呼吸是肺的一个独特功能,早在妊娠 10 周时,B 超就可以观察到胎肺的“呼吸运动”。出生后,肺接受与整个体循环相同的血流量。这使得肺组织既承受气体、液体流动产生的剪切力,又承受气体膨胀、血流流动及呼吸运动产生的压力拉伸。这些机械应力作用于多种肺细胞,包括肺泡上皮细胞、成纤维细胞、气道上皮细胞、肺内皮细胞、平滑肌细胞以及间皮细胞。研究细胞如何感知机械应力刺激,细胞内和细胞间信号传递,以及在转录和转录后水平上的基因表达调控,可增加对机械应力与肺细胞相互之间关系的理解,有助于在细胞和分子水平上理解肺生理学和病理生理学,以及异常机械应力导致的多种肺疾病的病理生理情况。从而有助于设计预防和治疗异常机械应力相关疾病的策略,如肺发育不良、脊柱畸形相关的肺生长受限、机械通气创伤等。
一、体外模拟对肺细胞施加的各种应力及模型
除了机械拉伸,大量的空气和血液流动还会产生流经气道和血管壁的剪切应力。目前已有几种装置来模拟对肺细胞的这几种类型的机械应力刺激。根据它们的主要物理特征可分为:静态拉伸、循环拉伸、二维拉伸与三维拉伸、剪切应力作用、触碰、扭曲等。
1. 静态拉伸:在呼吸运动中肺受到气流和血流的周期性拉伸,常用的静态拉伸实验装置原理为通过工具垂直单向正压推动,将培养在弹性膜上的细胞施加垂直双向应力[8]( 图 1a ),或者水平推动培养在弹性膜上的细胞[9]。单一的静态拉伸装置可以比较直观地在显微镜下观察及检测细胞形态、细胞内 Ca2+和其它信号的变化。
2. 循环拉伸:常见的为 Flexercell 应变单元,用于在细胞上施加循环拉伸应力。该设备使用真空泵将覆盖有细胞的弹性膜循环向下拖动 ( 图 1b )。通过该装置可以预测弹性膜内的任何位置的细胞应变分布[10]。
3. 三维培养基中拉伸细胞:在体外维持肺泡上皮细胞的表型是非常困难的,因为在一般的培养基中,肺细胞是分散培养的,当基质密度低时,Ⅱ 型细胞迅速变扁,失去产生表面活性物质的能力。但是用胶原蛋白海绵在三维环境中培养胎肺细胞却可以维持肺泡细胞形态和表型[11]。这是因为胶原蛋白海绵被用作细胞黏附的底物时,分散的胎肺细胞聚集在海绵中,海绵周围被间充质细胞包围[12],创造了一个高度组织化的“肺泡样结构”( 图 1c )。
4. 剪切应力:在流固界面上施加在流动方向上的单位表面积的摩擦力称为剪切应力。具有代表性的模型为:Aparallel-plate 流动通道,它通过流体对单层培养的细胞施加剪切应力[13]( 图 1d )。为了模拟微循环中的剪切应力,有学者还设计了玻璃微吸管灌注系统,在 20~50 µm的分支管中培养兔肺微血管内皮细胞,通过灌流施加剪切应力[14]。
5. 剪切应力和机械拉伸:气道、肺血管和胸膜间隙不仅受剪切应力的影响,还受机械拉伸的影响。出生后的肺在呼吸运动膨胀收缩的同时还接受相当于整个体循环的血流量,且血管阻力较低。因此,流体剪切应力和机械拉伸对肺动脉内皮细胞的影响都是举足轻重的。为了确定这两个分量的相对贡献,有学者开发了可以选择性地控制剪切应力和机械拉伸的装置[15],以及跨毛细血管灌流培养系统[16]。
6. “触碰”和“扭曲”设备:该设备通过选择性地向单个细胞施压,来模拟研究肺气道上皮细胞所受的应力作用[16]。通过计算机显微操作将尖端直径为 1 µm 的玻璃移液管放置在单个细胞的顶膜附近。移液管由计算机控制向下接触细胞,使细胞膜瞬间受到触碰变形 ( 图 1e )。另一种装置让细胞结合涂有特定受体配体的球形磁微珠。通过在一个方向上磁化这些珠子,然后施加第二个方向为 90°的较弱磁场,通过旋转磁珠,从而在细胞表面上施加可控的剪切应力[17]( 图 1f )。
二、不同的肺细胞在应力刺激下的反应
机械应力对肺不同细胞的增殖和分化有不同的影响,循环拉伸应力可刺激胎儿肺细胞增殖;在体外受循环拉伸机械应力作用下培养气道平滑肌细胞可观察到细胞数量和DNA 合成均有增加;循环拉伸应力还可下调前列腺素的生成,但是剪切应力作用却相反。机械应力作用下细胞外基质的成分也会改变;剪切应力还能改变细胞的通透性。但是异常机械应力作用下则会引起促炎细胞因子和趋化因子的表达增加。
1. 胎儿肺细胞:胎儿呼吸运动所产生的循环拉伸是胎儿肺生长的重要刺激因素,模拟体外培养大鼠胚胎肺细胞并施加间歇性机械拉伸应力 ( 海绵伸长 5%,60 个周期 / min,15 min / h ) 该方案与报道的正常人类胎儿呼吸运动的频率、幅度和周期性相似[18],结果发现,妊娠第 19 天( 对应人肺发育的小管期 ) 胎儿大鼠肺细胞的 DNA 合成和细胞分裂增加[19]。这说明环拉伸应力刺激胎肺细胞的生长。
2. 气道平滑肌细胞:气道平滑肌细胞增生和肥大是哮喘、慢性阻塞性肺疾病和其它气道阻力增高的慢性疾病的常见表现。犬气道平滑肌细胞,用 Flexercell 应变单位进行循环应力拉伸体外培养,在培养后 5 天或 14 天,细胞数量和 DNA 合成均有增加。细胞总蛋白含量,特别是肌球蛋白、肌球蛋白轻链激酶和结蛋白等收缩蛋白的含量比静态培养细胞明显增加[20]。这些结果表明过多的机械应力刺激会导致气道平滑肌向病态方向发展。
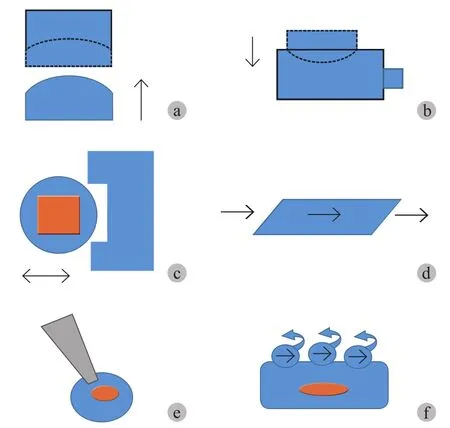
图 1 体外模拟对肺细胞施加的各种应力模型 a:细胞培养在弹性膜上,弹性膜由物体向上推动 ( 箭头 ),产生拉伸应力;b:培养在弹性膜上的细胞被循环负压向下拉 ( 向下箭头 ) 产生循环拉伸应力;c:细胞培养在明胶海绵上,海绵的一端粘在培养皿的底部,另一端粘在金属棒上,通过计算机控制的螺线管 ( 箭头 )产生的磁力作用在金属棒上,对海绵上的细胞施加应变;d:平行板流道对单层培养的细胞施加流体剪切应力;e:微吸管触碰单个细胞的顶膜,使细胞膜变形;f:细胞表面受体链接磁珠上的配体,磁珠一个方向上磁化后,第二个较弱的磁场方向为90°“扭曲”,使珠子的剪切应力可控Fig.1 Simulations of various stress models applied to lung cells in vitro a: The cells were cultured on an elastic membrane, which was pushed upward by the object ( arrow ) to produce tensile stress; b: The cells cultured on the elastic membrane were pulled down by cyclic negative pressure ( downward arrow ) to produce cyclic tensile stress;c: The cells were cultured on a gelatin sponge; one end of the sponge was attached to the bottom of the culture dish, and the other end was attached to a metal bar; the magnetic force generated by a computercontrolled solenoid ( arrow ) acted on the metal bar and exerted strain on the cells on the sponge; d: Parallel plate exerted fluid shear stress on monolayer cultured cells; e: The micropipette touched the top membrane of a single cell, deforming the cell membrane; f: Receptors on the cell surface were connected to ligands on magnetic beads;After magnetization in one direction, the second weak magnetic field direction was “twisted” at 90°, so that the shear stress of the beads could be controlled
3. 细胞外基质:间歇拉伸诱导 Ⅳ 型胶原和肌原蛋白稳态 mRNA 水平升高。机械拉伸应力还通过上调纤维连接蛋白的合成和分泌来增加纤维连接蛋白的产生[21],使得细胞之间紧密连接更稳固。循环拉伸应力最初导致牛肺动脉内皮细胞减少纤维连接蛋白的释放,但是随着拉伸时间的延长,培养基中的纤连蛋白开始接近非应力对照组,而细胞层相关纤连蛋白也显著增加[22],这些结果表明,肺动脉内皮细胞通过增强与细胞黏附相关的分子成分来响应循环拉伸应力。
4. 炎症介质产生和细胞损伤:机械通气是治疗呼吸衰竭不可缺少的治疗方式,但同时也会诱导或加重潜在的肺损伤。模拟机械通气离体大鼠肺模型中收集的灌洗液中:包括巨噬细胞炎症蛋白-2、干扰素-γ、细胞因子[ 肿瘤坏死因子 ( tumor necrosis factor,TNF )-α、白介素( interleukin,IL ) 如 IL-1、IL-6、IL-10 ]增加[23]。肺机械通气过程中产生的炎症细胞因子可能导致急性肺损伤和多器官功能障碍综合征的发展。机械拉伸应力,可增加人肺泡上皮细胞分泌 IL-8,但是过多增加拉伸程度 ( 10% 伸长率 ) 或连续拉伸应力,则可诱导胚胎肺细胞的损伤,这与促炎细胞因子和趋化因子的表达增加有关[24]。
5. 前列腺素的合成:由气道上皮细胞合成的具有生物活性的二十烷类物质有助于调节气道平滑肌张力和炎症反应。在机械通气中,气道进行循环伸展,循环拉伸应力可下调人气道上皮细胞中前列腺素 ( prostaglandin,PGs ) 的合成,包括 PGE2、PGI2 和血栓素 A2[25],相反,剪切应力可增加肺内皮细胞释放前列腺素。
6. 通透性:当牛肺泡表面细胞培养基流速增加即产生剪切应力增加时,细胞的通透性也增加[26],肺胸膜表面的间皮细胞是肺表面和胸膜间隙之间的界面,在肺和周围液体和组织之间提供屏障。由于肺的呼吸运动,这些细胞暴露在高水平的机械刺激下。当肺扩张和收缩时,间皮细胞被周期性地拉伸、收缩。在肺扩张时,肺胸膜的一些区域相对于胸壁胸膜滑动,因此受到流体剪切应力。在细胞流体剪切力研究模型中,这些细胞的通透性可被流体剪切应力可逆地改变,这表明间皮细胞的屏障功能随着流体剪切力的变化而变化。
三、展望
早发性脊柱侧凸 ( early onset scoliosis,EOS ) 会影响胸廓及心肺的发育,主要表现在对肺形态结构和功能的影响。侧凸累及的椎体、肋骨越多,胸段、胸腰段侧凸Cobb’s 角越大,患者的肺功能越差。当胸廓畸形复杂程度超过了呼吸肌的代偿,可出现限制性通气功能障碍为主的肺功能损伤,表现为以肺活量 ( vital capacity,VC )、用力肺活量 ( forced vital capacity,FVC )、最大自主通气量( maximal voluntary ventilation,MVV ) 的显著降低和 1 秒量( forced expiratory volume in one second,FEV1 ) 的增加或正常为特征,也可出现阻塞性通气功能障碍以及混合型通气功能障碍。颈胸弯、胸弯角度过大时可出现支气管走形迂曲移位,血管弯曲,肋间隙变窄,压缩侧肺不张,膨胀侧肺气肿,V / Q 异常,肺内气体交换面积减少,弥散功能下降,长期低氧血症,肺血管收缩,此时肺动脉高压有可能进展为肺心病,加之支气管的迂曲移位狭窄,排痰困难,肺反复感染,进一步造成缺氧及二氧化碳潴留的恶性循环。
许多研究集中在机械应力对肺细胞生理功能的影响上。关于机械应力因素在 EOS 导致的胸廓、肺生长受限、肺细胞结构及功能受损等机制的报道较少。有几种策略可用于研究物理因素在 EOS 中的作用:可以从动物模型或患者身上收集细胞,然后在体外研究它们对机械应力刺激的反应。另外,如果异常物理影响因素的性质被很好模拟的话,可以用各种设备来模拟这些条件。例如,可以模拟 EOS 的胸廓条件比较拉伸受限、正常拉伸和过度拉伸对细胞的影响;可用不同振幅、频率和拉伸 - 松弛比干预细胞;在存在其它有害物理因素时,如高氧、缺氧和缺血再灌注时,应用机械应力刺激;或存在其它治疗条件时,如由拉伸受限变为正常拉伸 ( 模拟胸廓成形后的肺组织空间改善 );在胸廓成形后对原生长受限的肺组织实施间充质干细胞的干预、生长因子的干预、激素的干预等;从而探索因脊柱侧凸造成的肺功能受损患者的治疗方法。还可以通过多种组合干预措施研究机械应力刺激与其它混杂因素之间的相互作用。例如,胎儿肺的成熟受机械应力因素和激素因素的控制。在良好的培养条件下,在限制的条件下,这些因素的作用和相互作用的研究。同样,EOS应力失调与细菌产物、细胞因子、趋化因子和其它有害因子的相互作用可以同时在培养细胞上检测。
机械力如何被细胞感知并转化为细胞内信号转导的生化信号以及各信号通路在基因转录、翻译、表达调控中发挥的作用尚不清楚。由于器官结构的复杂性、细胞类型的多样性以及细胞在体内所受应力的多样性,不同细胞感知机械刺激的机制可能会有所不同。主要的应力相关信号转导机制有,牵张 - 活化离子通道、细胞外基质 - 整合素 - 细胞骨架途径 ( ECM-integrin-cell keleton pathway )、细胞 - 细胞黏附体连接和缝隙连接途径[27]。在模拟 EOS 异常机械应力刺激引起的信号转导通路是否有不同的表现形式,在有其它刺激 ( 治疗或有害 ) 的情况下会发生怎样的信号转导改变,仍需进一步研究。一个特定基因的表达通常由其启动子和增强子中的几个转录因子控制。应力和其它因素可能会选择性地影响其活动。此外,从基因转录和翻译到翻译后修饰的多个步骤也可能受到异常应力和其它信号的不同调控。

