绵羊FHL2蛋白原核表达、蛋白纯化及多克隆抗体的制备
聂晓宁,李闰婷,陈龙欣,李玉华,聂文营,张丽萌,王林青
(郑州师范学院分子生物学实验室,河南 郑州 450044)
0 引言
卵巢是雌性动物体内最重要的生殖器官,可产生卵母细胞和分泌生殖激素,直接影响动物的产羔性能[1]。目前的研究结果显示,在绵羊繁殖调控机制研究中有众多的因子和蛋白在发挥调控作用,但大多数并没有深入研究。前期研究结果分析FHL2蛋白在调控绵羊繁殖性能方面有可能发挥着重要的作用,深入研究其生物学功能及作用机制也至关重要。
FHL2属于含有4个半LIM结构域的蛋白家族重要成员之一[2],由279个氨基酸残基组成,有7个外显子和6个内含子,仅有4个外显子编码FHL2蛋白,可以与不同的结构蛋白、转录调控因子等相互作用发挥功能[3]。有研究显示,FHL2能够与多种蛋白(FOXO1、β-catenin)等互作,直接或间接地调控细胞增殖、凋亡和周期的相关蛋白因子等的表达水平,从而影响细胞的凋亡、周期。因此,深入研究FHL2蛋白在绵羊卵巢中的生物学功能尤为重要。本研究对绵羊FHL2基因序列进行克隆并表达,制备重组FHL2蛋白,通过免疫BALB/c小鼠,制备抗FHL2基因的多克隆抗体,以期为研究FHL2蛋白的生物学功能及在繁殖调控中的作用机制提供良好的基础材料。
1 材料与方法
1.1 材料和菌株
pET28a-sumo载体和pEGFP-C1-FHL2质粒均郑州师范学院分子生物学实验室保存;4~6周龄雌性BALB/c小鼠由河南省实验动物中心所提供。
1.2 主要试剂
Pfu酶、质粒小提试剂盒,均购自全式金生物技术有限公司;限制性内切酶BamHⅠ和XhoⅠ,购自NEB公司; HRP标记的His单克隆抗体,HRP标记的羊抗鼠IgG,购自武汉三鹰; IPTG、咪唑,购自生工生物工程股份有限公司;弗氏完全佐剂和弗氏不完全佐剂购自Sigma公司。
1.3 引物设计和合成

1.4 绵羊FHL2基因的克隆
利用TRIzol法提取绵羊卵巢组织的RNA,用Pfu酶进行PCR扩增FHL2基因,克隆至pMD18-T载体,转化至DH5α感受态细胞并送测序。
1.5 重组载体pET28a-sumo-FHL2的构建及表达
将双酶切后的产物连接至pET28a- sumo线性化载体,37℃ 连接30 min,转化至DH5α感受态细胞。挑取单菌落用T7-PF /T7-Term进行PCR菌落鉴定并测序。挑取E.coliBL21(DE3)/pET28a-sumo-FHL2单个菌落接种至LB液体培养基中,37℃ 260 r/min振荡培养过夜,加入0.5 M IPTG,30℃继续培养5 h诱导表达蛋白;10 000 r/min离心收集诱导表达后的细菌沉淀,分别收集上清液和沉淀进行SDS-PAGE电泳检测。
1.6 FHL2目的蛋白的纯化
将种子液按照1:100的比例接种于LB液体培养基中,37℃、260 r/min培养至OD600=0.5时,加入0.5 M IPTG,30℃继续培养5 h诱导表达蛋白;10 000 r/min离心收集诱导表达后的细菌沉淀,用20 mL PBS 重新悬浮细菌沉淀,充分重悬;-80℃反复冻融3次后,超声破碎,4℃,12 000 r/min 离心20 min。将离心后的上清液进行Ni-NTA亲和层析纯化,收集洗脱产物浓缩后测定浓度。取5μg 纯化的蛋白进行SDS-PAGE和Western-blot鉴定结果。
1.7 动物免疫和多克隆抗体的制备
取4~6周龄雌性BALB/c小鼠3只,将纯化的FHL2重组蛋白按100 μg/次的量免疫小鼠。首次免疫,将弗氏完全佐剂与FHL2蛋白等体积混匀后多点皮下注射小鼠背部。二免和三免用FHL2重组蛋白和弗氏不完全佐剂混匀乳化,每次间隔2周进行,三免后10 d尾部采血测定抗体效价。
1.8 多克隆抗体的Western blot分析及效价检测
转染pEGFP-C1-FHL2质粒至HEK 293F细胞,24 h收集细胞后提取蛋白,100℃煮样10 min进行 SDS-PAGE,转至NC膜上,以多克隆抗体(1:2 000)和HRP 标记的山羊抗鼠IgG分别为一抗和二抗进行Western-blot检测。将纯化的FHL2蛋白包被96孔板,包被封闭后加入不同浓度的FHL2多克隆抗体,二抗为HRP标记的羊抗鼠IgG,显色后ELISA分析结果。
2 结果与分析
2.1 FHL2基因的克隆
以提取的绵羊卵巢组织反转录产物cDNA为模板,通过RT-PCR成功扩增获得绵羊FHL2基因,大小约864 bp(见图1),与预期结果大小一致。
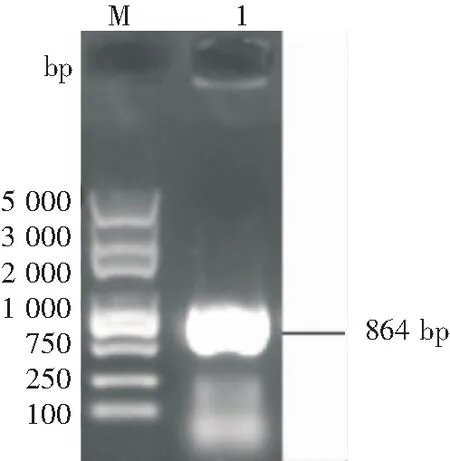
M-Trans2K®Plus DNA Marker;1-FHL2基因扩增产物
2.2 重组表达质粒的构建
挑取4个单菌落进行PCR菌落鉴定并送测序,测序结果经MegAlign软件比对分析,序列正确未发生碱基突变,氨基酸同源性100%。表明成功构建重组表达质粒pET28a-sumo-FHL2。
2.3 FHL2蛋白的表达鉴定
SDS-PAGE结果表明,重组蛋白FHL2大小约48 ku(见图2A)。通过Ni-NTA蛋白纯化系统纯化蛋白,将FHL2蛋白转至NC膜后,结果显示在48 ku处出现明显蛋白条带(见图2B)。
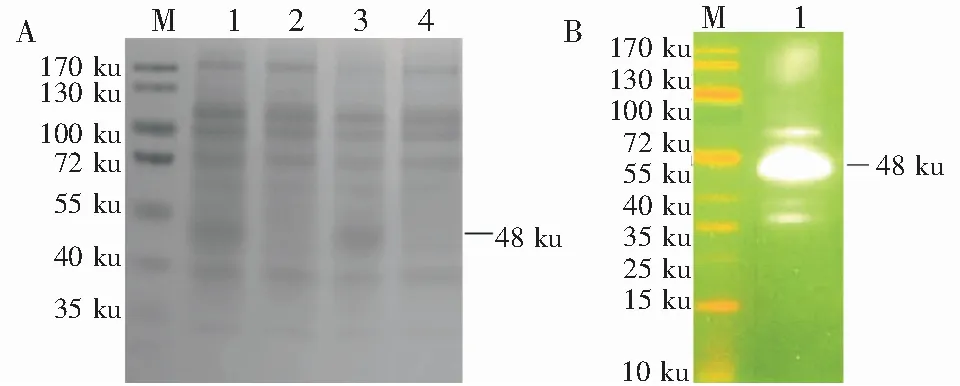
A:M-PageRuler Prestained Protein Ladder;1-诱导后pET28a-sumo-FHL2超声破碎上清(+DTT);2-未诱导pET28a-sumo-FHL2表达的全菌体蛋白(+DTT);3-诱导后pET28a-sumo-FHL2超声破碎上清(-DTT);4-未诱导pET28a-sumo-FHL2表达的全菌体蛋白(-DTT);B:M-PageRuler Prestained Protein Ladder;1-重组蛋白FHL2
2.4 多克隆抗体免疫原性和抗体效价检测
转染重组质粒pEGFP-C1-FHL2,24 h后收取细胞裂解液进行Western-blot。结果显示可检测到大小约48 ku的特异性目的条带,表明制备的抗体可与FHL2蛋白反应,具有良好的特异性。将血清抗体进行梯度抗体稀释,检测结果表明血清抗体进行1:6 400倍稀释后仍可与FHL2蛋白进行特异性结合。
3 讨论
FHL2是FHL家族蛋白中研究最多的,因所具有的特殊结构和特性,通过与转录调控因子等相互作用发挥多种生物学功能。Zhang等在绵羊卵巢颗粒细胞中利用siRNA抑制FHL2的表达,结果显示能够抑制细胞凋亡,促进细胞生长。在小鼠卵泡颗粒细胞中,FHL2通过结合不同转录因子,直接调控INHA 和P450scc的表达。因此,推测FHL2在哺乳动物的卵泡发育过程中起着至关重要的作用,且目前无专门特异性针对绵羊的FHL2抗体。因此,需要通过人工制备FHL2多克隆抗体来解决这一问题。
本研究选择pET系列载体主要优点包括以下几个:具有构建效率高、蛋白表达量高、仅有6个His组氨酸,标签小、易于分离纯化等诸多优势。在本试验中所选择的pET28a载体上带有sumo序列,它可促进易形成包涵体蛋白的可溶性表达[4]。试验中选择E.coilBL21(DE3)表达系统,该菌株敲除了蛋白酶,并溶源了噬菌体DE3,具备遗传背景清晰、目的基因表达水平高等特点,也因此成为重组蛋白克隆表达的首选表达系统。本试验以绵羊卵巢组织为材料,通过PCR扩增、酶切PCR产物及载体等方法,成功构建出pET28a-sumo-FHL2重组原核表达载体,加入0.5M IPTG诱导剂诱导后SDS-PAGE检测显示重组FHL2蛋白能够可溶性表达。以重组蛋白FHL2免疫BALB/c小鼠,制备抗FHL2多克隆抗体。试验中又通过转染pEGFP-C1-FHL2质粒,采用Western-blot方法对FHL2特异性进行鉴定,证明制备的多抗血清与重组蛋白FHL2有特异性反应。因此,本研究成功构建重组蛋白pET28a-sumo-FHL2并制备了具有良好特异性的FHL2多克隆抗体,为后续用于研究FHL2蛋白生物学功能和绵羊繁殖调控机制提供了良好的检测材料。

