内消软脉汤对ApoE-/-小鼠解耦联蛋白1依赖性脂解通路、血脂及高敏C反应蛋白的影响
王可彬 李贺 吴圣贤
心脑血管疾病是威胁人类生命健康的重要原因[1-2],高脂血症及代谢性炎症在许多心脑血管病发生及发展的过程中起到重要作用。目前现代医学针对高脂血症的主要治疗措施是强化降脂治疗,如长期服用他汀类药物,但其具有一定的肝毒性及肾毒性[3],且没有针对性降低血管内代谢性炎症的药物,而中医药治疗高脂血症及代谢性炎症具有显著的疗效并且副作用较小。本课题组结合多年临床经验,提出了“脉生痰核”的理论[4-5],创立了“内消软脉汤”用于治疗颈动脉粥样硬化,已取得显著临床疗效,通过观察临床患者的治疗效果以及进一步的探究,发现“内消软脉汤”可以降低患者的血脂及炎症水平。因“内消软脉汤”属于“化痰散结”类方剂,源于中医外科治疗“颈生痰核、臂生痰核”的方药,故认为其作用部位在皮下。而大量研究表明,皮下脂肪的活化可显著遏制动脉粥样硬化发展并且稳定易损斑块[6],究其作用机制主要也是抑制代谢性炎症[7]以及降低甘油三酯和胆固醇水平[6-8],因此推测,“内消软脉汤”可以抑制代谢性炎症、降低甘油三酯和胆固醇水平,且这些功效是通过激活皮下脂肪活化来实现的,而皮下脂肪的激活严格依赖解耦联蛋白1(uncoupling protein 1,UCP1)[9-10],为验证“内消软脉汤”是否抑制代谢性炎症及降低血脂水平,并探究此作用的实现是否与激活UCP1依赖性脂解有关,进行了以下实验。
1 材料与方法
1.1 实验动物
选用7周龄雄性ApoE-/-小鼠48只,购自北京维通利华实验动物技术有限公司,合格证号:SCXK:(京)016-0006。适应性饲养1周,饲养于北京中医药大学东直门医院教育部重点学科实验室动物实验中心,室温22℃,湿度45~55%,12 h/12 h:光照/黑夜循环,自由进食水。
1.2 实验药物与试剂
“内消软脉汤”由陈皮9 g、茯苓9 g、姜半夏9 g、白僵蚕9 g、玄参9 g、生牡蛎9 g、海藻9 g、昆布9 g、炮山甲3 g、皂刺3 g、浙贝母9 g、天花粉9 g、夏枯草9 g、橘核9 g、醋鳖甲9 g、姜黄9 g、丹参9 g、当归6 g、制乳香3 g、制没药3 g、炒白芥子6 g、白芷6 g、薄荷6 g、香附6 g、生黄芪9 g、灵芝9 g、金银花9 g、黄连9 g组成,所有药材购自北京康仁堂公司。4%多聚甲醛溶液(4%,PFA),货号:SS0312;中性快干胶,购自中杉金桥公司,货号:ZLI-9516;兔抗GADPH抗体,购自PTG公司;山羊抗兔二抗试剂,购自北京普利莱公司,货号:P1003;兔抗UCP1抗体,购自abcam公司,货号:ab10983;5×蛋白上样缓冲液,购自普利莱公司,货号:B1012;BCA蛋白定量试剂盒BCA Reagent,购自普利莱公司,货号:P1511;RIPA裂解液,货号:C1053,购自普利莱公司;蛋白酶抑制,购自普利莱公司;SDS,购自普利莱公司;吐温-20,购自普利莱公司,货号:A1007;封闭专用脱脂奶粉,购自普利莱公司,货号:P1622;预染色蛋白Maker,购自普利莱公司,货号P1103;发光液,购自碧云天公司。
1.3 动物分组与造模[11]
48只ApoE-/-小鼠采用随机数表法分为空白组、模型组、“内消软脉汤”低剂量组、“内消软脉汤”高剂量组,每组12只。各组小鼠适应性饲养1周后,除空白组给予正常饮食外,其余三组给予高脂饮食(21%脂肪+0.15%胆固醇),持续60日,造模过程中无小鼠死亡。鉴于环境温度对脂解作用有明显影响,本研究采用环境动物饲养箱,全程控制并恒定饲养温度为22°C。鉴于脂解过程中消耗热量,会明显增加小鼠食量,本研究将各组动物匹配饲养。
1.4 给药
造模结束后第2天开始灌胃给药,每天一次,连续60天。空白组和模型组予0.9%生理盐水0.3 mL灌胃;“内消软脉汤”低剂量组予“内消软脉汤”混悬液68 mg/kg/d灌胃;“内消软脉汤”高剂量组予“内消软脉汤”混悬液102 mg/kg/d灌胃,每只小鼠的给药体积为0.3 mL/d,其中低剂量组为临床等效剂量,连续给药56天,“内消软脉汤”高剂量组小鼠在药物干预过程中死亡1只。
1.5 标本采集处理过程
在给药60天后对各组小鼠(除“内消软脉汤”高剂量组11只外,其余组12只)进行取材,需要采集的样本有:血清,肩胛区棕色脂肪组织、腹股沟皮下白色脂肪组织、附睾内脏白色脂肪组织。处死小鼠前禁食水8小时。使用眼球取血法采血,剪去小鼠嘴边须毛,左手捏住颈后肌肉,保持头低脚高位,固定小鼠头部,右手持弯镊快速夹除一侧眼球,采血于1.5 mL离心管内,每只小鼠采血(200~300)μL血液,取血结束后,静置,血样待出现分层后,以3000 rpm×15 min的参数进行离心,取上层血清,冻存于-80℃冰箱,于协和医院检验科以生化法检测血脂和高敏C反应蛋白(high-sensitive C-reactive protein,HS-CRP)。采血完毕后,把小鼠浸泡于75%酒精中充分消毒并固定于自制小鼠手术台,后采集小鼠肩胛两侧棕色脂肪组织、腹股沟皮下白色脂肪组织、附睾内脏白色脂肪组织。分别将一侧脂肪组织放入冻存管内并立即放置于液氮中保存以备Western blot法检测;另一侧脂肪组织保存于4%多聚甲醛中以备HE染色。
1.6 指标检测
1.6.1 生化法检测各组小鼠血清TG、LDL、HS-CRP 以上指标均由北京协和医院检验科检测。
1.6.2 HE染色观察脂肪细胞形态及大小 对各组小鼠的肩胛、腹股沟和附睾区脂肪组织(n=3)的石蜡切片进行HE染色,使用高倍显微镜拍摄几个连续的切片照片,观察脂肪细胞形态及大小来验证脂肪组织的褐变情况。
1.6.3 Western blot法检测UCP1在肩胛区、腹股沟处、附睾区的蛋白表达量 将组织用RIPA裂解缓冲液和蛋白酶抑制剂(50∶1)充分消化,制成乳糜颗粒,然后在4℃冷冻离心机(Eppendorf 5424/5424R)中于12000 G离心10分钟。用SDS-PAGE上样缓冲液(1∶5,APPLYGEN)稀释液体上清液中的蛋白质,并转移至沸水中,然后-20℃保存。通过依次用6%+10%SDS-PAGE在60V下离心30分钟分离加工的蛋白质,然后在100 V上调电压下离心1小时,然后在300 mA的硝酸纤维素膜(APPLYGEN)上转移1.5小时。转移后,将膜在3%~5%的脱脂干奶中于常温下封闭1小时。将膜与针对UCP1的一抗(1∶1000,abcam)在4℃孵育过夜,并用TBST洗涤,然后在室温下与适当的二抗(ZSGB-BIO)孵育1小时。最终,使用轻质液体(BeyoECL星,BEYOTIME)通过化学发光检测目标蛋白,并通过内部参照GADPH(1∶5000,abcam)将其标准化。
1.7 统计学处理

2 结果
2.1 “内消软脉汤”对小鼠血脂水平及炎性因子的影响
与空白组比较,模型组的HS-CRP、TG、LDL水平未见明显差异。与模型组比较,“内消软脉汤”低剂量组、“内消软脉汤”高剂量组的HS-CRP、TG水平均下降,具有统计学意义(P<0.05),且HS-CRP在“内消软脉汤”低剂量组下降程度更明显。同时,与模型组比较,“内消软脉汤”低剂量组的LDL也呈降低趋势,但无统计学意义(P>0.05)。结果见表1。

表1 各组ApoE-/-小鼠血清中HS-CRP、TG、LDL水平的比较
2.2 “内消软脉汤”对小鼠脂肪细胞棕色化的影响
2.2.1 ApoE-/-小鼠肩胛区脂肪细胞HE染色 “内消软脉汤”低剂量组、“内消软脉汤”高剂量组小鼠的肩胛脂肪具有细胞体积缩小、细胞数目增多、细胞HE染色较深等棕色脂肪细胞的表现,且这种表现随着“内消软脉汤”剂量增加而更加明显。结果如图1所示。
2.2.2 ApoE-/-小鼠腹股沟处脂肪细胞组织HE染色 空白组、模型组、“内消软脉汤”低剂量组、“内消软脉汤”低剂量组高剂量组的脂肪细胞体积逐渐变小、表现为分隔增多的多房室结构脂泡、HE染色逐渐变深、细胞核着色逐渐增多,高倍显微镜下单位视野见脂肪细胞数目逐渐增多。结果如图2所示。
2.2.3 ApoE-/-小鼠附睾区HE染色 空白组、模型组、“内消软脉汤”低剂量组、“内消软脉汤”低剂量组小鼠的附睾区脂肪的细胞体积、细胞数目未见显著差异。结果如图3所示。
2.3 “内消软脉汤”对ApoE-/-小鼠肩胛区、腹股沟区及附睾区UCP1蛋白表达的影响
用Western blot法对ApoE-/-小鼠肩胛区、腹股沟区及附睾区的UCP1蛋白表达量进行检测。模型组、“内消软脉汤”低剂量组、“内消软脉汤”高剂量组的肩胛区、腹股沟区的UCP1蛋白表达量依次增加。ApoE-/-小鼠肩胛区、腹股沟区及附睾区UCP1蛋白在模型组的表达量与空白组比较,差异均具有统计学意义(P<0.05)。ApoE-/-小鼠肩胛区、腹股沟区及附睾区UCP1蛋白的表达量与模型组比较,差异具有统计学意义(P<0.05)。结果见表2,图4、图5、图6。

表2 各组ApoE-/-小鼠肩胛区、腹股沟区及附睾区UCP1蛋白表达的比较

注:A.空白组;B.模型组;C.内消软脉汤低剂量组;D.内消软脉汤高剂量组。
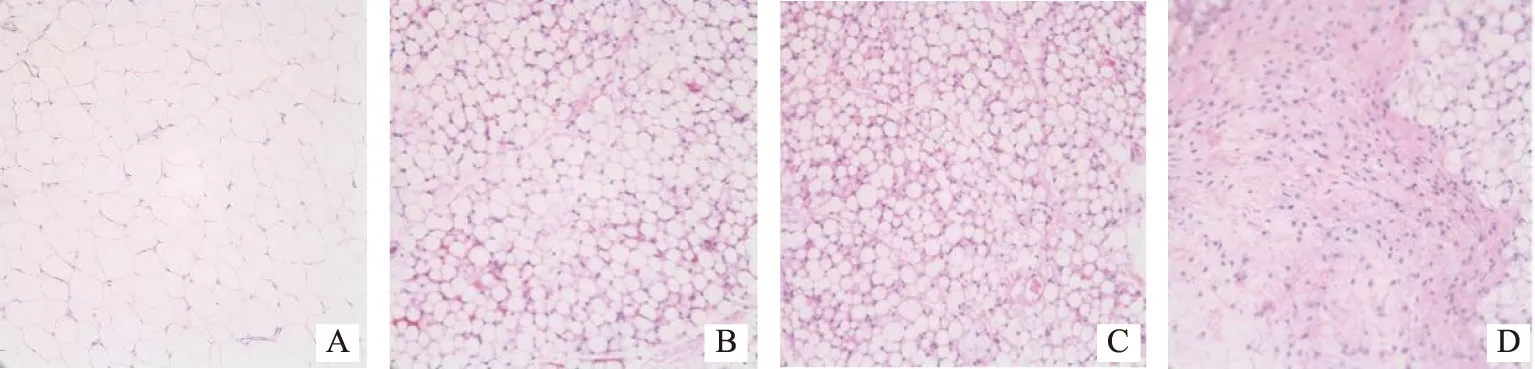
注:A.空白组;B.模型组;C.内消软脉汤低剂量组;D.内消软脉汤高剂量组。

注:A.空白组;B.模型组;C.内消软脉汤低剂量组;D.内消软脉汤高剂量组。

注:A.空白组;B.模型组;C.内消软脉汤低剂量组;D.内消软脉汤高剂量组。

注:A.空白组;B.模型组;C.内消软脉汤低剂量组;D.内消软脉汤高剂量组。

注:A.空白组;B.模型组;C.内消软脉汤低剂量组;D.内消软脉汤高剂量组。
3 讨论
实验结果表明,“内消软脉汤”可以降低ApoE-/-小鼠甘油三酯水平,并使ApoE-/-小鼠的肩胛区、腹股沟区及附睾区的脂肪组织活化增加,说明“内消软脉汤”可以激活棕色脂肪组织,并可以使白色皮下及内脏脂肪组织棕色化,其中白色内脏脂肪组织(附睾区脂肪组织)棕色化的程度小于白色皮下脂肪组织(腹股沟区脂肪组织)。根据实验结果,小鼠脂肪组织UCP1的表达随“内消软脉汤”剂量的增加而具有增加趋势,说明此方可激活UCP1依赖性皮下脂肪活化。
小鼠TG及炎症水平的降低可能均与脂肪组织活化有关。既往研究表明,当脂肪组织活化时,腺苷酸环化为cAMP,激活cAMP依赖蛋白激酶,促进激素敏感性甘油三酯脂肪酶(hormone-sensitive triglyceride lipase,HSL)和细胞质中脂滴包被蛋白1的磷酸化,后者激活脂肪组织内甘油三酯脂肪酶(adipose triglyceride lipase,ATGL),最终在这些酶的作用下,甘油三酯分解为甘油及脂肪酸[12],脂肪酸可出细胞并由血浆清蛋白运输至全身利用,而存在于胞内的脂肪酸则可进一步激活UCP1的活性以促进后期UCP1介导的产热作用。棕色脂肪细胞内富含脂肪酸结合蛋白3(fatty acid binding protein 3,FABP3),甘油三酯分解产生胞内脂肪酸在细胞质内与FABP3结合被转运至线粒体内部[13],进行脂肪酸的β氧化,棕色脂肪细胞线粒体内富含UCP1,可在线粒体内膜上形成质子通道,使内膜细胞质侧的氢质子直接由此通道返回线粒体基质,由于影响了原本氢离子电化学梯度回流而促使释放势能的过程,从而使得氧化与磷酸化解偶联,最终不产生ATP而由热能直接释放[14-15],减少了脂类物质的储存,棕色脂肪组织活化产热严格依赖于UCP1[16],故UCP1是控制肥胖的重要靶点,可使得脂肪活化小鼠的TG水平得以下降。小鼠胆固醇水平的降低机制可能于棕色脂肪细胞活化后提升了胆固醇酯转移蛋白活性,使富含TG的脂蛋白代谢后的残粒向高密度脂蛋白转移增加,从而使胆固醇逆向转运途径效率增加有关[17];还可能于产热脂肪细胞膜活化后,脂肪细胞数量增加,使机体利用胆固醇合成细胞膜增加有关,但具体机制尚需进一步研究。
有研究证据表明,棕色脂肪组织的活化产热严格依赖UCP1[12],另外,激活白色脂肪组织可使之转化成棕色样脂肪组织,或称为米色脂肪(beige)激活,从而发挥产热作用,这一过程同样也依赖UCP1[13]。由此可见,UCP1的激活机制是调控脂肪组织代谢的关键环节,也是研究新型降脂药物的重要靶点。
中医学认为,血脂异常的表现多与“痰”相关[18],过食肥甘厚味损伤脾运而生痰,或素体脾虚,脾失健运,致痰蕴体内,痰湿体质是体内膏脂偏多[19],是代谢紊乱性疾病如脂质代谢异常发生的重要生理病理基础,运用化痰法可改善血脂异常的状态,“内消软脉汤”以二陈汤之陈皮、茯苓、姜半夏燥湿健脾化痰;以白僵蚕、浙贝母、海藻、昆布、橘核、炒白芥子化痰散结,又兼生黄芪、灵芝以健脾益气,扶助正气,助脾胃运化,以绝生痰之源,可通过多方面改善人体血脂异常的状态。“炎症”的成因与性质与中医学中“毒邪”的理论颇为相似,许多研究表明,具有清热解毒作用的单味中药及中药复方均可抑制炎症[20],“内消软脉汤”中以天花粉、夏枯草、玄参、金银花、黄连清热解毒,结合白芷、香附、薄荷,配和僵蚕可升阳中之清阳;姜黄可降阴中之浊阴,一升一降,可以畅通身体内外之气机,可使杂气之流毒顿消。
高脂血症及代谢性炎症对人体健康危害极大,中医药对于这类疾病的治疗具有独特的优势,目前,对于“化痰散结法”的研究已有不少,但对于其具体作用机制的研究不足,“内消软脉汤”作为“化痰散结法”典型方剂,若能明确其作用机制,将会对于开拓中医药治疗心脑血管的新思路,寻找中医药防治高脂血症及代谢性炎症的新靶点,继而进一步提高临床疗效,具有重要意义。

